Erastin诱导人非小细胞肺癌细胞系A549凋亡
2021-09-11姜学东李文雅
姜学东,李文雅
(1.中国人民武装警察部队辽宁省总队医院 胸外科,辽宁 沈阳 110034;2.中国医科大学附属第一医院 胸外科,辽宁 沈阳 110001)
肺癌(lung cancer)在全球范围内是常见的恶性肿瘤之一,其中约85%患者为非小细胞肺癌(non-small cell lung cancer, NSCLC)[1]。人体正常生理功能受机体细胞程序性死亡调节,细胞死亡是维持机体内稳态,预防细胞癌变的重要过程。近来,新的研究发现一种非凋亡性细胞死亡——铁死亡(ferroptosis),其特征是脂质过氧化物积累至致死水平而引起的膜损伤,是一种不同于凋亡、坏死及自噬的另外一种程序性细胞死亡形式[2-3];肺癌组织普遍有着更高的活性氧和脂质氧化标志物活性氧集团(reactive oxygen species, ROS)水平,提示ROS和铁死亡在肺癌中发挥着关键作用[4-6]。众多研究证实,铁死亡与肿瘤[7]、心脑血管疾病[8]等疾病密切相关。
爱拉斯汀(erastin/sorafenib)是一种常用的铁死亡诱导剂,通过抑制谷氨酸/胱氨酸反向转运体xCT的活性,使细胞中半胱氨酸(cysteine,Cys)和谷胱甘肽(glutathione, GS-H)缺乏,进而破坏细胞氧化还原稳态, ROS堆积,进而导致铁死亡的发生[9]。研究证实,小分子erastin介导细胞内ROS累积,诱导NSCLC细胞系N5CP铁死亡,能有效抑制N5CP生长,提示erastin诱导的铁死亡对NSCLC的化疗有积极作用[6]。现已明确ROS可以通过引起细胞损伤,但erastin引起的ROS堆积除了诱导铁死亡外,是否还可调节细胞凋亡尚不明确。本研究就erastin引发肺癌细胞A549的损伤和凋亡机制进行探讨,确定erastin的抑癌作用,以期为肺癌的治疗寻找新的思路。
1 材料与方法
1.1 材料
人非小细胞肺癌细胞系A549(成都飞鸥尔生物科技有限公司);细胞培养基RPMI1640和凋亡抑制剂(Z-VAD-FMK)(Life Technologies, Thermo Fisher Scientific公司);Erastin、staurasporine、N -乙酰基-L-半胱氨酸(N-acetyl-L-cysteine, NAC)、CCK-8试剂盒、annexin V-FITC/PI双染试剂盒和CFSE/PI双染试剂盒(Sigma-Aldrich, Merck公司);铁(Fe)含量检测试剂盒(Biovision公司);ROS活性氧检测试剂盒(北京百奥莱博科技有限公司)。
1.2 方法
1.2.1细胞的分组及处理:培养A549细胞,制备A549细胞悬浮液,调节浓度至1×106细胞/mL,分为对照组(mock组)和处理组(erastin处理/erastin+Z-VAD-FMK/erastin+NAC)。
1.2.2 CCK-8法分析细胞活力:将细胞浓度调节至1×106细胞/mL。将细胞按5 000个/孔接种于96孔平板中,贴壁过夜。在每孔中加入不同浓度的erastin (0.1、1、2、4、6、8、10 μmol/L)。处理24 h后,加入CCK-8反应液,避光37 ℃下培养4 h。用分光光度计读取A450 nm的吸光度值。
1.2.3 铁(Fe)含量检测试剂盒检测铁含量:用不含EDTA的胰蛋白酶重悬细胞,收集1×108个细胞,调整细胞浓度至1×107个/mL,加入0.2 μL Calcein-Am荧光探针,并将细胞放在37 ℃培养箱中继续孵育7 min。孵育结束后,用Hank’s平衡缓冲液冲洗细胞3次,并往体系中加入锥虫蓝(trypan blue)(0.25%终浓度),室温孵育1 min以确定细胞存活率。最后,在488 nm的激发波长和517 nm 的发射波长下测量染色荧光信号。
1.2.4 活性氧检测试剂盒定量分析过氧化物ROS:细胞与羧基-H2DCFDA共培养30 min,去掉培养基,用预冷磷酸盐缓冲液(PBS)清洗2次。用X71(U-RFL-T)荧光显微镜拍摄绿色荧光信号,并用Image J软件进行定量分析。
1.2.5 流式细胞测量术分析细胞凋亡:用annexin V-FITC/PI双重染色法对1×106个细胞进行染色,避光孵育20 min。然后,用预冷PBS清洗细胞3次,加入终浓度1%多聚甲醛PBS并在冰上放置10 min。应用3种激光导航流式细胞仪(Beckman Coulter)定量分析坏死(propidine iodide, PI 阳性)、非凋亡(双阴性)、早期凋亡(annexin V-FITC阳性和PI阴性)和晚期凋亡细胞(双阳性)。
1.2.6 免疫印迹(Western blot)检测相关剪切蛋白:用10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)对20 μg总蛋白进行分离,并将免疫印迹转移到硝酸纤维素(PVDF)上,用含5%牛血清白蛋白的PBS (BSA, Sigma-Aldrich, Merck)封闭。将抗体按1∶1 000比例稀释,加入到PVDF膜上室温孵育1 h。用预冷的T-PBS清洗PVDF膜,然后用1∶5 000稀释的辣根过氧化物酶(horse radish peroxidase, HRP)偶联抗兔二抗与PVDF膜室温孵育30 min。经过3次T-PBS清洗后,用X线片曝光。
1.2.7 CFSE/PI双染色检测细胞凋亡:在erastin处理A549细胞的同时加入ROS清除剂NAC,共同处理后用CFSE/PI双染检测,检测过程为:将1×106个细胞接种于6个孔板中,并贴壁过夜。加入100 μL CFSE荧光染料, 在37 ℃下培养15 min。去除上清液,用无菌培养基清洗细胞去除残留的CFSE。Erastin处理细胞后,加入5 μg/mL的PI室温孵育10 min,去除上清液,用无菌培养基清洗细胞去除残留的PI。最后,用X71荧光显微镜拍摄荧光照片。
1.3 统计学分析
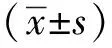
2 结果
2.1 Erastin诱导A549细胞损伤
随着erastin浓度增加,A549细胞活力降低(图1A)(P<0.05);10 μmol/L erastin处理A549细胞24 h后引起了铁凋亡的典型表型:铁离子含量大量升高(图1B)(P<0.05),并产生大量过氧化物(图1C)(P<0.05);PI染色阳性细胞(死亡细胞)比率显著升高(图1D)(P<0.05)。
2.2 Erastin诱导A549细胞凋亡
凋亡抑制剂Z-VAD-FMK以不可逆的形式与活化的半胱氨酸蛋白酶caspases结合,从而阻断细胞凋亡。加入Z-VAD-FMK后,erastin引起的A549细胞凋亡减少(图2A);活化型半胱氨酸天冬氨酸蛋白酶-3(cleaved-caspase-3)和cleaved-caspase-9表达量减少(图2B)。
2.3 Erastin引起ROS增加诱导细胞凋亡
Annexin V-FITC/PI双染显示,erastin组A549细胞凋亡率增加,而erastin/NAC组A549凋亡率降低(图3)。

A.CCK-8 kit was used to detect the inhibitory rate of A549 cells treated with different concentrations of erastin; B.A549 cells were treated with 10 μmol/L erastin for different time (0, 12 and 24 hours) to detect the content of iron, *P<0.05 compared with 0 hour; C.ROS content was analyzed after A549 cells were treated with 10 μmol/L erastin for different time (0, 12 and 24 hours),*P<0.05 compared with 0 hour, #P<0.05 compared with 0 hour; D.the ratio of dead cells was detected by PI staining after A549 cells were treated with 10 μmol/L erastin or 10 μmol/L staurosporine for different time (0 and 12 hours), *P<0.05 compared with mock group; #P<0.05 compared with mock group
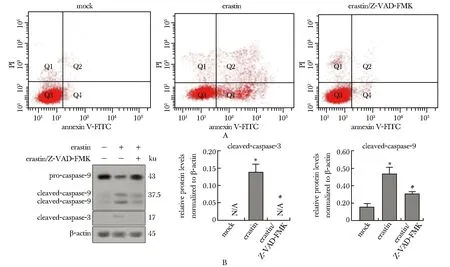
N/A.not applicable; A.A549 cells were treated with Z-VAD-FMK and erastin, and cells apoptosis were detected by annexin V-FITC/PI staining; B.Western blot was used to detect the splicing of caspase-9 related proteins in A549 cells after the addition of V-ZAD-FMK and erastin; *P<0.05 compared with mock group; #P<0.05 compared with erastin/Z-VAD-FMK group
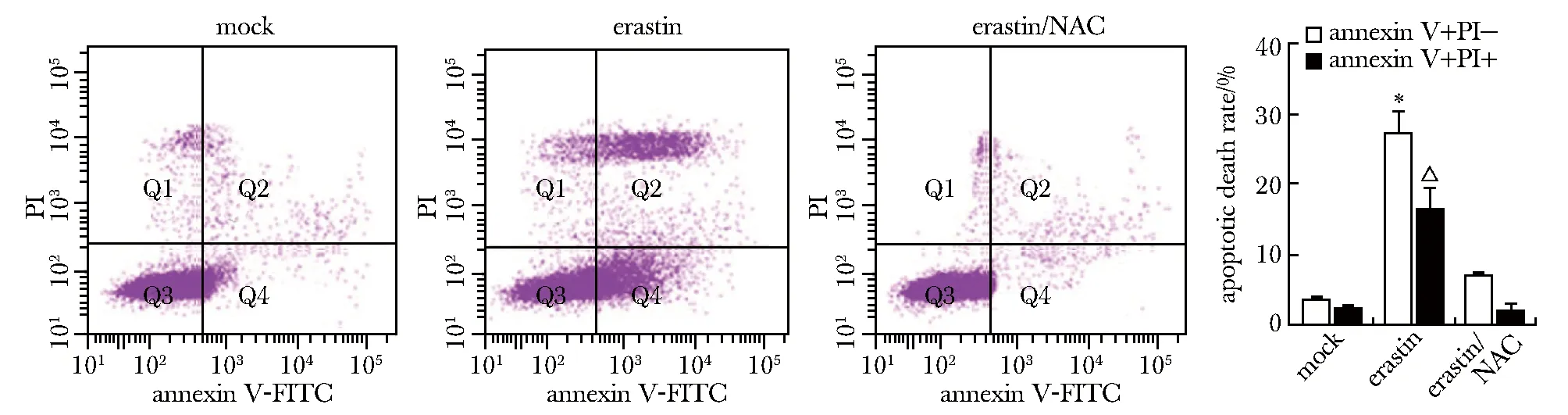
A549 cells were treated with NAC and erastin, and cells apoptosis were detected by annexin V-FITC/PI double staining; *P<0.05,△P<0.05 represent comparisons to mock groups, respectively
3 讨论
细胞的凋亡与细胞内caspase激活和过度氧化有关[10]。Erastin是典型的铁死亡诱导剂,通过引起ROS堆积而引起铁死亡;同时,ROS通过细胞氧化应激反应诱导细胞凋亡,产生细胞毒性作用[11]。ROS、铁死亡和细胞凋亡与肺癌的发病密切相关,但erastin引起肺癌细胞死亡的机制尚未明确。先前的研究表明,用erastin治疗抗辐射细胞A549-R,通过诱导谷胱甘肽过氧化物酶4 (glutathion peroxidase 4, GPX4)介导的铁蛋白作用,增强了A549-R的辐射敏感性,该研究证实erastin对非小细胞肺癌细胞A549具有辅助治疗作用[12]。本研究通过检测erastin处理A549细胞后细胞活力、铁离子和ROC含量,证实erastin可诱导A549细胞损伤和凋亡。随后,课题组通过研究凋亡抑制剂Z-VAD-FMK的干预,在erastin处理A549细胞后加入Z-VAD-FMK,发现细胞凋亡和活化型caspase-9和caspase-3蛋白含量均减少,证实erastin可诱导A549细胞凋亡;为了进一步论证erastin引起A549细胞凋亡的机制,本实验又加入ROS清除剂N -乙酰基-L-半胱氨酸(N-acetyl-L-cysteine, NAC),证实erastin可使细胞内ROS产生增加从而诱导A549细胞凋亡。已有研究表明erastin引起ROS积累增加和p53激活,从而诱导非小细胞肺癌细胞系A549铁死亡和细胞凋亡[13]。本研究结果先论证了erastin对非小细胞肺癌细胞系A549的正向杀伤和诱导凋亡的作用,然后论证其抑制A549作用的机制是通过增加细胞内ROS产生所致,这一结果与最新的国内外研究结果一致。
综上所述,本研究证实erastin通过诱导非小细胞肺癌细胞内ROS产生,引起细胞凋亡,说明erastin对A549的细胞毒性作用同时来源于介导了铁死亡和凋亡过程,并最终达到抗肿瘤作用。本研究实验设计简洁、严谨,为肺癌的发生机制的阐述提供了新的视角,为肺癌的治疗寻找了潜在的靶点。
