基于碳点与适配体的荧光生物传感器制备与应用
2021-09-03朱志承
朱志承,杨 柏
(吉林大学化学学院 超分子结构与材料国家重点实验室,吉林 长春 130012)
1 引 言
随着科学技术的发展,传统的检测方式难以满足人们在环境监测、临床诊断、生物检测方面的信息获取需求,如何制备与发展新型传感器以求对生物分子及金属离子实现快速灵敏检测是亟待解决的问题。近年来,基于荧光的传感技术因其灵敏度高、响应时间短、成本低廉、检测方便等优点受到了广泛关注。研究者们设计开发了多种荧光传感材料,其中常用的荧光基元包括有机荧光染料[1]、半导体量子点[2]和稀土荧光材料[3],同时还有其他荧光材料如荧光蛋白、有机聚合物点和AIE纳米点。但是在实际应用的过程中,研究者们发现这些材料都有着固有的、难以克服的缺陷。例如,有机荧光染料存在着光稳定性差、寿命短以及斯托克斯位移小的问题,而当研究者们尝试将量子点与稀土荧光材料作为替代的荧光基元时,它们的高毒性以及高成本又成为了实际应用的巨大阻碍。因此,开发一种合适的荧光基元是荧光生物传感器制备的关键之一。碳点(Carbon dots, CDs)作为一种新型荧光纳米材料[4],由于其独特的物理化学性质及结构特征,在生物标记成像、传感、防伪、光电设备以及催化领域获得了广泛的关注。在荧光传感方面,相较于传统的有机荧光染料、半导体量子点以及稀土荧光材料,碳点具有光学性质突出、生物相容性好、毒性低、制备简单等特点,这使得碳点被广泛地应用于生物成像与生物检测的荧光生物传感器制备当中[5]。
荧光生物传感器有两个关键组成部分:目标识别和信号转导模块。目标识别依靠的是探针与目标物质的特异性结合能力,如离子对结合[6]、抗原抗体[7]、核酸杂交[8]、酶与底物相互作用[9]等,目前常用的识别材料有抗体、酶和适配体(Aptamer,Apt)[5,10]。信号转导则是传感器将目标识别过程中所产生的物理化学变化转换为可检测的荧光信号,纳米粒子是目前常用的转导材料[11]。对碳点与适配体构造的荧光生物传感器而言,目标识别的过程由适配体与目标物质的特异性结合完成,通过检测结合前后碳点荧光行为(荧光强度、发射波长、荧光寿命等)的变化则可以实现信号的转导[5]。本文将对基于碳点与适配体构建的荧光生物传感器发展现状进行总结,先简要介绍碳点及适配体的结构与性质特点,然后着重总结近年来基于碳点与适配体的荧光生物传感器的构建方式、传感机理及应用范围。
2 碳点的制备与性质
碳点是一种尺寸小于10 nm的新型零维碳基纳米材料,在2004年由Xu等首次通过物理方式从电弧放电产生的烟灰中纯化得到[4]。两年后,Sun等通过激光烧蚀法以石墨靶为碳源合成出荧光碳纳米颗粒,并首次将其命名为碳点[12]。随着研究的进行,人们发展了“自上而下”和“自下而上”的制备途径[13-14]。“自上而下”法主要是通过氧化与剥离的方式切割具有大块sp2碳结构的石墨基材料,例如石墨粉、碳纳米管、碳纤维、炭黑等[14]。涉及的主要方法有电弧放电[4]、激光烧蚀[12,15]、电化学氧化[16-17]、化学刻蚀[18-19]等。由“自上而下”法制备出的碳点结构较为清晰,易于进行发光机制与结构特征的研究,但其制备过程复杂,荧光量子产率较低,往往需要进行后处理钝化[20],且原料来源单一,元素组成单调,这大大阻碍了碳点的进一步发展。2013年,我们课题组Zhu等以柠檬酸、乙二胺为原料,采用一步水热的方法制备出具有超高荧光量子产率(80%)的聚合物类碳点材料[21],实现了碳点在荧光效率上的突破。自此之后,这种由小分子为原料出发的“自下而上”法广泛地应用于碳点的合成之中,碳点的结构与性能获得了极大的丰富。“自下而上”法制备碳点通常涉及聚合、交联、碳化的过程[22],其具体制备方法主要包括水热/溶剂热法[21,23-25]、热解法[6]、微波辅助法[26-27]以及模板法[28-29]。由“自下而上”法制备的碳点具有结构组成独特、荧光性质突出、加工性能优异等特点。
由于合成方式与前体材料的多样化,碳点材料具有多种结构特征,因此碳点是一大类材料的统称。虽然目前关于碳点的分类仍有争论,但人们逐渐接受将碳点依据结构特征分为石墨烯量子点(Graphene quantum dots,GQDs)、碳量子点(Carbon quantum dots,CQDs)以及碳化聚合物点(Carbonized polymer dots,CPDs)[22,30-32]。GQDs是由单层或小于5层的石墨片层构成的具有各向异性的二维纳米材料,其表面或边缘连接有化学基团。CQDs的提出参考了传统量子点的概念,但研究发现两者在合成与结构、性质与应用方面有着较大差异,不能一概而论[33]。GQDs的发光行为主要受碳核上的π共轭域及表面化学基团影响。CQDs通常具有三维类球形结构,其横向尺寸与纵向尺寸类似,可以通过“自上而下”法从大块碳材料上剥落,也可由具有周期性高度对称结构的小分子通过“自下而上”法合成[22]。由小分子或聚合物通过“自下而上”的方式合成的碳点大部分属于CPDs的范畴,其形成过程会经历聚合与碳化两个阶段,随着碳化程度的增加,CPDs表面的功能基团或聚合物链逐渐减少,碳核内部的结晶度逐渐升高,最后形成结晶度较高的CQDs[22,31]。因此CPDs是适度交联、适度碳化的表面存在聚合物短链与官能基团,内部轻微石墨化的具有核壳结构的类球状功能材料。CPDs的概念由我们课题组提出,其很好地阐述了碳点的形成过程与结构特征,我们课题组近期也通过多种表征手段证明了CPDs表面的聚合物链结构[23]。CPDs的合成前体物质多样,不仅可以选择小分子、聚合物,还可选择天然产物作为前体物质,通过设计不同的前体物质与反应条件,可以实现B、N、O、S、金属离子等多种元素掺杂,这使得碳化聚合物点的性能更加多样化。
碳点优异的荧光性质是其最引人入胜之处,例如较强的光吸收、高荧光量子产率、可调的荧光发射以及抗光猝灭性等。不同种类碳点的荧光吸收与荧光发射行为有着较大的差别,这些差别主要源于不同的前体原料与合成方法,它们会导致碳点具有不同的碳核结构和表面基团[30]。例如,Jiang等以苯二胺的邻间对同分异构体为原料,通过溶剂法合成了分别具有红绿蓝三种荧光发射的碳点材料[24]。这三种碳点具有相似的表面基团结构,但粒径与含氮量有着较大区别,随着荧光发射波长的红移,碳点的粒径与含氮量逐渐升高(图1(a))。除了改变前体原料种类,碳点的荧光发射还可以通过调节反应物的比例和反应条件来调节。如图1(b)所示,Miao等通过柠檬酸和尿素的热裂解合成了多色发光碳点[25]。他们通过控制柠檬酸/尿素的比例和反应温度等反应条件实现了碳点荧光发射由蓝到红的可控调节。经过多种仪器表征之后,他们认为碳核内有效共轭长度和碳点表面官能团数量的增加是碳点荧光由蓝到红转移的关键。除了可调的荧光发射,Tao等以聚丙烯酸与乙二胺为原料实现了无金属室温磷光发射碳点材料的制备,并在研究中详细验证了交联增强发射效应对碳点室温磷光发射的影响[34](图1(c))。另一方面,具有超窄荧光发射半峰宽碳点的制备近期也取得了很大进展。Liu等以红豆杉干叶为原料制备了半宽峰达到20 nm、荧光量子产率达到59%的深红色发光CPDs,并成功应用于生物成像[23](图1(d))。由于碳点有着光学性能出色、结构性质优异、生物相容性好及易制备的性质,在生物医药、防伪、传感、催化、发光二极管、光伏器件等领域有着广泛的应用前景[30,32,35-37]。

图1 (a)(ⅰ)用3种不同的苯二胺异构体制备红绿蓝三色CDs,(ⅱ)m-CDs、o-CDs和p-CDs在日光下(左)和λ=365 nm紫外线照射下(右)的照片[24];(b)不同CA/尿素量比和不同反应温度下CDs的最大发射峰位[25];(c)用于图形安全和数字信息加密的RTP CPDs[34];(d)具有超窄半峰宽的深红荧色发射CPDs的合成过程和PL光谱[23]。
3 适配体
Ellington和 Tuerk 在1990年分别独立地创建了体外指数富集配体的系统进化技术[38-39](Systematic evolution of ligands by exponential enrichment process,SELEX),并首次提出了适配体的概念。适配体是一种与靶标有强亲和力且可以特异性结合的核苷酸单链,通常有功能性DNA单链与功能性RNA单链两种类型,它们可以通过碱基互补配对作用、氢键作用以及范德华力等作用力折叠成明确三维结构,通过空间构型互补与目标分子进行特异性结合[40]。适配体的出现极大地丰富了生物检测的范围与手段,在此之前生物传感平台的建立主要依靠抗体与酶,但它们对生物样品的分析有很大的局限性,难以分析有毒小分子、非免疫原性目标、结构相近的大分子目标等。相对于使用抗体和酶的生物传感器,基于适配体的生物传感器具有前所未有的优势[41]:首先,适配体结构灵活、设计方便,理论上来讲可以在体外对任何给定的目标物质进行特异性选择。其次,筛选出的适配体可以在体外通过聚合酶链式反应(PCR)等技术进行快速增殖,且产品的重复性好、纯度高。再者,相对于抗体与酶,适配体在复杂环境中的化学性质更加稳定,对于温度等条件的敏感度更低。最后,相比于抗体,适配体更易穿透组织,且由于其尺寸较小,不易引起免疫反应,更加适合于临床应用。适配体的靶标十分广泛,包括金属离子[42-44]、有机分子[43, 45-46]、蛋白质[47-49],甚至整个细胞或微生物[50-51]。
适配体对靶标的特异性识别作用只是传感过程中的目标识别部分,如何将探针与靶标结合前后的变化通过可测信号转导出来同样是传感过程的关键问题。近年来,纳米材料与适配体偶联构建生物传感器引起了研究者们极大的兴趣。由于纳米材料特有的光学、电学、磁性和催化特性,将适配体与纳米材料偶联之后,可以通过检测传感器与靶标结合之后纳米粒子的光、电、磁等特性变化来实现靶标的可测传感,常见的纳米材料有金纳米颗粒[52-53]、碳纳米管[11]、量子点[54]、磁性纳米颗粒[45,48]、碳点[47-49]等。本文将着眼于由碳点与适配体构建的荧光生物传感器,着重对其构建方式、传感机理以及具体应用进行介绍。
4 基于碳点与适配体的荧光生物传感器构建
构建荧光生物传感器的荧光探针应具有灵敏度高、选择性好、操作方便、不易受电磁作用干扰、能够对靶标进行原位实时无损分析的特点。碳点相对于有机荧光分子、半导体量子点及稀土荧光材料等传统荧光材料,具有荧光性质稳定、斯托克斯位移大、生物相容性好、毒性低、表面易修饰等优势,是理想的荧光传感器构筑基元[5]。利用荧光碳点与适配体构建生物传感器已经成为了荧光传感领域的研究热点。选用碳点作为荧光生物传感器的信号转导模块、适配体作为目标识别模块时,如何将碳点与适配体进行偶联,以及以什么样的信号转导方式传递靶标结合信号成为了问题的关键。结合近年来的文献来看,碳点与适配体的偶联主要有两种方式:标记法与免标记法,下面我们将分别对其进行介绍。
4.1 标记法
标记法是将碳点与适配体之间通过共价键进行连接,连接过后,碳点与适配体成为一个整体(CDs-Apt),这种方法的好处在于传感过程明晰,靶标与适配体的作用将直接影响到碳点荧光信号的变化,且传感器不易受外界复杂环境的影响。应该注意的是,单一的由碳点与适配体共价键连接所构成的荧光生物传感器难以实现信号的有效转导,还需要其他物质的配合。其中一种方式是利用金银纳米粒子[55-56]、氧化石墨烯[44,57-65]、金属化合物片[66-68]、磁纳米粒子[69]、碳点[70]等纳米粒子对CDs-Apt荧光的猝灭作用实现对碳点荧光行为的控制。具体方式是将纳米粒子与CDs-Apt于一个体系中混合,CDs-Apt中的寡核苷酸链会通过碱基配对作用力、静电作用力或氢键作用力与以上物质结合并与纳米粒子通过一定作用方式使得碳点荧光发生猝灭。当体系中存在靶标分子时,靶标与上述纳米粒子会发生竞争反应,由于适配体与靶标的特异性结合作用和强亲和力,CDs-Apt会与上述纳米粒子脱离,进而使得碳点荧光恢复,通过检测结合前后体系的荧光变化来实现信号的转导(on-off-on模式)。另一类方式是利用适配体将靶标与碳点一同固定在某一纳米粒子之上[71],通过检测结合前后纳米粒子的荧光增强程度来实现靶标物质的定量检测。例如,Qaddare等以组氨酸为原料,采用一步水热的方法制备了具有蓝色荧光发射的碳点,利用金纳米粒子(AuNPs)与碳点之间的荧光共振能量转移作用,将AuNPs作为碳点荧光的猝灭剂,成功制造了一种用于检测HIV相关DNA序列的超灵敏均质生物传感器[55]。作者将5’端氨基修饰的寡脱氧核苷酸通过共价键连接到碳点表面,在靶标存在的情况下,该荧光探针会从AuNPs表面释放出来,从而恢复碳点的荧光(图2(a))。得益于氧化石墨烯(GO)良好的水溶性、优异的荧光猝灭能力以及较强的吸附能力,GO经常被用作荧光猝灭剂[58-59]。Chen等基于CDs、Aptamer与GO构建了一种荧光传感器并将其用于三磷酸腺苷(ATP)的检测[62]。碳点经适配体修饰后形成的CDs-Apt通过π-π堆积与疏水相互作用力吸附在GO表面,并通过CDs与GO之间的荧光共振能量转移(FRET)过程猝灭CDs-Apt荧光。在ATP的存在下,它将与适配体结合进而将CDs-Apt从GO表面解离,抑制FRET过程,从而恢复了碳点的荧光。在最佳条件下,检测限为80 pmol/L,ATP浓度在0.1~5 nmol/L范围内与碳点荧光强度呈线性变化(图2(b))。除了石墨烯纳米片,金属化合物的纳米片也可以用作荧光猝灭剂,如图2(c)所示,Saberi等利用CDs、Aptamer与氢氧化钴(CoOOH)纳米片之间的相互作用,设计了一种简单的荧光双功能感应传感器,可同时检测溶菌酶(LYS)和三磷酸腺苷(ATP)[68]。通过CoOOH对碳点荧光的猝灭作用以及Aptamer对靶标的特异性吸附,实现碳点荧光的“on-off-on”变化。在最佳条件下,ATP和LYS的检出限分别为4.0 nmol/L和1.8 nmol/L。除了荧光共振能量转移作用导致的碳点荧光猝灭以外,由碳点聚集所导致的荧光猝灭行为也可用于荧光生物传感器的构建。Jiao等研究开发了一种基于核酸适配体介导的碳量子点(CQDs-Apt)纳米聚合体的新型生物传感器,用于啶虫脒的检测[70]。作者将啶虫脒适配体及其互补DNA在5’端修饰后分别标记在CQDs上。适配体与其互补DNA的杂交引发了CQDs纳米聚集体的形成,导致CQDs的荧光猝灭。加入啶虫脒后,适配体对啶虫脒的特异性识别引起cDNA-CQDs的释放,碳点荧光恢复,且荧光强度与啶虫脒的浓度呈线性相关。传感器对啶虫脒的线性范围为0.2~20 ng/L,检测限为0.04 ng/L(图2(d))。磁纳米粒子也可以猝灭碳点荧光,Ma等建立了一种基于多碳点和核酸适配体的信号放大比率荧光探针用于检测蛋白酪氨酸激酶7(PTK7)[69]。作者分别选择适配体修饰的黄色荧光发射碳点y-CDs和蓝色荧光发射碳点b-CDs作为信号检测单元和内部标记单元。在没有PTK7的情况下,将y-CDs修饰的适配体和cDNA修饰的Fe3O4MNPs组装在一起,y-CDs的荧光被Fe3O4MNPs猝灭,加入PTK7后荧光恢复。经过信号放大后,该传感器对PTK7的检测限可低至0.016 ng/mL(图2(e))。对于另外一类信号转导方式,虽然也是检测碳点荧光强度变化,但少了荧光猝灭的过程。如图2(f) 所示,Xu等将硅纳米粒子与碳点通过适配体功能化,构筑了凝血酶的荧光传感平台[71]。当凝血酶不存在时,碳点与硅纳米粒子之间不存在相互作用,通过离心作用可以将碳点除去;但当凝血酶存在时,它可以通过与适配体的特异性相互作用,诱导适配体修饰的荧光CDs与适配体功能化的二氧化硅纳米颗粒形成三明治结构,进而实现对凝血酶的灵敏传感。
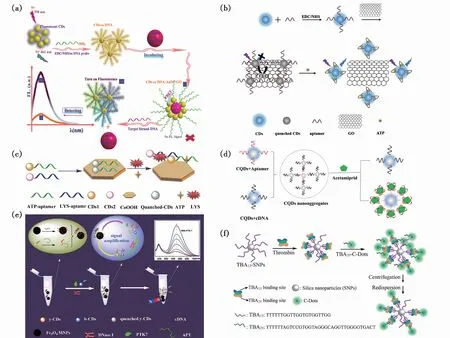
图2 标记法构建荧光生物传感器。 (a)基于AuNPs和CDs-Apt的检测系统构建方法[55];(b)基于CDs-Apt和GO之间的FRET作用检测ATP示意图[62];(c)荧光生物传感器对ATP和LYS检测示意图[68];(d)基于ACQ效应的生物传感器用于啶虫脒检测示意图[70];(e)比值荧光探针的制备工艺及用于PTK7检测的原理[69];(f)“三明治”结构荧光传感器检测凝血酶原理示意图[71]。
4.2 免标记法
相较于标记法,免标记的方法更加方便,且成本更低[42,72-74]。与标记法依靠共价键将碳点与适配体链接为一个整体的作用方式不同,免标记法是通过分子间的作用力,如范德华力、氢键作用力、π-π堆叠等将碳点与适配体通过物理方式进行偶联(CDs/Apt)[75]。这种偶联是可逆的,当适配体的靶标出现时,这种偶联将会被打破,碳点荧光行为发生变化,进而实现信号的转导。采用物理偶联的方式对适配体空间结构的影响最小,几乎可以忽略不计,这对适配体实现其特异性识别功能是非常有利的[40]。因此,采用免标记的方法构建的荧光生物传感器具有简单、快速、灵敏的特点。由于适配体表面是显负电性的,采用免标记法构建荧光生物传感器时,碳点的表面状态需要特殊注意,在合成或后修饰过程中要在不影响荧光性质的前提下将碳点表面的电荷状态调成正电性,这将更加利于物理偶联[42,74]。如图3(a) 所示,Saberi等开发了一种基于核酸适配体的荧光法灵敏检测农药啶虫脒的方法。他们以西曲溴铵(CTAB)为原料,采用一步水热的方法合成了具有蓝色荧光的阳离子碳点(cCDs)[74]。在带有负电荷的啶虫脒适配体存在的情况下,适配体由于静电吸引而结合在cCDs表面,cCDs荧光被部分猝灭。在体系中加入啶虫脒后,适配体与靶标结合,进而使得cCDs荧光恢复,且荧光强度随啶虫脒的浓度线性增加。该方法的检出限为0.3 nmol/L,动态范围为1.6~120 nmol/L,与其他方法相比具有较高的灵敏度。通过后修饰的方式也可以实现对碳点表面状态的改变,Kong等以柠檬酸、乙二胺为原料,通过一步水热法合成表面带有负电荷的碳点,将该CDs与带正电的聚乙烯亚胺(PEI)进行组装,然后通过静电相互作用与DNA适配体AS1411结合,形成CDs-PEI-AS1411纳米复合物,并成功应用于肿瘤细胞的靶向成像[73]。在这项工作中,由于PEI的组装,细胞膜对该纳米复合物的通透性更好,且碳点毒性较低,进入细胞后不会引起细胞的行为变化(图3(b))。
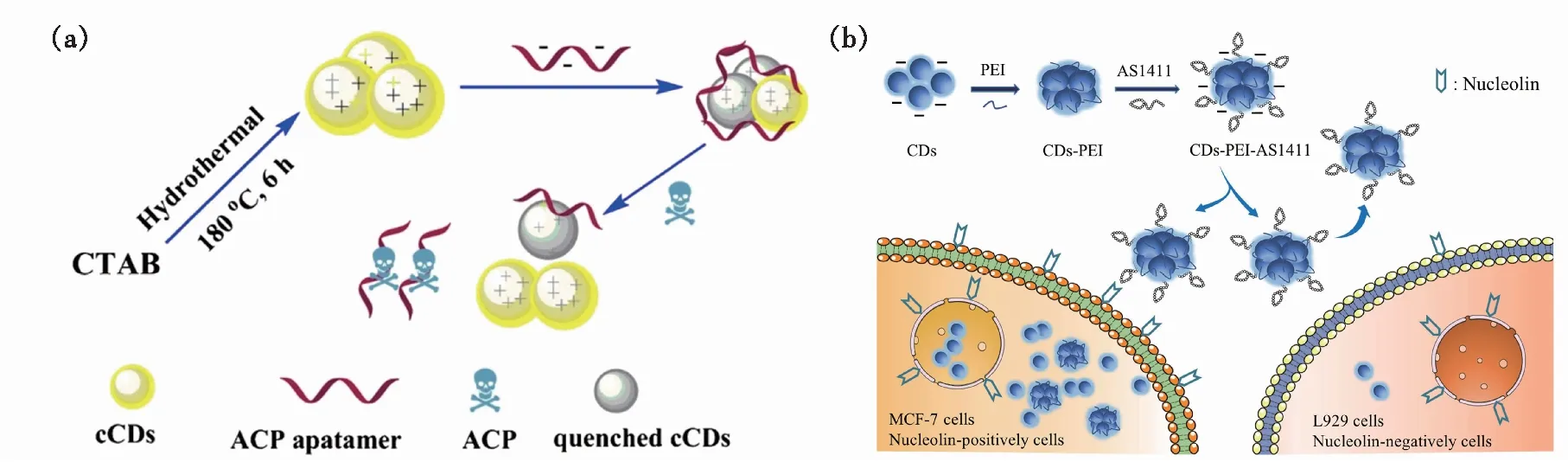
图3 免标记法构建的荧光生物传感器。 (a)检测啶虫脒的荧光生物传感器示意图[74];(b)CDs-PEI-AS1411检测癌症的原理示意图[73]。
5 基于碳点与适配体的荧光生物传感器传感原理
基于碳点与适配体的荧光生物传感器的构建方式已经在上文进行了详细介绍,不难发现,无论是使用标记法还是免标记法构建的荧光生物传感器,在信号转导时大部分会涉及到荧光的猝灭与恢复过程。目前基于碳点与适配体构建的荧光生物传感器的传感机理主要有以下四种:荧光共振能量转移(Fluorescent resonance energy transfer,FRET)、内滤效应(Internal filter effect,IFE)、光致电荷转移(Photo-induced electron transfer,PET)和聚集诱导猝灭效应(Aggregation-caused quenching,ACQ)。
5.1 荧光共振能量转移
荧光共振能量转移过程是福斯特共振能量转移(Förster resonance energy transfer)的一种形式,它指的是能量供体与受体之间的非辐射能量转移过程[76]。FRET过程的发生需要一定的条件:首先,供体与受体间要存在偶极-偶极的相对取向;其次,能量供体与受体之间要存在合适的距离,一般为2~8 nm;再者,供体发射光谱与受体吸收光谱重叠度要高。只有满足这三个条件,FRET过程才能有效进行。在基于碳点与适配体构建的荧光生物传感器中,能量供体是荧光碳点,受体则有多种选择,如金/银纳米粒子、氧化石墨烯、金属化合物纳米片、碳点、有机荧光分子[77]等。FRET过程中最常用的受体是氧化石墨烯,近期Zhou等利用适配体功能化的CQDs和氧化石墨烯(GO)设计了一种基于FRET效应的荧光生物传感器,用于灵敏且特异性地检测贝类过敏原[61]。利用GO对适配体的强吸收作用以及对CQDs荧光的强猝灭作用,通过检测加入GO与靶标前后碳点的“on-off-on”荧光强度变化,实现了对贝类过敏原的定量检测(图4(a))。
5.2 内滤效应
内滤效应是指当荧光体与其他吸光物质共存时,由于吸光物质对于激发光或发射光的吸收而导致荧光体荧光减弱的现象[78-80]。IFE过程也依赖于荧光团和受体之间的光谱重叠,但与FRET过程不同的是,IFE过程来源于辐射能量传递,供体的能量扰动主要发生在基态。因此,在IFE过程中只观察到荧光猝灭,荧光寿命没有明显变化。此外,IFE与FRET的另一个主要区别在于在IFE过程中能量的供体与受体之间没有距离限制。由于金纳米粒子(AuNPs)有着高消光系数和宽吸收峰,常被用作IFE过程的受体材料。Qin等以柠檬酸钠为原料,采用一步水热法制备了具有蓝色荧光发射的碳点,基于金纳米粒子(AuNPs)在不同聚集状态下对碳点荧光猝灭程度不同的原理,通过适配体来调控AuNPs的聚集状态,在碳点的配合下构建了一种简便、新颖的用于灵敏检测啶虫脒的免标记荧光传感平台[81]。没有靶标存在时,适配体将聚集在AuNPs表面,使得AuNPs在溶液中保持隔离与稳定,通过内滤效应,AuNPs将对CDs荧光有效猝灭。当靶标存在时,适配体将会在靶标的竞争作用下从AuNPs表面脱离,进而使得AuNPs产生聚集而减弱内滤效应,碳点荧光会逐步恢复(图4(b))。
深静脉血栓的预防分为药物预防和非药物预防。药物预防,包括肝素、低分子肝素、华法令等药物使用,根据不同患者选择合适药物应用。研究显示,依诺肝素应用使腹部大手术围手术期血栓发生率更低[18] ,他汀类药物可以有效预防血栓发生[19] 。但药物使用存在出血风险,有出血风险和出血倾向患者则不能使用,尤其是部分危重病患者使用抗凝药物存在禁忌症。非药物预防,包括早期活动[20] 、增加被动运动、压力梯度长袜、气压泵应用[21] 等,为避免出血风险发生或存在药物应用禁忌症,可选择使用非药物预防方法,联合使用多种非药物预防方法,亦可达到很好预防效果。
5.3 光致电荷转移
光致电荷转移是指在光的作用下,电子在供体与受体之间传递的现象[44,80,82-83]。在PET过程中基态和激发态分子都可以是电子供体,也都可以是电子受体。当激发光照射到探针分子上,电子从供体转移到激发态荧光团上,导致激发态分子失活,光能转变为化学能。有一点需要注意的是,PET过程的发生需要供体与受体之间存在键连作用,以提供电子近距离转移通道。Miao等利用番茄汁为碳源,构建了一种快速绿色合成蓝色荧光发射碳点的策略,并且作者基于适配体在CDs表面通过竞争机制吸附和解吸的原理,提出了一种连续、可循环的无标记敏感检测癌胚抗原的方法[72]。作者对体系中CDs/Apt复合体进行表面电荷及透射电镜表征,确定了适配体对CDs的荧光猝灭机制来自于光致电荷转移过程,而非聚集诱导猝灭效应(图4(c))。
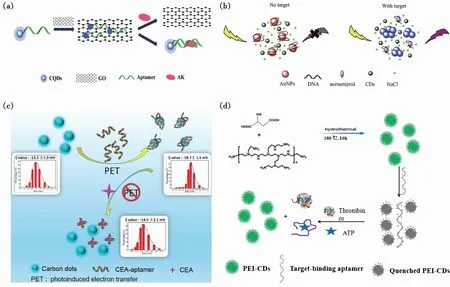
图4 荧光生物传感器的传感机理。 (a)基于FRET效应检测AK的荧光传感方案示意图[61];(b)基于IFE效应的啶虫脒检测原理示意图[81];(c)基于PET原理检测CEA的示意图[72];(d)基于ACQ机制的凝血酶和ATP检测原理示意图[49]。
5.4 聚集诱导猝灭效应
荧光体在稀溶液中具有较高荧光强度,但在浓溶液或者固态下荧光强度降低甚至消失的现象称为聚集诱导猝灭效应[7,70]。多数研究认为ACQ现象的产生是由于荧光分子在浓度升高后会由于分子间的碰撞与堆叠产生自猝灭,或者由于浓度升高后体系中猝灭剂与荧光团的相互作用。π-π堆叠、氢键作用、疏水效应和静电作用都会对这个过程产生影响。利用碳点的ACQ效应构建荧光生物传感器十分常见,例如Guo等以苹果酸和聚乙烯亚胺为前驱体制备了具有明亮绿色荧光的聚乙烯亚胺碳量子点(PEI-CDs),在生理pH值下,PEI-CDs表面呈正电性,在静电作用力下与表面呈电负性的适配体结合而产生聚集,荧光被猝灭[49]。在体系中加入靶标之后,适配体与靶标的特异性紧密结合使得PEI-CDs被释放,碳点荧光恢复。在优化条件下,以该传感机制构建的荧光生物传感器可以分别对凝血酶和ATP实现1.2 nmol/L和13 nmol/L的灵敏检测(图4(d))。
6 基于碳点与适配体的荧光生物传感器应用
碳点优异的光学性质结合适配体出色的识别能力完美地构建了纳米传感器的目标识别模块和信号转导模块。时至今日,基于碳点与适配体构建的荧光生物传感器在金属离子、有机分子、核酸、蛋白质乃至细胞的灵敏传感领域取得了丰硕成果,极大地丰富了人类在环境监测、生物检测以及疾病诊疗过程中的检测手段。
6.1 检测金属离子
金属离子在自然界中广泛存在,无论是对环境监测还是人体健康检测而言,对它的灵敏传感都显得尤为重要。传统的检测方法为电感耦合等离子体质谱法和原子吸收/发射光谱法,但这两种检测设备都需要昂贵的设备以及复杂的检测程序,不能满足常规监测中速度快、成本低的需求[43-44]。基于碳点与适配体的荧光生物传感器可以利用适配体对金属离子的特异性吸附作用,实现对金属离子的nmol/L级检测。Srinivasan开发了一种基于MoS2纳米片、适配体和碳点通过纳米组装而成的荧光传感器,用于检测环境样品中的Hg2+[66]。作者以蜂蜜为原料通过一步水热法制备了具有蓝色荧光发射的碳点,碳点通过共价键作用与适配体结合,构成了一种高效的荧光探针(CDs-Apt)。得益于MoS2纳米片优异的荧光猝灭性能,CDs-Apt吸附在MoS2纳米片上后会通过二者间的FRET过程产生荧光猝灭。而伴随着Hg2+的加入,Hg2+会与适配体上的裸露碱基强烈作用,进而导致CDs-Apt与MoS2纳米片的脱附,抑制了FRET过程,碳点荧光得以逐步恢复。该荧光传感器可实现0~10 nmol/L内Hg2+的灵敏传感。此外,该传感系统的回收实验显示了良好的汞离子回收率(图5(a))。经过研究发现,在适配体对金属离子的特异性识别过程中,适配体的寡核苷酸单链会通过盘曲折叠与金属离子形成G-quartet复合结构。例如,Qian等报道了一种基于适配体功能化石墨烯量子点(GQDs-Apt)和氧化石墨烯(GO)的荧光生物传感器用于Pb2+灵敏传感[44]。通过GQDs与GO之间的高效光致电荷转移过程实现对GQDs荧光的猝灭,而伴随着Pb2+的加入,Pb2+会诱导适配体形成G-quartet- Pb2+复合结构,进而使得GQDs荧光恢复。基于该方法制备的传感器可以实现对Pb2+检测的1 min快速响应,同时具备400 nmol/L的线性检测跨度及0.6 nmol/L的超低检测限(图5(b))。类似的报道还有,Wang等以柠檬酸三钠为碳源、尿素为氮源,采用微波法快速制备了具有450 nm荧光发射的氮掺杂碳点(CDUN)。作者利用适配体与CDUN之间的相互作用,通过免标记法构建了K+的传感平台[42]。在K+存在时,适配体与K+会形成G-quartet- K+复合体,进而减弱对CDUN荧光发射的抑制作用,通过检测结合前后体系荧光强度的变化,可以实现0.008~0.27 μmoL/L 浓度范围内K+的定量检测(图5(c))。

图5 检测金属离子。(a)通过二硫化钼纳米片对CDs-Apt的荧光猝灭作用检测二价汞离子[66];(b)基于石墨烯量子点与氧化石墨烯之间的光诱导电子转移过程检测二价铅离子[44];(c)痕量K+的检测原理[42]。
6.2 检测小分子化合物
6.2.1 有机小分子
小分子增塑剂是一种常见的化学添加剂,可以提高聚合物的可塑性,因此在化妆品及食品的包装材料中广泛应用。但这些油溶性有机小分子很容易溶解在食物或化妆品内并通过消化道或皮肤进入人体,威胁人类身体健康,因此对小分子增塑剂的快速灵敏检测显得尤为重要。近期,Wang等以抗坏血酸为原料合成了双荧光发射碳点材料,通过与氨基修饰的核酸适配体共价偶联之后,在氧化石墨烯的存在下构建了一种双荧光发射比值传感器用于特异性检测邻苯二甲酸二丁酯(DBP)[59]。在最佳实验条件下,DBP的线性范围为12.5~1 500 μg/L,检出限为5.0 μg/L。该方法对食用油样品中DBP含量的检测结果与气相色谱法测定结果无显著差异,可用于食品中DBP的快速检测(图6(a))。
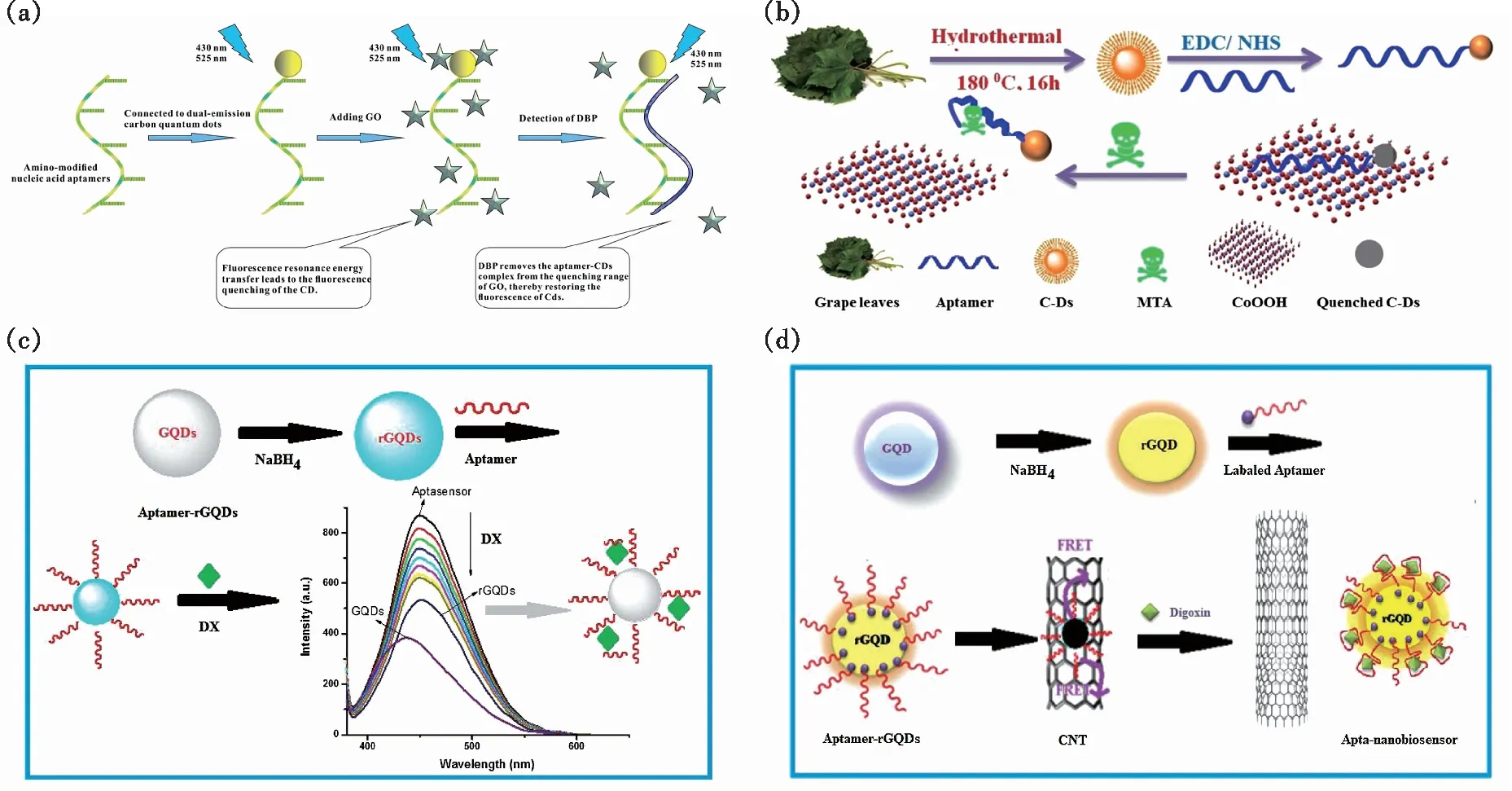
图6 检测有机小分子。 (a)以适配体标记的双发射碳量子点构建荧光比值传感器检测邻苯二甲酸二丁酯[59];(b)荧光传感器检测MTA示意图[67];(c)基于方法1的rGQDs/适体制备及DX测定原理示意图[82];(d)基于方法2的rGQDs-Aptamer制备、aptamer-rGQDs /CNT组装和测定DX示意图[82]。
基于碳点与适配体构建的荧光生物传感器还可用于人体尿液、血液及唾液样本中毒品甲基苯丙胺(MTA)含量的快速灵敏检测。Saberi等以葡萄叶为原料合成了一种具有蓝色荧光发射的碳点,通过化学偶联作用将适配体连接在CDs表面,形成CDs-Apt复合体,利用CoOOH纳米片对CDs-Apt的吸附作用、荧光猝灭作用(FRET),以及MTA对CDs-Apt的特异性结合作用实现对MTA浓度的线性灵敏检测[67]。在最优条件下,检测限为1 nmol/L,动态检测范围为5~156 nmol/L(图6(b))。理论研究表明,CoOOH纳米片与CDs之间的距离约为0.76 nm,证明了发生FRET现象的可能性,同时作者利用分子动力学模拟研究了MTA与适配体的相互作用。
6.2.2 生物小分子
腺苷(AD)在人生理活动中起着重要作用,它可以调节心脏心肌耗氧量和血流量,调节多巴胺等大脑神经递质的释放,同时它还有助于调节平滑肌收缩、神经传递、肾血流动力学和肾素的释放。对AD的实时监控可反映人体的生理健康状态。Wang等以一水合柠檬酸与二乙烯三胺为原料通过一步水热法制备了具有蓝色荧光发射的碳点[60]。碳点经腺苷适配体修饰后形成的CDs-Apt可被纳米石墨吸附在表面并通过FRET过程猝灭CDs-Apt荧光,在AD存在时CDs-Apt荧光可逐步恢复。在优化条件下,AD的检测范围为2~50 nmol/L,检出限为0.63 nmol/L(图7(a))。利用FRET机制检测AD的相似报道还有You等利用蓝色荧光发射碳点为响应性荧光团、红色荧光发射的硅涂层CdTe量子点为内参照制备了一种双发射比率荧光传感器用于人尿液中AD的检测(图7(b))[64]。除此以外,Zhu等采用核酸适配体标记的碳点作为荧光探针和选择性识别元件(CDs-Apt),以Fe3O4@polypyrrole(Fe3O4@PPY)作为荧光猝灭和磁分离材料,构建了一种以AD为模型目标分析物的高灵敏荧光检测方法[84]。通过对游离CDs和CDs-Apt-AD络合物进行两次磁分离纯化,检测限可从8 nmol/L降至0.15 nmol/L(图7(c))。

图7 检测生物分子。 (a)基于CDs-Apt和NG的AD传感器示意图[60];(b)利用荧光传感器对腺苷进行检测的机制[64];(c)利用Apt-CDs和Fe3O4@PPY NPs对腺苷检测示意图:直接检测(ⅰ)和磁分离纯化后检测(ⅱ) [84];(d)基于CDs/Apt的荧光传感器检测ATP原理图[63];(e)基于CDs-Apt/NG的生物传感器检测DA策略示意图[85]。
类似于腺苷的检测,由碳点与适配体构建的荧光生物传感器还可用于ATP 与多巴胺的快速、灵敏及特异性检测。与传统的“turn-on”型荧光变化方式不同,Luo等基于FRET机制设计了一种可进行信号放大的“turn-off”型ATP检测器[63]。在构建的过程中,CDs与适配体的互补单链(cDNA)相连形成CDs-cDNA,CDs-cDNA与适配体链部分互补后吸附在氧化石墨烯(GO)上,当体系中存在ATP分子时,ATP与适配体的特异性结合后会在燃料链的作用下改变体系中碱基互补配对形式,进而导致CDs-cDNA被吸附到GO表面,并发生FRET作用导致CDs-cDNA的荧光猝灭。该文作者利用靶循环链置换技术对信号进行放大的策略可将检测限降低至3.3 nmol/L(图7(d))。多巴胺(DA)是中枢神经系统中最重要的神经递质之一,在心血管、中枢神经系统和内分泌系统中起着重要作用。Zhu等研制了一种基于DA适配体标记碳点(CDs-Apt)和纳米石墨(NG)的DA荧光生物传感器[85]。在该系统中,CDs-Apt作为DA识别单元,无DA存在时将通过π-π堆积和疏水作用吸附在NG表面,DA的存在会与适配体形成球链状结构并使得CDs-Apt从NG表面脱离,从而恢复CDs-Apt的荧光强度。最佳条件下,CDs-Apt的荧光强度在0.10~5.00 nmol/L范围内随DA浓度的增加呈线性增加,检出限为0.055 nmol/L(图7(e))。
6.2.3 细菌分泌物
黄曲霉素与赭曲霉素通常在发霉的谷物中高度富集,如果不经去除,将会残留在二次加工的农产品之中。这两类毒素的毒性极高,对人体的危害极大,高剂量暴露之下会诱导肝癌。Guo等以柠檬酸和乙二胺为原料,采用水热法合成蓝色荧光发射碳点,在该碳点表面修饰黄曲霉素B1适配体作为荧光探针(CDs-Apt),并在腐殖酸(HAs)的配合下对黄曲霉素B1进行灵敏检测[86]。腐殖酸表面存在大量的醌基、芳香环和糖基,很容易吸附CDs-Apt并猝灭碳点荧光,但当黄曲霉素B1存在时,探针会与其作用进而脱离腐殖酸表面并恢复荧光。在优化的实验条件下,该检测器可在0.1~0.8 ng/mL浓度范围内对黄曲霉素B1呈线性响应,检测下限为70 pg/mL(图8(a))。类似的检测手段还有,Wang等利用金纳米粒子对碳点荧光的猝灭效应,通过免标记法构建了黄曲霉素B1的灵敏荧光传感平台[87]。作者以胰液素为原料合成了表面带有正电荷的新型荧光氮掺杂碳点(N,CDs)并通过静电作用将其组装在核酸适配体修饰的金纳米粒子(Aptamer/AuNPs)上,N,CDs的荧光被有效猝灭。当黄曲霉素B1添加到检测溶液中,其适配体之间的特异性相互作用会导致N,CDs的释放。通过测定碳点荧光的强度变化可以对黄曲霉素B1实现5 pg/mL~2.00 ng/mL的线性检测(图8(b))。利用金银纳米粒子对碳点荧光的高效猝灭机制还可用于赭曲霉素A的检测,Wang等基于FRET传感机理,利用高荧光强度的氮掺杂碳点作为能量供体、适配体修饰的银纳米粒子(AgNPs)作为能量受体搭建了荧光生物传感器用于农产品中OTA的快速检测[56]。作者将核酸适配体与其互补DNA分别修饰在AgNPs和CDs上,通过杂交反应来限制两者间的空间距离,诱导FRET过程的发生,而OTA的加入会破坏体系的杂交反应,使得CDs荧光恢复。该方法对OTA的浓度检测范围可达10~5 000 nmol/L(图8(c))。
卡那霉素是一种常见的兽用抗生素,但卡那霉素的过度使用可能导致其残留在动物性食品中,对人体健康造成威胁。Wu等采用免标记法以金纳米颗粒(AuNPs)作为吸收体,通过内滤效应猝灭碳点的荧光,构建了一种新型卡那霉素荧光传感器[88]。该策略主要依赖于AuNPs的吸收光谱与荧光团的荧光激发光谱重叠,以及适配体与卡那霉素的特异性结合能力。在没有卡那霉素的情况下,适配体可以吸附在AuNPs表面并使其分散,从而有效地熄灭CDs的荧光。当加入卡那霉素后,适配体脱离AuNPs表面,导致AuNPs在高盐浓度下聚集。因此,AuNPs的吸收光谱发生变化,不再与CDs的荧光发射光谱重叠,从而使CDs的荧光恢复。在最佳检测条件下,该传感器对卡那霉素的检测线性范围为0.04~0.24 μmol/L,检测限为18 nmol/L(图8(d))。

图8 检测细菌分泌物。 (a) AFB1传感器工作原理示意图[86];(b) AFB1检测原理示意图[87];(c)基于荧光分析法检测啤酒和面粉中的OTA示意图[56];(d)基于内部过滤效应检测卡那霉素的荧光传感器传感示意图[88]。
6.3 检测蛋白质
癌胚抗原(CEA)是人体组织和胎儿细胞中常见的一种作为抗原的细胞表面糖蛋白,它能参与细胞粘附,并在细胞识别和相互作用中起调节作用。通常情况下它在血液中的含量很少,而一旦体内出现肿瘤,它就会在肿瘤细胞中过度表达并分泌到体液中,因此确定CEA在体液中的含量对肿瘤的早期预警、筛查、诊断及预后分析具有重要意义[72]。Shao等将谷胱甘肽溶解在甲酰胺中,以溶剂热的方法制备了具有近红外荧光发射的碳点(NIR-CDs),基于NIR-CDs与金纳米棒(AuNRs)之间的荧光共振能量转移,构建了一种新型的高信噪比荧光传感装置,实现了对CEA的高灵敏度检测[89]。作者通过相应的羧基和氨基之间的共价键合反应制备了AuNRs@SiO2-Aptamer和NIR-CDs-cDNA探针,cDNA与适配体杂交后会限制AuNRs和NIR-CDs之间的空间距离,进而猝灭NIR-CDs荧光。而CEA与适配体的特异性结合会破坏DNA杂交链结构,导致NIR-CDs-cDNA从AuNRs@SiO2表面分离,NIR-CDs的荧光恢复强度与CEA浓度在0.1~5 000 pg范围内呈线性相关(图9(a))。不同于以上检测机制,Miao等采用免标记法构建了一种更加简便的CEA荧光传感器。他们以番茄汁为碳源,合成了一种具有高量子产率、高光稳定性且无毒的碳点[72]。该CDs表面丰富的羧基使得适配体通过π-π叠加作用吸附在CDs表面,并且适配体通过光致电荷转移过程猝灭CDs荧光。当体系中存在CEA时,CEA与适配体的竞争性结合使得CDs荧光恢复,基于该策略构建的荧光传感器可实现对1~0.5 mg/mL范围内CEA浓度的定量检测(图9(b))。
Singh等以谷氨酸为原料采用热解法一步合成具有蓝色荧光发射的碳点,并通过化学反应将恶性疟原虫谷氨酸脱氢酶(PfGDH)适配体偶联到碳点表面[47]。利用适配体对碳点荧光的部分猝灭及蛋白诱导荧光增强效应实现了血清样本中0.5~25 nmol/L范围内PfGDH的快速检测(图9(c))。Ghayyem等利用核酸适配体生物分子与碳点(CDs)表面的相互作用,采用免标记法构建了一种荧光生物传感器用于细胞色素c(Cyt c)蛋白的快速灵敏检测,检出限为25.90 nmol/L,线性范围为40~240 nmol/L[90]。Shi等利用碳点荧光作为指示信号构建了β-乳球蛋白(β-LG)的快速检测器[48]。作者将适配体固定在磁铁矿(Fe3O4)纳米颗粒(MNPs)上,适配体互补寡核苷酸(cDNA)固定在CDs表面形成CDs-cDNA,在β-LG存在下,CDs-cDNA将会被释放到溶液中,经过磁分离之后,通过测定上清液中的荧光强度可以实现0.25~50 ng浓度范围内β-LG的线性检测(图9(d))。
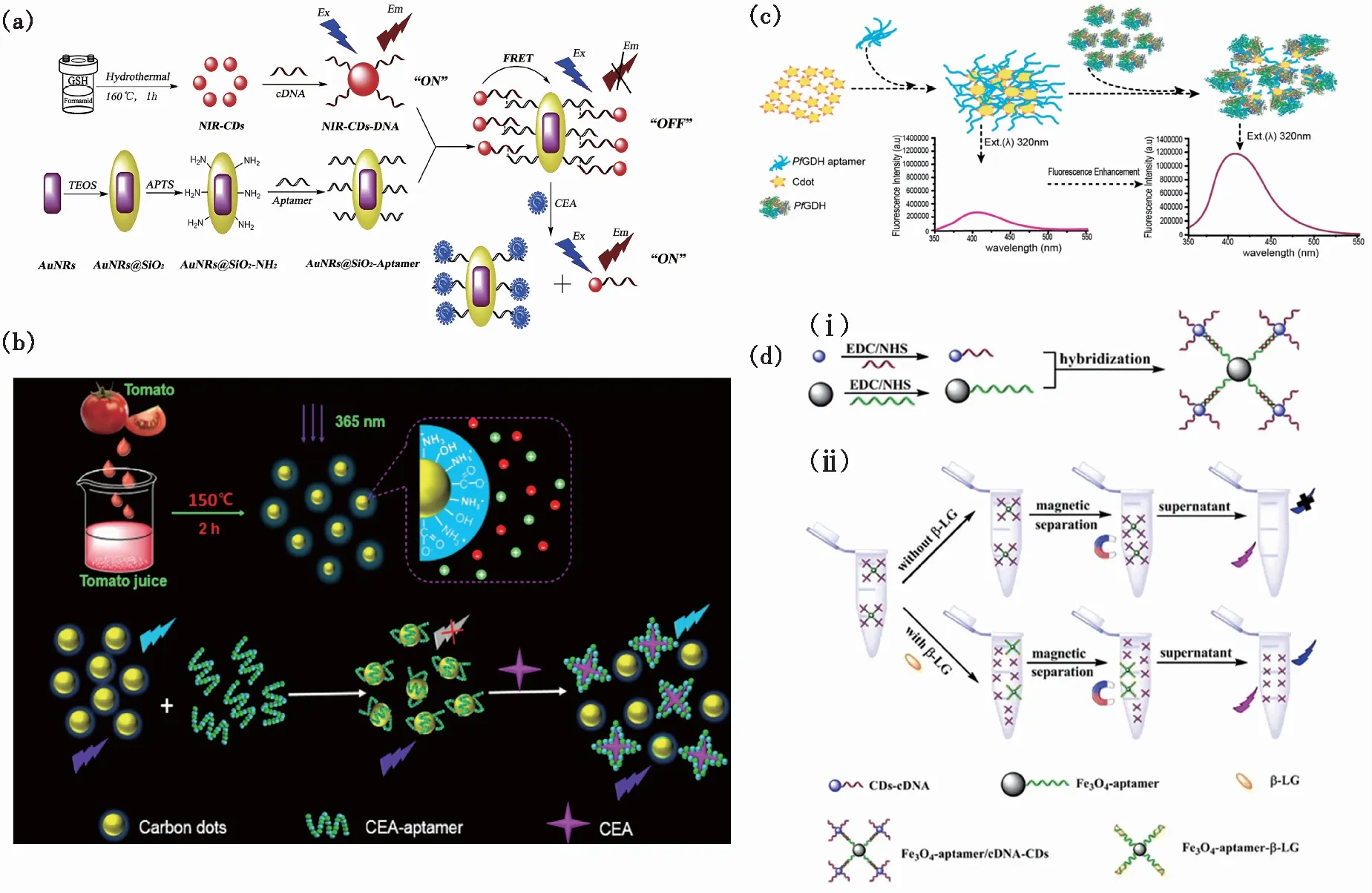
图9 检测蛋白质。 (a)基于NIR-CDs的荧光传感器检测靶标CEA[89];(b)CDs合成示意图及CEA检测过程[72];(c)基于蛋白荧光增强(PIFE)现象对血清中PfGDH的检测示意图[47];(d)传感器的制备示意图(ⅰ)和β-LG检测的原理(ⅱ)[48]
6.4 检测细胞
基于碳点与适配体的荧光生物传感器对细胞的识别本质大部分是基于适配体对细胞膜上的特定膜蛋白的特异性识别作用[51]。例如,Wang等构建了一种基于碳点和核酸适配体组合的荧光探针,用于鼠伤寒沙门菌的灵敏定量检测[50]。在传感过程中,碳点与适配体的偶联体(CDs-Apt)将会特异性地结合到细菌外膜蛋白上,进而对细菌实现灵敏检测(图10(a))。Zhang等在其研究论文中对该过程进行了更为清晰的描绘,他们以色氨酸与苯丙氨酸为原料,在盐酸的催化下制备了蓝色荧光碳点(ACDs)[91]。将该ACDs通过EDC/NHS反应与DNA适配体连接形成ACDs-Apt,基于适配体对人乳腺癌细胞上MUC-1蛋白的特异性结合,该ACDs-Apt能够实现对人乳腺癌细胞的特异性粘附识别(图10(b))。

图10 检测细胞。 (a)CD-Apt对细菌细胞的传感过程[50];(b)ACDs-Apt的结构和对癌细胞的成像原理示意图[91]。
7 总结与展望
碳点材料具有光学性质突出、生物相容性好、毒性低、易修饰、制备简便等优良性质,是一种非常出色的荧光纳米材料。适配体在特异性识别靶标分子方面有着优异的性能,是优异的目标识别材料。本文对基于碳点与适配体的荧光生物传感器结构组成(碳点、适配体)、构建方式(标记法、免标记法)、传感机理(FRET、IFE、PET、ACQ)和应用范围(金属离子、小分子化合物、蛋白质、细胞)进行了系统的总结。目前来看,该种类型的传感器性质很突出、应用很广泛,但仍存在着一些问题:(1)碳点的荧光发射机理不明确,这阻碍了对传感机理的探究;(2)碳点结构不明晰,合成过程的不可控性使得碳点的表面状态具有宏观相似微观不同的特点,这对探针的精细结构设计影响较大;(3)碳点荧光需要向长波长方向设计以抵抗生物体的背景荧光干扰,这是临床应用的关键;(4)适配体与靶标的特异性结合位点及作用方式需要进一步研究。这些问题的解决将极大地提高基于碳点与适配体的荧光生物传感器的灵敏性、特异性以及检测范围。
我们认为,碳点结构的精确设计是解决上述问题的关键之一,通过调节前驱体的结构与优化反应条件可以实现碳点大小与组成的精确控制,但目前仍缺少普适性的指导方法。另一个关键问题是如何通过控制合成前体与路径实现碳点的荧光发射峰位向长波长移动以及优化生物相容能力。CPDs是近年来提出的一类具有核壳结构的碳点材料,其表面的聚合物链与基团结构赋予了CPDs易修饰的性质,易于与生物体之间相容,并且CPDs可以调节荧光发射至近红外区,这在临床应用中有很大的前景。总体来看,碳点与适配体结合用于荧光传感器件有着广阔的应用前景,但精确的器件结构设计以及适配体与靶标的作用形式仍需要从理论计算和谱学表征方面进行深入的研究。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210161.
