红光/近红外光响应碳点在肿瘤治疗中的应用进展
2021-09-03南福春薛小矿葛介超汪鹏飞
南福春,薛小矿,葛介超*,汪鹏飞
(1. 中国科学院理化技术研究所 光化学转换与功能材料重点实验室,北京 100190;2. 中国科学院大学 未来技术学院, 北京 100049)
1 引 言
碳点是一种新兴的尺寸小于10 nm的零维荧光碳纳米材料。2004年,Scrivens课题组在利用电泳法纯化碳纳米管时首次发现获得的产物中含有荧光纳米碎片[1]。因为该类材料性能与硅量子点相似,2006年,克莱姆森大学孙亚平博士最先将该类材料命名为碳点[2]。碳点是一个较为宽泛的概念,是碳化量子点(Carbon quantum dots,CQDs)、石墨烯量子点(Graphene quantum dots,GQDs)、碳纳米点(Carbon nanodots,CNDs)和碳化聚合物点(Carbonized polymer dots,CPDs)的统称[3]。不同于传统的无机量子点,碳点具有与有机大分子相似的长π-π共轭结构,其内核是由高度石墨化的sp2杂化的碳组成,外壳部分则包含了丰富的有机官能团,如羧基、氨基、羟基等[4]。这种有机无机杂化的特点赋予了碳点特殊的性质。与传统有机荧光染料相比,碳点表现出优异的抗光漂白性、低毒性、水溶性、生物相容性及表面易修饰等特点。与传统Ⅱ-Ⅵ族金属量子点相比,碳点不含有毒的金属元素,具有良好的生物相容性[5-6]。
根据碳点前驱物的不同,目前关于碳点的制备主要分为两大类方法[7]:一种是自上而下法,包括激光烧蚀法、电化学氧化法、电弧放电法。该方法主要是针对大尺寸的碳材料而言,如石墨烯、碳纳米管、碳纳米纤维、石墨等,将这些较大尺寸的碳材料进行裂解,使其尺寸变小获得碳点。另一种方法是自下而上法,包括模板法、溶剂热法、微波辅助法、热解、燃烧法等。该方法主要是针对有机小分子或生物质材料而言,将前驱物进行碳化,经过分离纯化获得发光碳点。在碳点形成过程中,不同的制备方法对碳点的性能有着至关重要的影响。即便是相同的前驱物,选用不同的溶剂、采用不同的制备方法获得的碳点性能也大相径庭[8]。因此,探索发展新的制备方法来获得具有新性能的碳点是目前碳点研究领域的热点。
碳点吸收及发光范围可调的性质使得其在生物医学领域如生物传感、肿瘤诊断中具有重大的应用前景。在研究初期,所制备的碳点发光区域大多数在蓝绿光范围内。蓝绿光的组织穿透深度浅,仅有1~2 mm,这极大地限制了碳点在生物医学领域的应用(图1)[9]。随着制备方法的不断改进,多种红光/近红外发光的碳点被制备出来。与蓝绿光碳点相比,红光/近红外(600~950 nm)发光碳点具有组织穿透深度大、生物体自发光干扰较小、对组织损伤小等优点,因而可以将该类材料用于生物体深度荧光成像,极大地拓宽了碳点在生物医学成像等领域的应用[8]。除了荧光成像之外,一些碳点在近红外区域具有强的吸收峰,可以将其用于光声成像[10]。同时,碳点丰富的官能团使得顺磁性金属离子可以与碳点发生配位作用,获得金属掺杂的碳点,用于磁共振成像和CT成像等[11]。
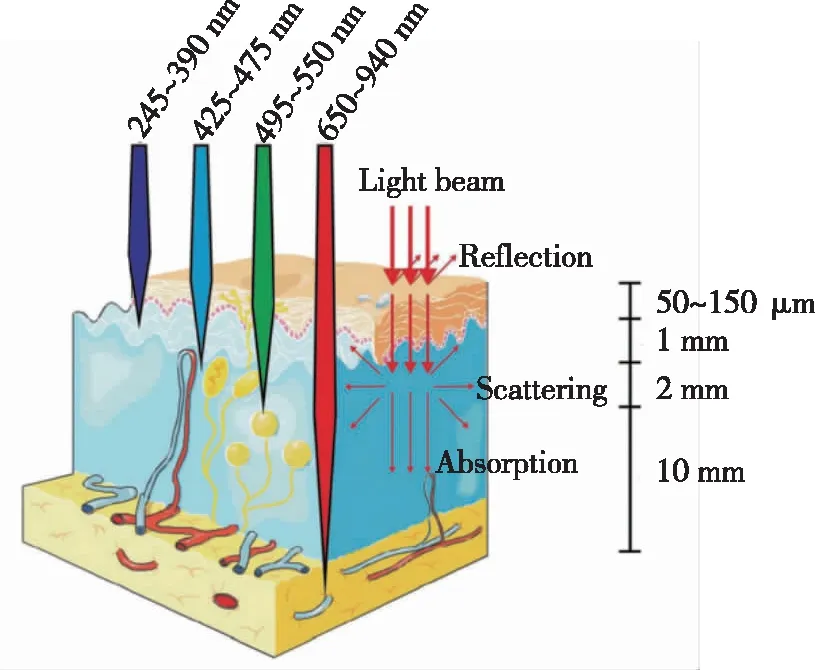
图1 不同波长光源在生物组织中的穿透深度[9]
除了具有优异的光学成像诊断功能,近年来陆续发现一些碳点还具有优良的治疗功能(图2)[12]。例如,碳点作光敏剂可以实现对肿瘤的光动力治疗(Photodynamic therapy,PDT)或光热治疗(Photothermal therapy,PTT)。光动力治疗是光敏剂在合适光源的照射下产生活性氧物种(Reactive oxygen species,ROS),引起癌细胞内生物大分子发生氧化损伤,进而导致细胞死亡,实现治疗目标[13-14]。光热治疗则是光敏剂将光能转化为热能,利用过高热引起癌细胞的不可逆损伤,消灭癌细胞[15-16]。传统的化疗药物在治疗肿瘤的同时会产生系统毒性,对身体具有较大的毒副作用,往往是杀敌一千,自损八百;而光动力治疗与光热治疗可以通过控制激光照射区域将治疗范围缩小至肿瘤区域,从而实现针对肿瘤的特异性治疗,避免对正常组织产生损伤,因此具有光疗效果的碳点在肿瘤治疗中有广阔的应用前景[17]。另外,随着研究的不断深入,针对肿瘤及其微环境的特异性、靶向性治疗功能的碳点研究也备受关注。
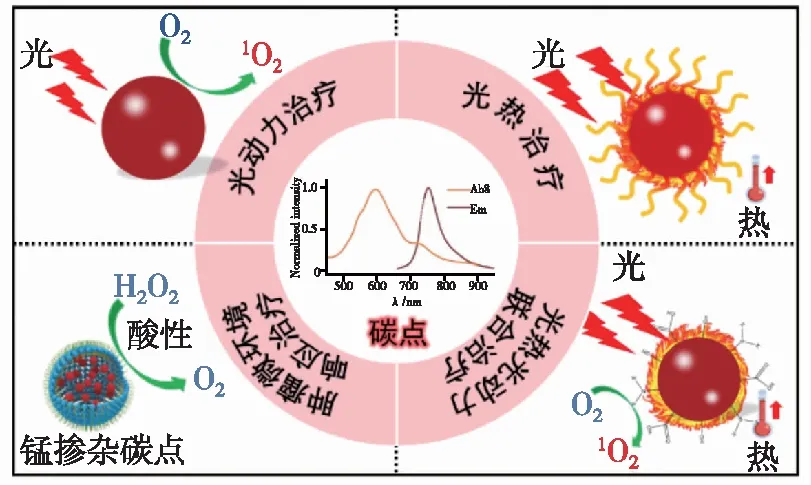
图2 红光/近红外光响应碳点在肿瘤治疗中的应用
在本综述中,我们将着重介绍红光/近红外光响应碳点的吸收/发光影响因素以及近几年碳点在肿瘤治疗中的新进展,后者主要包括碳点在光动力治疗、光热治疗、光动力/光热协同治疗的应用。另外,针对肿瘤微环境的特点,介绍了微环境响应型碳点及其在肿瘤治疗中的应用研究新进展。
2 红光/近红外光响应碳点光学特性的影响因素
不同前驱物以及不同方法制备的碳点会表现出结构多样性,由此会使得碳点的吸收及发射光谱发生明显变化。
2.1 碳点吸收特性的影响因素
碳点内核为π-π共轭的sp2杂化结构,这使得碳点在短波长范围内表现出高效的光子捕获特性,从而使得碳点在紫外范围内(230~320 nm)有着较强吸收[18]。此外,碳点的尺寸、杂原子掺杂、结构、表面基团等都会对碳点的吸收产生显著影响。为了使碳点在红光/近红外光区域具有明显吸收,用于高效光疗[9],目前主要有以下方式获取具有长波长吸收的碳点。例如,氮、硫等非金属原子以及Cu2+、Mn2+、Ni2+等金属离子掺杂能够显著提高碳点材料在长波长范围内的吸收[19-22]。中国科学院长春光学精密机械与物理研究所曲松楠课题组在制备柠檬酸/尿素体系碳点中,通过改变溶剂热过程中的溶剂,成功将硫原子掺入到碳点中。硫原子的掺杂降低了碳点的带隙,使得碳点在红光/近红外光区域表现出强吸收峰[19];东南大学吴富根课题组利用Cu2+离子掺杂提高了碳点在近红外光区域的吸收[20]。此外,利用碳点自身的相互作用,组装获得超碳点材料也是一种获得具有近红外光吸收碳点的有效策略。曲松楠课题组利用碳点组装策略,使碳点在湿润的空气中(60%空气湿度)组装为在近红外光区域有明显吸收的超碳点材料[23]。
2.2 碳点发光的影响因素
与传统有机小分子及无机光敏剂相比,碳点结构及组成复杂,因此关于碳点的发光机理众说纷纭。碳点是由共轭碳核及表面分子层组成,这两方面性质都会对碳点的发光性能产生影响。目前普遍认为碳点的发光特性主要受以下因素影响:碳点尺寸效应、表面功能化官能团及杂原子掺杂等。通过调节碳点的上述特性,可获得适用于生物医学应用的红光/近红外光发射的碳点。
2.2.1 尺寸效应对碳点发光的影响
量子限域效应(尺寸效应)对碳点的发光有着重要影响,这里所说的尺寸并不是碳点的整体尺寸,而是碳点内部高度共轭的sp2区域尺寸[24]。随着碳核共轭区域尺寸变大,碳核中电子离域程度提高,带隙降低,HOMO与LUMO轨道之间的能级差减小,导致碳点的发光产生红移,从而获得红光/近红外光发射的碳点。该模型适用于解释石墨化程度高的碳量子点。2014年,新加坡南洋理工大学陈鹏课题组与新加坡理工学院Lim团队合作,利用理论计算的方法模拟了碳点尺寸对其发光波长的影响[25]。结果表明,随着碳点尺寸增大(0.46~2.31 nm),其发光波长由蓝光区域红移至近红外光区域。这种变化正是由于尺寸增加后π电子离域程度增加所导致。2017年,曲松楠课题组利用柠檬酸与尿素为前驱物,改变制备过程中的反应溶剂,成功制备了具有不同尺寸的碳点,随着碳点尺寸变大,该碳点的荧光发生明显红移[26]。这一结果也证实了碳点尺寸对碳点的发光具有重要影响。
2.2.2 碳点表面态对碳点发光的影响
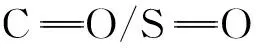
2.2.3 杂原子掺杂对碳点发光的影响
大量研究表明,杂原子如氮、氟、硫、硼等的掺杂对碳点的发光同样有着重要影响[30-31]。
多种原子共掺杂也是调节碳点发光特性的重要方法。例如,2017年,兰州大学任翠领等以2,5-二氨基苯磺酸和4-氨基苯硼酸为原料成功制备了氮、硫、硼共掺杂的红光碳点,其中硼、氮掺杂能够提高碳点的发光强度,氮掺杂能够降低带隙,使碳点发射波长红移[32];最近,安徽大学毕红等利用柠檬酸、尿素、氟化铵为前驱物,采用溶剂热法制备了氮/氟掺杂的碳点。氟/氮共掺杂能够形成D-π-A结构,有利于碳点的激发波长发生红移,获得近红外光发射的碳点[34]。
综上所述,碳点尺寸、表面态以及杂原子掺杂都会影响碳点发光红移。尽管已经有相关的理论试图解释碳点的发光机制,但是,用统一理论阐释碳点的发光机理以及预先设计并制备具有可控发光特性的碳点依然存在着诸多挑战。
3 红光/近红外光响应碳点在肿瘤治疗中的应用
3.1 光动力治疗
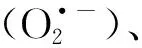
近年来,碳点在光动力学治疗肿瘤方面发展迅速(表1)。2012年,Markovic等利用电化学法制备了能够在470 nm光源刺激下产生1O2的石墨烯量子点[18],并证实了该材料在光源照射下对细胞有明显的杀伤效果。但是,该碳点为蓝光碳点,极大地限制了该碳点在生物医学特别是荧光成像中的应用。2014年,汪鹏飞课题组发展了一种新的制备碳点的策略,以聚噻吩衍生物PT2为前驱物,利用水热法成功制备了硫、氮掺杂的具有近红外发射的水溶性碳点,其最大发射峰在700 nm左右,实现了碳点在近红外区的荧光成像,拓宽了碳点在生物医学成像中的应用[35]。更重要的是,该近红外发光碳点在可见光或红光照射下,可高效产生1O2,其1O2量子产率高达1.3,远远超过了传统的有机小分子光敏剂。这种超高的1O2量子产率来源于两种路径:一是T1态到S0态的过程中产生1O2;二是S1态到T1态的系间穿越过程产生1O2(图3(a))。体外细胞与体内抗肿瘤实验结果表明该材料具有高效的光动力治疗效果。但是,该类近红外发光碳点表面带有大量正电荷,容易与血液中的红细胞发生团聚,形成血栓,无法通过静脉注射的方式给药。为了解决这些问题,该课题组利用正负电荷相互作用,将十二烷基苯磺酸钠(SDBS)与该正电碳点组装,之后用聚乙二醇(PEG)钝化,得到了具有近红外吸收的碳点纳米球(Carbon dots nanospheres,CDNS)(图3(b))[36]。利用SDBS与正电碳点组装后,能够将碳点表面的正电荷转化为负电荷,可以实现尾静脉给药。同时与正电碳点相比,得到的碳点纳米球CDNS的吸收波长发生了明显红移,在671 nm激光照射下,1O2量子产率为45.4%。细胞及活体实验表明,碳点纳米球CDNS既可以用于近红外荧光成像,又能用于近红外光响应的光动力学治疗。
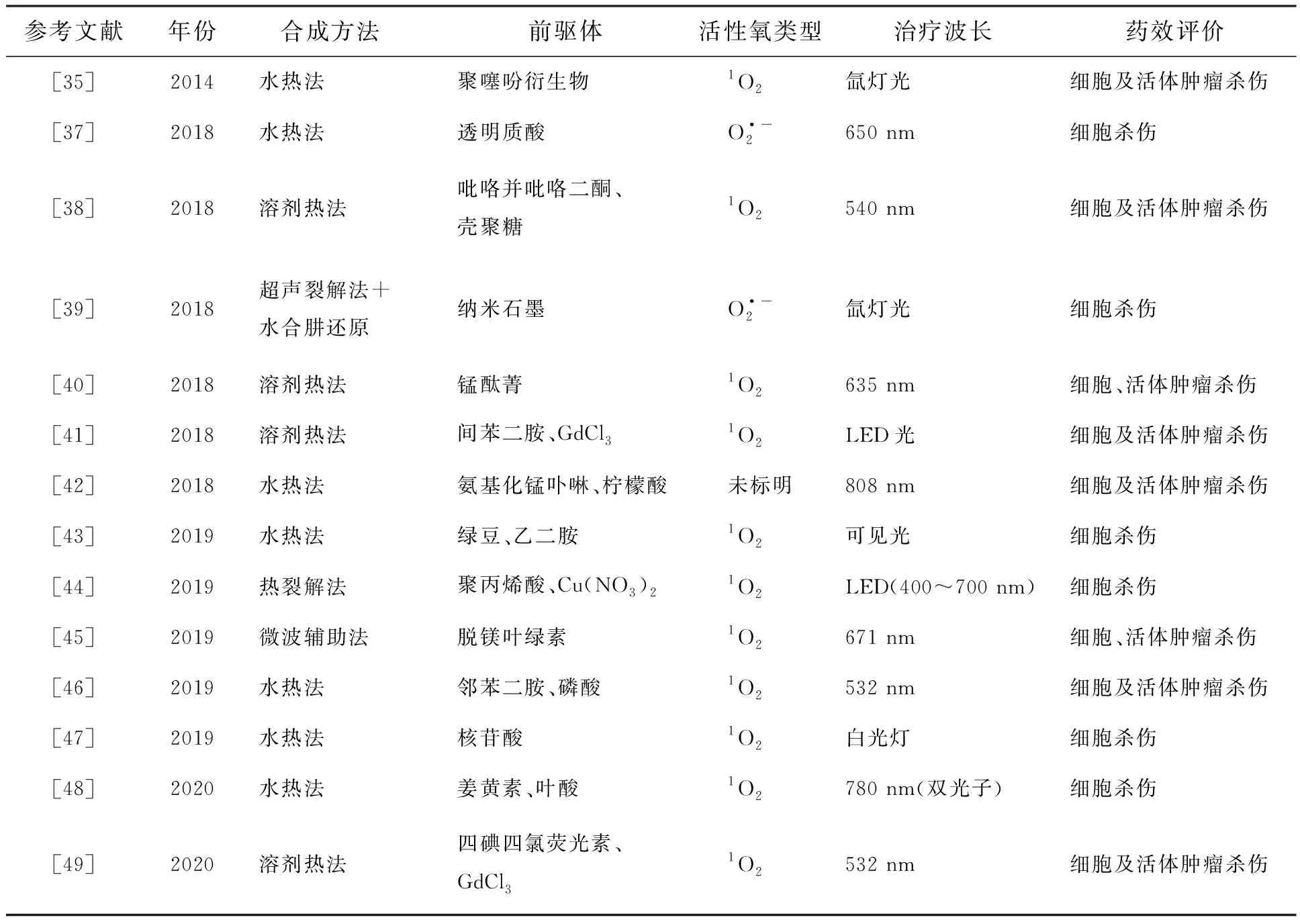
表1 光动力治疗效果碳点
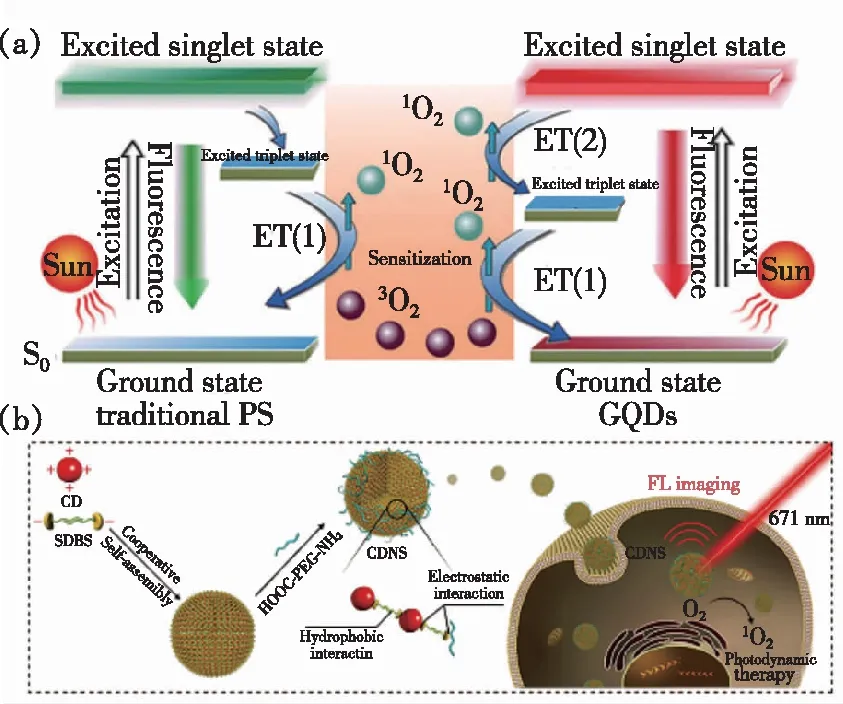
图3 (a)传统光敏剂与碳点1O2产生原理图[35];(b) CDNS组装体制备及其用于近红外光荧光成像介导的光动力治疗原理图[36]。
以高分子聚噻吩衍生物为碳源制备碳点过程复杂,需要经过多步化学反应合成前驱体,因此需要发展更为简单的方法制备具有光动力效果的碳点。2018年,该课题组又利用生物质原料脱镁叶绿素为前驱物,采用微波辅助法制备了1O2产率为62%的碳点[45],且该碳点最大发射峰为680 nm,经过与DSPE-PEG组装,得到了具有良好水溶性的碳点组装体。该组装体保持了高1O2量子产率以及荧光成像的特性,最终可以将该材料用于荧光成像介导的光动力治疗,具有良好的光动力肿瘤治疗效果(图4(a))。另外,谢志刚课题组利用类卟啉化合物与壳聚糖为前驱物,采用一步水热法制备了具有两种光动力治疗效果的碳点(图4(b)、(c))[38,50]。经过水热碳化后,该碳点依然保持了光敏剂的芳香结构,因此可以在光照下产生1O2,具有较好的光动力治疗效果。在这两个体系中,虽然碳化过程会让原本光敏剂的结构发生改变,但是最终获得的碳点不仅具有与前驱物类似的1O2产生能力,而且壳聚糖的引入使得碳点具有优良的水溶性和生物相容性。最近,美国国立卫生研究院陈小元和厦门大学陈洪敏课题组合作,以间苯二胺与GdCl3为前驱物,利用溶剂热法制备了Gd3+掺杂的具有光动力治疗效果的红光碳点(Gd@GCNs)[41]。高分辨透射电镜表明该碳点尺寸分布均匀,Gd3+含量达到了37.6%,可以将其用于T1与T2的肿瘤磁共振成像。且该碳点具有类似金属卟啉的结构,Gd3+能够增强碳点的自旋轨道耦合,从而增强系间穿越,使得碳点具有1O2产生能力。细胞及小鼠体内实验结果表明,该碳点具有良好的光动力治疗效果,并且可以用于小鼠肿瘤的荧光/磁共振双模态成像(图4(d))。随后,该课题组进一步利用四碘四氯荧光素与Gd(NO)3为前驱物,采用相似的策略,制备了荧光/磁共振成像介导的光动力与放射协同治疗功能的碳点GRDs(图4(e))[49]。2019年,谢志刚课题组与长春工业大学郑敏课题组合作,利用碳点与BODIPY分子之间的自组装,制备了具有良好水溶性的纳米组装体,该组装体具有良好的生物相容性以及光动力治疗效果[51]。最近,该课题组又制备了表面带醛基的碳点,并与BODIPY分子反应,制备了发红光的共价有机骨架(Covalent organic framework,COF)材料。细胞及活体实验表明该COF材料具有良好的光动力抗肿瘤效果,拓展了碳点作为构筑COF基元在肿瘤光疗中的应用[52]。
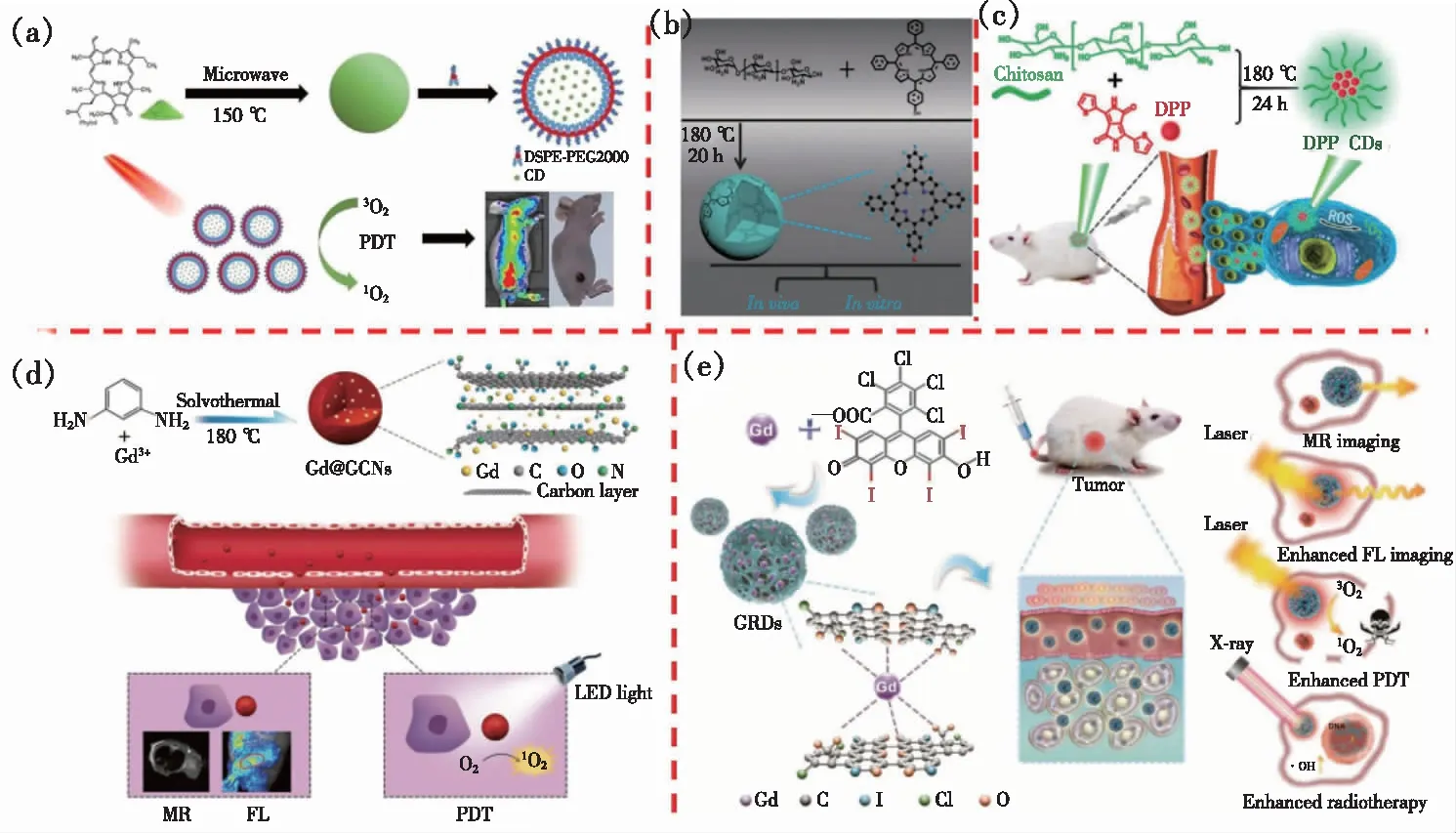
图4 (a)以脱镁叶绿素为前驱物的生物质碳点用于荧光成像介导的肿瘤光动力治疗示意图[45];(b)卟啉基碳点的制备[50];(c)DPP基碳点制备及其在肿瘤光动力治疗中的应用[38];(d)Gd@GCNs用于荧/磁共振成像介导的光动力治疗[41];(e)GRDs用于荧光/磁共振成像介导的肿瘤光动力/放射协同治疗示意图[49]。
3.2 光热治疗
光热治疗是光疗的另一种形式,光敏剂在合适波长的光照下,能够将光能转化为热能产生过高热,从而杀灭癌细胞[15]。与光动力治疗相比,光热治疗不需要氧气参与,因而不受肿瘤乏氧的限制。并且光热效应能够赋予碳点光声成像的特性。光声成像的信号来源于物质的光声效应,该效应是指当脉冲激光照射物质后,物质在吸收光后产生热量,导致热膨胀进而产生宽带超声波,将声波转化为光学信号,可实现光声成像[53]。荧光成像具有高灵敏度特性,但是光的组织穿透深度有限,使得荧光成像的空间分辨率较差,不能满足深层组织观察的需求。而光声成像则能够在一定程度上克服荧光成像的缺点,具有高对比度、高分辨率以及组织穿透深度大等优点。
2015年,汪鹏飞课题组以聚噻吩苯丙酸(PPA)为前驱物,利用水热法制备了一种具有光热特性的红光碳点(图5(a))[54],其发射峰位于640 nm,在400~750 nm范围内呈现出宽的吸收峰,具有较强的光声信号,可以将其用于光声/荧光双模态成像(图5(b)、(c))。同时该碳点在671 nm激光照射下光热转化效率接近40%,是一种非常好的光热试剂,细胞及活体实验表明该碳点具有良好的光热治疗效果(图5(d))。此后,具有红光/近红外光响应的碳点类光热转化试剂被不断发现(表2)。汪鹏飞课题组和中国香港城市大学张文军团队合作,以聚噻吩衍生物PT2与二苯基二硒醚为前驱物,成功制备了S,Se掺杂的红光碳点[55]。该碳点具有双光子荧光成像功能,其双光子吸收截面为30 045 GM。在808 nm激光照射下碳点的光热转化效率为30.6%,可以用于荧光成像介导的光热治疗。

图5 (a)聚噻吩苯丙酸碳点制备示意图;(b)~(c)尾静脉注射0~6 h碳点在肿瘤部位活体荧光成像与光声成像图;(d)不同处理下肿瘤体积随时间变化统计图[54]。
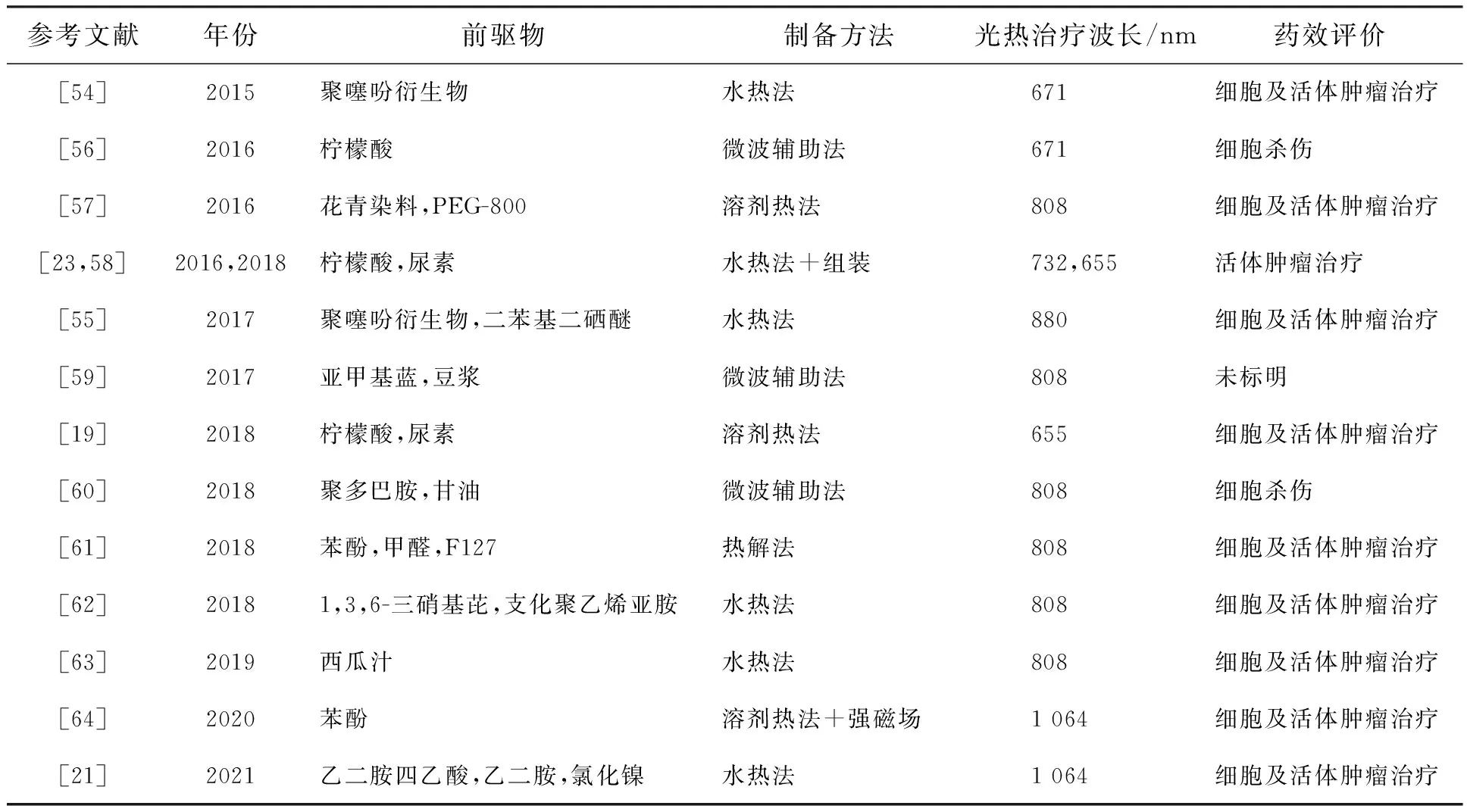
表2 光热治疗效果碳点汇总表
除了高分子前驱物外,许多具有反应性官能团的小分子也被用来制备具有光热活性的红光碳点。例如,中国科学院宁波材料技术与工程研究所林恒伟课题组利用柠檬酸为前驱物、甲酰胺为溶剂,采用微波辅助法制备了红光发射的碳点[56],其最大发射峰在650 nm左右,并且该碳点具有双光子成像的功能。在671 nm激光照射下碳点的光热转化效率达到了43.9%,细胞实验表明该碳点的光热效应能够有效地杀灭癌细胞,可以将其用于光热治疗。曲松楠课题组以柠檬酸/尿素为前驱物,二甲基亚砜为溶剂并提供S源,成功制备了吸收范围宽且最大吸收波长为600 nm的碳点[19],在655 nm激发下,该碳点的发射峰在720 nm左右,并且具有59.2%光热转化效率。活体实验结果表明,该碳点可以用于荧光/光声双模态成像介导的光热治疗,具有良好的肿瘤治疗效果。同时,该课题组利用碳点之间的静电及氢键相互作用,采用后组装策略制备了在可见光及近红外光范围有明显吸收的超碳点,其光热转化效率超过50%[23]。进一步的实验证明该碳点可以用于光声成像介导的光热治疗[58],为开发新型碳点光热试剂提供了新思路。
金属离子掺杂能够提高碳点在红外/近红外区域的吸收,从而显著提高碳点类材料的光热转化效率。例如,吴富根课题组以邻苯二胺/L-半胱氨酸为前驱物,制备了S,N掺杂的碳点,之后利用静电相互作用使Cu2+与碳点共组装并用PEG进行表面修饰,制备了具有光热特性的PEG修饰的CuCD NSs[20]。组装前碳点在近红外/可见光范围内没有明显吸收。而Cu2+参与组装后,CuCD NSs吸收光谱发生显著变化,在500~900 nm范围内具有强吸收,该材料具有优良的光热转化特性,可以将其用于荧光/光声双模态介导的光热治疗。电子科技大学蔡璐璐课题组利用锰离子与苯胺黑为前驱物制备碳点(Mn-NCDs)[22],与未掺杂锰离子的碳点(NCDs)相比,Mn-NCDs在550~850 nm表现出更强的吸收,锰离子掺入能够显著提高碳点的光热转化能力,可以用于荧光/光声双模态介导的肿瘤光热治疗。最近,哈尔滨工程大学杨飘萍课题组以乙二胺四乙酸/乙二胺为碳源、氯化镍为镍源,成功制备了镍掺杂的碳点(Ni-CDs)[21]。在该碳点中镍离子掺杂对其吸收特性有着决定性的影响,未掺杂镍离子的碳点在近红外区域没有明显吸收,而镍离子掺杂后碳点在近红外区域(750~1 350 nm)具有明显吸收,其峰值在1 002 nm左右,可以用于第二近红外的光声成像与光热治疗。
3.3 光热/光动力协同治疗
尽管光动力治疗与光热治疗都表现出良好的肿瘤治疗效果,但是两种治疗方式各有其局限性。对光动力治疗而言,肿瘤部位的乏氧降低了光动力治疗效果[65-66]。对光热治疗而言,肿瘤治疗过程中往往需要较高的激光功率,产生的高温容易对肿瘤周边的正常组织产生损伤[67]。将两种治疗方式结合起来能够克服单一治疗方式的局限性,提高肿瘤的治疗效果[68]。光热治疗产生的高温能够促进血液循环,减小肿瘤组织中乏氧区域,有利于提高光动力的治疗效果[69];而光动力治疗产生的活性氧物种会降低癌细胞对过高热的耐受性,有利于提高光热治疗效果[67]。因此,光动力/光热治疗结合起来可以实现1+1>2的治疗效果。目前主要有两种措施来实现碳点类材料的光动力与光热协同治疗:一是将具有单一治疗功能的碳点与具有其他治疗功能的纳米材料或者小分子进行组装,获得具有多重治疗功能的纳米材料;二是直接制备出兼具光动力光热协同治疗功能的碳点。
2016年,汪鹏飞课题组将前期报道的正电碳点与表面修饰有负电性二氧化硅的金纳米棒以静电相互作用的方式结合到一起,借助碳点的光动力治疗效果与金纳米棒的光热治疗效果制备了具有光动力/光热协同治疗功能的金纳米棒@二氧化硅/碳点纳米材料(GNR@SiO2-CDs)[70]。在808 nm激光照射下,金纳米棒能够作为光声成像与光热治疗试剂;而在635 nm激光照射下,正电碳点可以作为肿瘤的荧光成像与光动力治疗试剂,最终实现针对肿瘤的光动力/光热的协同治疗(图6(a))。在该项工作中,需要采用两种光源才能实现光动力与光热的协同治疗,过程较为繁琐。2019年,林恒伟课题组利用酰胺化反应将商用化的光敏剂Ce6固定到表面带氨基的红光发射的碳点上,获得了碳点/Ce6纳米材料Ce6-RCDs[71],最终实现了单一激光(671 nm)激发的光动力/光热协同治疗(图6(b))。与等量的Ce6或者RCDs相比,在0.5 W/cm2激光照射下,Ce6-RCDs表现出更好的抗肿瘤效果。
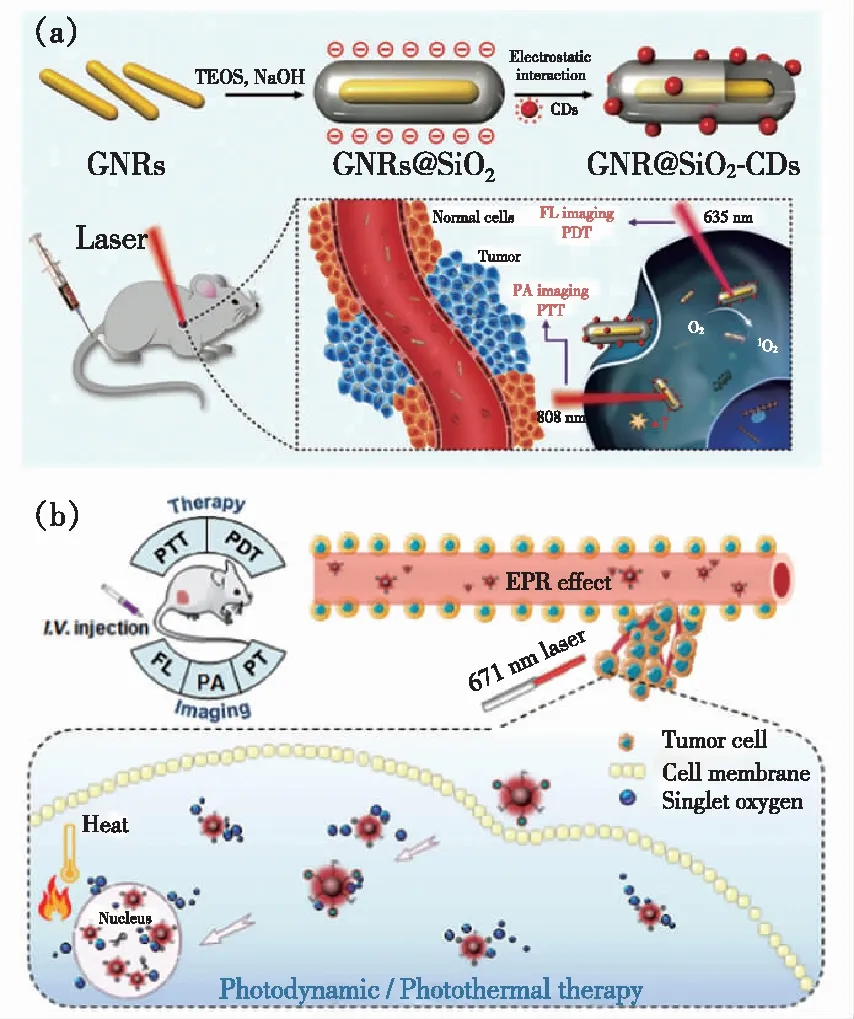
图6 (a)GNR@SiO2-CDs制备及其肿瘤光动力/光热协同治疗原理图[70];(b)Ce6-RCDs用于多模态成像介导的光动力光热协同治疗原理图[71]。
上述工作都是采用具有单一治疗功能的碳点与其他治疗材料结合,以此构建多功能治疗材料,这些工作不可避免地存在制备工艺复杂、成本高以及组装后的光敏剂和碳点提前泄露等问题。兼具光动力/光热协同治疗效果的碳点可有效克服上述问题。2016年,汪鹏飞课题组以聚噻吩苯甲酸(PBA)为前驱体,制备了兼具光动力/光热协同治疗效果的碳点(图7(a))[72]。该碳点表现出明显的红光发射特性,并且在635 nm激光照射下,既可以产生1O2又可以产生热(图7(b)、(c))。其1O2量子产率为27%,光热转化效率为36.2%,实现了荧光成像介导的单光源激发的光动力/光热协同治疗。随后,该课题组又以生物质材料竹红菌为前驱物,制备了具有光动力光热协同治疗效果的碳点(HBCDs)[73],进一步降低了该类碳点的制备成本(图7(d))。在635 nm激光照射下,该碳点的1O2量子产率为38%,光热转化效率为27.6%。活体实验结果表明,在尾静脉注射碳点后,低功率0.1 W/cm2635 nm激光照射,肿瘤部位升温不明显;而经过0.8 W/cm2激光照射后,肿瘤部位升温明显,最高温度达到56.4 ℃(图7(e))。低激光功率照射组的小鼠肿瘤在经过光动力治疗后生长速度被明显抑制,但是肿瘤不能被完全清除。而高功率激光照射组的小鼠在经过光动力光热协同治疗后,肿瘤被完全清除且在治疗后14 d内无复发(图7(f))。这一结果表明了光动力光热协同治疗效果远高于单纯的光动力治疗。另外,广西师范大学沈星灿和蒋邦平团队利用Cu2+与乙二胺四乙酸二钠盐(EDTA)为原材料,成功制备了在808 nm激光照射下产生1O2与热的Cu2+掺杂碳点[74],可以将其用于光动力/光热协同治疗。最近,中南大学蓝敏焕课题组以1,3,6-三硝基芘为前驱物,利用水热法制备了具有光动力光热协同治疗效果的碳点[75],在635 nm激光下,该碳点的1O2产率为5.7%,光热转化效率为73.5%。并且该碳点具有双光子成像的功能,可以用于光声/荧光成像介导的光动力/光热协同治疗。
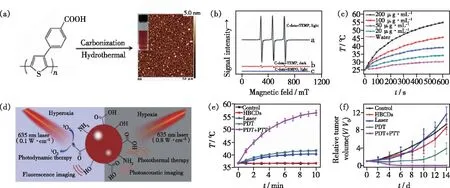
图7 (a)聚噻吩苯甲酸碳点制备[72];(b)不同条件下聚噻吩苯甲酸碳点的ESR信号图[72];(c)不同浓度聚噻吩苯甲酸碳点溶液在635 nm激光照射下的温度变化图[72];(d)HBCDs用于荧光/光声成像介导的光动力光热协同治疗示意图[73];(e)不同处理下小鼠肿瘤部位温度变化图[73];(f)不同处理下各组小鼠肿瘤体积统计图[73]。
4 微环境响应型碳点在肿瘤治疗中的应用
相较于正常组织,肿瘤的快速增殖等特点使得肿瘤组织表现出独特的生物化学环境,称之为肿瘤微环境。肿瘤微环境是一个复杂的体系,它是由肿瘤细胞、免疫细胞、炎症细胞、肿瘤相关的成纤维细胞、间质组织以及各种细胞因子等组成[76-77]。与正常组织相比,肿瘤微环境具有独特的性质,例如过表达的生物标志物、乏氧、弱酸性环境(pH 6.0~6.9)、高浓度谷胱甘肽(GSH, 0.5~10 mmol/L)及高浓度过氧化氢(H2O2, 50~100 μmol/L)等[78-79]。虽然肿瘤微环境为肿瘤的恶性增殖与转移提供了合适的环境,但是也为研究者们打开了肿瘤特异性治疗的大门。针对肿瘤微环境特点,设计具有肿瘤微环境响应型的碳点实现对肿瘤的特异性治疗,既可以提高治疗效果,又可以降低对正常组织的损伤。
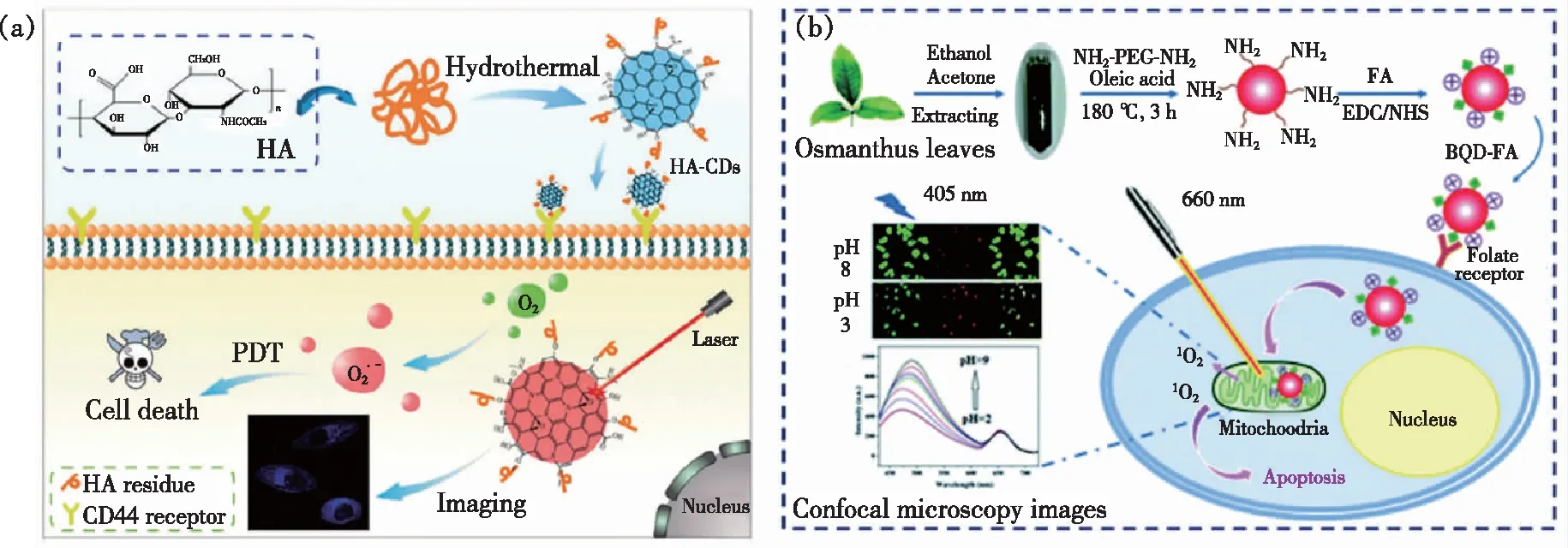
图8 (a)透明质酸碳点制备及用于肿瘤靶向的光动力治疗[37];(b)BQD-FA制备及其用于靶向癌细胞的光动力治疗示意图[82]。
Warburg效应以及淋巴循环缺失导致的代谢废物堆积使得肿瘤组织表现出弱酸性[83]。因此,针对肿瘤弱酸性环境的pH响应型碳点基纳米药物也应运而生。新加坡南洋理工大学赵彦利课题组将顺铂类化疗药物负载到碳点表面,将RGD多肽链接到碳点上作为主动靶向配体,最后将含有pH响应性的苯亚胺键的PEG共价修饰到碳点表面[84]。在弱酸性刺激下,苯亚胺键发生断裂,将内部的RGD靶向肽暴露出来。RGD靶向肽能够特异性地结合αγβ3整合素,从而增加癌细胞对碳点的摄取,有利于顺铂类药物发挥作用。韩国加图立大学的Kun等以柠檬酸与1-(3-氨基丙基)咪唑为前驱物制备了具有pH响应型的碳点[85]。该碳点能够利用亲疏水相互作用高效地负载DOX,并且在肿瘤的弱酸性条件下,咪唑基团的质子化会加速DOX的释放,从而实现针对肿瘤的特异性治疗。最近,吉林大学徐蔚青教授课题组以柠檬酸与双氰胺为前驱物,利用水热法制备了pH响应型的碳点。在中性条件下,该碳点在近红外区域没有吸收;而在肿瘤弱酸性刺激下,该碳点会发生聚集,形成碳点聚集体。与中性条件下的碳点相比,该碳点聚集体在近红外区域表现出明显的吸收,从而可以用于针对肿瘤的光热治疗[86]。该智能型碳点能够提高碳点对肿瘤细胞的选择性光热治疗效果,降低对正常细胞的光热损伤。随后,该课题组进一步利用线粒体靶向肽及癌细胞靶向肽对该碳点进行修饰,获得了具有癌细胞及线粒体双重靶向功能的碳点[87],该碳点具有良好的靶向肿瘤光热治疗效果,而对正常细胞没有明显光毒性。该碳点为开发针对肿瘤特异性治疗的碳纳米材料开辟了新的道路。
肿瘤细胞的快速增殖及其组织结构异常使得肿瘤组织表现出乏氧的特点,这一特点极大限制了Ⅱ型光动力治疗,而Ⅰ型光动力治疗受影响较小。南京邮电大学汪联辉课题组利用超声辅助热分离及后续的水合肼还原等方法制备了还原氧化石墨烯量子点[39],该量子点能够进行Ⅰ型光动力治疗,从而克服了乏氧对光动力治疗的限制,有利于提高肿瘤治疗效果。肿瘤组织处于高的氧化还原态,其内部过氧化氢含量远高于正常组织。因此,为了改善肿瘤乏氧环境,汪鹏飞和葛介超团队结合之前的工作,利用正电碳点还原高锰酸钾,制备了碳点/MnO2材料,并用聚乙二醇修饰形成水溶性的纳米杂化材料[88]。在正常生理条件下,该杂化材料的荧光被猝灭,同时,单线态氧产生能力被显著抑制,不具备磁共振成像能力。而在肿瘤微环境中,MnO2会在弱酸性环境中与过氧化氢反应,杂化材料结构破坏,正电碳的荧光及单线态氧产生能力得以恢复,并且产生的锰离子可以用于磁共振成像。同时,MnO2与过氧化氢反应产生的氧气可以缓解肿瘤的乏氧,有利于提高光动力治疗效果。该纳米杂化材料可以用于肿瘤微环境响应的荧光/磁共振双模态成像介导的改善肿瘤乏氧的增强光动力治疗。,2018年,汪鹏飞和葛介超团队进一步利用酞菁锰为前驱物,制备了MnO掺杂的具有1O2产生功能的碳点(图9)[40],MnO的掺入使得碳点具有磁共振成像功能,并且能够在肿瘤弱酸性的条件下与过度表达的H2O2反应生成氧气,肿瘤组织乏氧得到改善,从而增强碳点的光动力治疗效果。经过与DSPE-PEG组装后,该组装体能够用于小鼠体内的近红外荧光成像(发射峰在745 nm),最终可以实现荧光/磁共振成像介导的改善肿瘤乏氧的光动力治疗。此外,武汉大学张先正课题组在自然界光合作用的基础上提出了一种通过光分解水产生氧气的策略来解决肿瘤的乏氧[89]。他们在C3N4上负载碳点来增强材料在红光区域的吸收,这能够使得水在红光的照射下分解产生氧气。之后将含有原卟啉光敏剂的PEG与C3N4/碳点共组装,实现了改善肿瘤乏氧的光动力治疗。
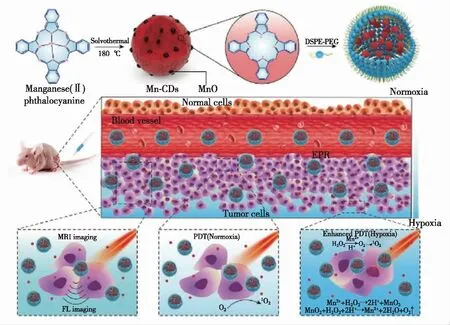
图9 MnO掺杂的碳点用于荧光/磁共振成像介导的改善肿瘤乏氧的增强光动力治疗示意图[40]
最近,针对肿瘤微环境的化学动力学治疗也引起了研究者们的关注。化学动力学治疗是指芬顿或类芬顿试剂(Fe,Cu,Co,Mn等离子)在肿瘤的弱酸性及H2O2过表达的条件下,利用芬顿反应将H2O2转化为高毒性的·OH,在所有的ROS中,·OH的毒性最强,从而能够有效地杀灭癌细胞[79,90]。碳点的结构特点使得其能够有效地负载金属离子,因此其在化学动力学治疗中有非常大的潜力。例如,林恒伟课题组以柠檬酸、聚乙烯亚胺为前驱物,甲酰胺为溶剂,采用溶剂热的方法制备了表面带有氨基的碳点;之后将小分子光敏剂Ce6接枝到碳点表面赋予碳点光动力治疗的特性;最后利用Cu2+与碳点络合,制备了具有GSH响应型的纳米组装体Cu/CC NPs(图10(a))[91]。掺入的Cu2+能够与GSH反应消耗GSH,之后使得Ce6光敏剂的荧光恢复,并且Cu+可以与过氧化氢反应产生·OH杀伤癌细胞。GSH消耗后会使得癌细胞对活性氧物种更加敏感,细胞更容易死亡,从而有利于提高肿瘤的光动力与化学动力学治疗效果。最终实现了GSH响应型的化学动力学/光动力/光热协同治疗效果(图10(b))。
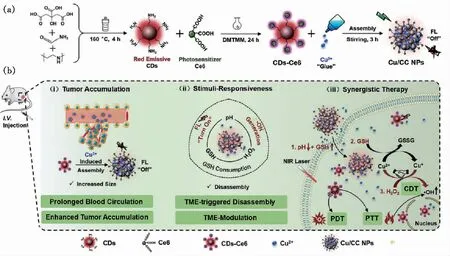
图10 (a)Cu/CC NPs制备示意图[91];(b)Cu/CC NPs用于GSH响应型的化学动力学/光动力/光热协同肿瘤治疗[91]。
细胞内氧化应激水平对细胞的生存状态具有关键性的影响,破坏细胞内的氧化还原稳态能够杀灭癌细胞。清华大学李景虹课题组和国家纳米科学中心梁兴杰团队合作,以柠檬酸与多烯多胺为原料,制备了表面带氨基的蓝光碳点,之后在碳点上成功负载了原子分散的Au,并在碳点表面修饰了肉桂醛与三苯基膦,制备了具有靶向线粒体的肿瘤治疗碳点基纳米材料mitoCAT-g[92]。修饰的三苯基膦能够赋予该碳点线粒体靶向的功能,材料进入线粒体后,原子分散的Au能够结合GSH,GSH损耗会提高线粒体内的氧化应激水平,肉桂醛能够产生活性氧物种,进一步提高了线粒体内的氧化应激程度损坏线粒体,引起癌细胞死亡,相关活体实验结果表明该碳点具有良好的肿瘤治疗效果。该工作进一步拓展了碳点在肿瘤治疗中的应用,为碳点类材料治疗肿瘤提供了新的思路。
5 总结及展望
近几年来,碳点在肿瘤治疗研究领域中发展迅猛,但仍处在起步阶段,离实际临床应用还有很大差距。
(1)尽管碳点具有优异的光学特性以及治疗性能,但是相较于小分子明确的结构,碳点的成分结构复杂,其由内部的sp2杂化碳核与表面功能性官能团组成,因此难以清晰地确定碳点的结构。并且碳点的发光机制众说纷纭。碳点内部结构与性能之间的关系不明确极大地限制了碳点在生物医学中的进一步应用。
(2)碳点的大批量稳定制备以及表面结构调控依然是一个极具挑战性的难题。为了解决上述问题,需要不断探索发展新的制备方法,发展新的表征技术手段,进一步揭示碳点结构与其诊疗特性的关系。
(3)碳点在生物体内的分布、安全性、体内代谢、作用机制、降解以及长期毒理学分析等需要解决的重要问题仍存在。
(4)目前用于光疗的碳点其发射/吸收波长多为红光或者红外光(600~950 nm),需要发展具有更长波长吸收或发射的碳点,进一步提高组织穿透深度,不断拓展碳点在肿瘤光诊疗中的应用。例如,发展在近红外二区(1 000~1 400 nm)具有吸收或发射特性的碳点,或具有双光子、三光子吸收特性的碳点。
(5)具有靶向癌细胞功能的碳点不仅能够增加癌细胞对该类材料的摄取,从而提高肿瘤治疗效果;同时也可以指导手术切除肿瘤范围的选择、术后治疗效果的评定,降低肿瘤复发率。因此,开发具有靶向肿瘤细胞功能的碳点同样是至关重要的。
(6)肿瘤微环境响应型碳点的开发已经取得了相关研究进展。但是,针对肿瘤微环境特点,设计制备具有多重特性的碳点用于肿瘤的磁动力、声动力、微波动力或化学动力学治疗仍然面临很大的挑战。
虽然碳点在肿瘤诊疗中面临众多挑战,但是随着生物学、化学以及纳米医学等相关领域的不断发展,上述问题都将会逐步得到解决,最终有望在临床上实现碳点对肿瘤的早期诊断与治疗。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210163.
