水稻ptc1隐性核不育系的创制及其配合力分析
2021-08-31李京琳李佳林李新鹏安保光吴永忠黄培劲
李京琳 李佳林 李新鹏 安保光 曾 翔 吴永忠 黄培劲 龙 湍
水稻隐性核不育系的创制及其配合力分析
李京琳 李佳林 李新鹏 安保光 曾 翔 吴永忠 黄培劲 龙 湍*
海南波莲水稻基因科技有限公司, 海南海口 570203
细胞质雄性不育系和光温敏雄性不育系是目前杂交水稻育种、制种中广泛利用的两种不育系, 然而这两种不育系分别具有组配不自由和育性不稳定的缺陷。隐性核雄性不育系可以克服上述缺陷, 创制、鉴定和利用细胞核雄性不育系将成为新一代杂交水稻技术的重要环节。本研究通过筛选9311的辐射诱变突变体库, 获得了一个无花粉型隐性核雄性不育突变体。图位克隆发现的突变位点位于9号染色体上, 是一段包含编码区在内259.37 kb的大片段缺失。共分离检测表明, 雄性不育表型是由突变位点造成的。通过分子标记辅助选择将突变位点回交转育至两系不育系C815S和三系保持系五丰B中, 在BC3F3世代分别获得与轮回亲本性状相似的隐性核不育系C815G和五丰G。配合力分析表明, C815G和五丰G分别具有与C815S和三系不育系五丰A基本相同的配合力水平。本研究为隐性核不育系的创制提供了新的基因和材料资源, 并证实了隐性核不育系代替现有三系和两系不育系的可行性。
水稻; 雄性不育;; 图位克隆; 回交转育; 配合力分析
水稻(L.)是最重要的粮食作物之一, 世界上超过1/2的人口以稻米为主食。据预计, 到2030年水稻产量必须增加40%才能满足世界人口增长的需求[1]。中国是稻米最大的生产国和消费国, 提高水稻产量是保障我国粮食安全和提高人民生活水平的基石[2]。利用杂种优势是提高水稻产量的有效方法之一[3], 杂交稻可以将水稻单产提高10%~20%[4]。目前, 我国的杂交水稻种植面积常年保持在1.3×108hm2以上。
我国杂交稻技术研究从1960年代开始, 共经历了3个阶段的发展[5]。第一阶段是以胞质不育为核心的“三系法”杂交稻技术。该技术是基于1970年发现的“野败”型细胞质雄性不育, 它的不育性状是由线粒体基因突变引起, 可以由核恢复基因()恢复育性[6-7], 因此可以构建一个包含不育系、保持系和恢复系的“三系”系统来实现杂交制种。1973年, 我国在东南亚和国际水稻所引进的品种中筛选出了优良的恢复系古154、泰引1号、IR24、IR665、桂选7号[8], 标志着三系配套的成功[9]。然而由于恢保关系的限制, 细胞质雄性不育的可利用种质资源仅为5%, 亲本间遗传多样性小, 杂种优势的潜力无法得到充分利用[5]。第二阶段是以光温敏不育系为核心的“两系法”杂交稻技术。两系法是利用其在一定的光温环境下植株表现出雄性不育, 而在另一光温环境下转变为正常可育的特性来分别实现杂交制种和自交繁殖。生产上常用的光温敏不育系的育性性状多由、和控制[10]。自1985培育出第一个两系不育系后, “两系法”杂交稻目前已占全国杂交水稻播种面积的35%左右, 成为水稻杂种优势利用的重要途径[11]。“两系法”较“三系法”具有诸多优越性: 其一, 两系的不育性状为核基因控制, 不受恢保关系的限制, 因而选育新品种的几率更大。其二, 不育系可以一系两用, 减少育种工序和时间成本, 是快速繁育杂交水稻新品种的新途径。其三, 两系不育系有丰富的种质资源, 对培育多样化的杂交稻有极大的促进作用[12]。然而, 环境变化引起的不育系育性转换将极大增加制种失败的风险。第三阶段将是以隐性核雄性不育系为核心的“遗传智能化育种技术”[13]。隐性核雄性不育的育性由核基因单独控制, 不受环境等外部因素的影响, 育性稳定, 可利用的种质资源广, 因此是杂交育种的理想材料。隐性核不育系无法通过常规方法大量繁殖, 在生产上的应用一直受到限制[14]。直到最近, SPT技术(seed production technology)的出现解决了隐性核不育系的繁殖问题, 使在水稻上大规模利用隐性核不育系进行育种、制种成为可能[15-16]。由于该技术将现代生物技术和传统杂交育种技术相结合, 这将是育种史上的一次巨大变革, 可能给水稻产量带来大幅度的提高。
目前在水稻中已有超过20个隐性核不育基因被克隆[17], 其中调控从四分体时期到花粉成熟时期小孢子发育的基因被认为是最理想的隐性核不育基因。这一过程中, 绒毡层细胞起着决定性的作用。水稻中绒毡层的早期发育受Undeveloped Tapetum1 ()基因调控[18], 它是一种loop- helx-loop (bHLH)转录因子, 在突变体中, 绒毡层降解延迟, 导致小孢子败育。最近发现另一个bHLH因子TDR, 它是绒毡层程序性死亡(programmed cell death, PCD)的调控基因, 该基因的突变使绒毡层的PCD启动延迟, 花粉壁因无法获得前体物质而形成受阻[19-20]。在拟南芥中,的直系同源基因同样具有调控绒毡层PCD的功能[21]。Zhang等[22]研究发现TDR还能与EAT1互作, 两者共同调控PCD的过程。此外, Huang等[23]克隆了一个基因, 它编码一个679个氨基酸的PHD锌指蛋白, 是绒毡层PCD的关键基因。PTC1 (OsMS1)蛋白还能够与OsMADS15和TIP2蛋白互作, 并通过调控基因的表达, 进而调控绒毡层的PCD过程[24]。在PTC1的缺失突变体植株中, 绒毡层细胞无限制分裂及增大, 导致绒毡层细胞降解延迟, 乌氏体形成异常, 花粉壁发育缺陷,从而引起完全雄性不育。
除了雄性育性性状外, 杂种优势潜力也是评价一个不育系优劣的重要标准。杂种优势是子一代表现出超越双亲平均值或高于任何一亲本的现象[25], 而有研究表明光温敏不育基因就是一个杂种优势的QTL位点[26]。利用隐性核不育基因替换光温敏不育基因或胞质不育基因后, 新不育系是否能保持原不育系的配合力水平, 目前尚无报道。为了调查不育基因对不育系配合力的影响, 本研究首先筛选并鉴定了一个大片段缺失型的新等位突变位点, 然后将该突变位点导入优良的两系不育系C815S和三系保持系五丰B中获得了相应的隐性核不育系。对F1表型的分析表明隐性核不育系与相应的两系或三系不育系具有相似水平的配合力。研究结果显示了隐性核不育系用于杂交水稻育制种的可行性,的克隆也为隐性核不育系的创制提供了新的基因和材料资源。
1 材料与方法
1.1 试验材料
突变体是通过Co60辐射诱变籼稻9311 (9311)获得[27]。籼稻品种明恢63和9311用于构建和的F2定位群体。两系不育系C815S和三系保持系五丰B作为轮回亲本, 构建带有位点的核不育系。R524、R329、R315、R9773、R9103、R730、华占、R6-7、R809、R5431、R51084、R177、海恢9380、福丰1658、岳恢9113等15个材料作为父本, 用于配制杂交种。以上材料由海南波莲水稻基因科技有限公司从相应材料选育单位引进。
1.2 突变体筛选和表型鉴定
2013年11月于海南临高播种9311突变体库中的M2家系共计3617份, 在盛花期筛选花药异常株系, 取其小花在体式显微镜下仔细观察花的各部分结构, 并用碘-碘化钾溶液(0.6% KI, 0.3% I2)鉴定花粉的育性, 以野生型9311作为对照。对于花粉碘染显示完全不育的家系, 在田间观察突变体与野生型的株高、穗长、花期、叶色等农艺性状并照相记录, 对突变体材料套袋自交, 并与明恢63杂交, 统计其结实情况。
1.3 遗传和定位分析
2015年10月在海南临高用9311和明恢63作父本分别与杂交。2016年2月在临高种植F1并观察其表型, 分别混收2个组合F1的自交种。2016年7月在临高种植2个F2群体, 并统计2个群体中雄性不育株与正常植株的分离情况。使用明恢63/群体的458株F2植株, 根据Michelmore等[28]的BSA (bulked segregation analysis)法进行基因定位。用于检测分子标记的PCR反应程序为: 94℃变性5 min, 95℃变性20 s, 55℃复性20 s, 72℃延伸30 s, 30个循环, 最后72℃补充延伸5 min。PCR产物经6%聚丙烯酰胺变性凝胶电泳, 1% AgNO3染色10 min, 在0.5%甲醛和2% NaOH混合液中显影后照相读带。
1.4 突变位点的克隆与验证
根据定位结果, 参考ASM465v1 (http://plants. ensembl.org/Oryza_indica/Info/Index)版本的9311基因组序列, 在连锁区段开发分子标记精细定位突变位点。参照刘耀光等[29]的侧翼序列分离方法分离突变位点序列, 根据突变位点序列设计共分离标记, 并用F2定位群体进行共分离验证。
用于侧翼序列分离的PCR反应分3步进行: 第一步, 使用引物对1664sp1_F和1664AC1_R扩增突变体基因组DNA, 反应程序为: 93℃预热2 min, 95℃变性1 min; 94℃变性30 s, 60℃复性1 min, 72℃延伸3 min, 10个循环; 94℃变性30 s, 20℃复性2 min, 72℃延伸3 min; 94℃变性20 s, 58℃复性1 min, 72℃延伸3 min, 25个循环; 72℃延伸5 min。第二步, 使用引物对1664sp2_F和1664AD1_R扩增第一步产物的40倍稀释液, 反应程序为: 94℃变性20 s, 65℃复性1 min, 72℃延伸3 min; 94℃变性20 s, 68℃复性1 min, 72℃延伸3 min, 94℃变性20 s, 68℃复性1 min, 72℃延伸3 min, 94℃变性20 s, 50℃复性1 min, 72℃延伸3 min, 13个循环; 72℃延伸5 min。第三步, 使用引物对1664sp3_F和1664AD2_R扩增第二步产物的10倍稀释液, 反应程序为: 94℃变性20 s, 68℃复性1 min, 72℃延伸3 min, 94℃变性20 s, 68℃复性1 min, 72℃延伸3 min, 94℃变性20 s, 50℃复性1 min, 72℃延伸3 min, 6~7个循环; 72℃补充延伸5 min。

表1 本研究所用的部分引物

(续表1)
1.5 ptc1-2核不育系的获得
选用优良的两系不育系C815S、三系保持系五丰B作为母本, 与的杂合株杂交, 用突变体特异的分子标记(1664F1、1664R1和1664R2)筛选出突变位点杂合型的F1, 种植F1并连续回交3次。每次先用突变体特异标记和的功能标记[30]筛选2位点为杂合型的株系, 再用多态标记筛选回复率高的株系进入下一轮回交。将获得的BC3F1自交, 用突变体特异标记和的功能标记筛选BC3F2植株, 其中只含有纯合突变位点且不含有位点的单株, 即为相应的核不育系, 分别命名为C815G和五丰G。观察C815G、五丰G、C815S和五丰A的农艺性状, 并照相记录, 用碘-碘化钾分析花粉育性情况。调查植株的株高、抽穗期、穗粒数、穗长、粒长和粒宽, 参照Griffing等[31]的显著性分析方法, 分析C815G和C815S, 五丰G和五丰A在这6个农艺性状上的差异。
1.6 杂交种配制
2018年夏在临高, 以C815G、五丰G、C815S和五丰A为母本, R524、R329、R315、R9773、R9103、R730、华占、R6-7、R809、R5431、R51084、R177、海恢9380、福丰1658和岳恢9113为父本, 根据不完全双列杂交(North Carolina mating design II, NCII)的方法配制杂交组合。
1.7 配合力分析
2019年春, 将配制的60个杂交组合种植于海南临高基地(抽穗期间日均温26~33℃, 日照时长13.1 h)的2个测试点, 按随机区组试验设计, 每点重复2次。每个组合种植5行, 每行7株, 单株栽植, 株行距为15 cm × 20 cm。在开始抽穗后, 调查抽穗期; 在黄熟期, 随机选取中间3株调查总分蘖数、株高、穗长(每株测量5穗)。收取3~5株的种子, 自然干燥后测量粒长、粒宽、穗粒数、结实率、千粒重、单株产量。统计由同一母本配制的杂交组合在各个农艺性状的平均值, 分析不同母本所配制的杂交组合的表型差异。参考黄远樟等[32]的方法分析一般配合力和特殊配合力, 用DPS软件分析2套NCII组合的配合力情况[33]; 根据Griffing等[31]的表型变异方差公式:2P=2G+2E估算父母本对组合间表型变异的贡献率。
2 结果与分析
2.1 突变体表型
从辐射突变体库中1664号家系的M2代群体中找到4株雄性不育突变体, 将其命名为。比较与野生型9311的株高、穗长、叶色、抽穗期等农艺性状, 发现均无显著差别(图1-A, B)。解剖小花观察可见,的花药明显变小、变白(图1-C)。用碘-碘化钾将花药染色后在显微镜下观察, 野生型的花粉粒被染成深紫色(图1-D), 而观察不到花粉颗粒(图1-E)。突变体在套袋自交情况下不结实, 而在作为母本与明恢63和9311杂交时能正常结实, 说明突变体是雄性完全不育突变体。2018年冬, 在海南陵水鉴定了突变体的温敏特性, 结果显示在低温下无法恢复育性, 表明该突变体不受光温环境的影响, 为隐性核不育突变体。
2.2 ptc1-2的定位
突变体与野生型9311、明恢63杂交所获得的所有F1植株正常可育, 而F2群体中可观察到育性分离。其中/9311的F2群体中不育株与可育株分别为92株、312株,/明恢63的F2群体中不育株与可育株分别为107株、351株。卡方检测表明, 2个群体中不育株与正常株的比例都符合1∶3的分离比(表2),突变体表型由核隐性单基因控制。
从400对SSR或InDel标记中筛选到169对在9311和明恢63之间有多态的标记, 从中选取均匀分布于水稻12条染色体上的129对多态标记分别分析/明恢63群体中突变体和正常株的DNA混合池, 获得位于9号染色体上的2个与不育表型紧密连锁的标记RM7039、RM257 (图2-A)。用RM7039和RM257标记分别扩增50个突变单株, 各检测到8个和5个交换单株(图2-B), 进一步证实就定位于这一区段内。然而, 使用位于RM7039和RM257之间的标记D9.168扩增这50个单株时, 没有条带扩增出来(图2-B)。

图1 ptc1-2突变体及野生型9311的表型
A: 灌浆期野生型9311和突变体的植株; B: 蜡熟期野生型9311和突变体的穗; C: 野生型9311和突变体的花器官; D: 野生型9311的花粉碘染; E:突变体植株的花粉碘染。标尺: 15 cm (A); 3 cm (B); 2 mm (C); 150 μm (D)。
A: plants of 9311 andmutant at filling stage; B: panicles of 9311 andmutant at ripening stage; C: floral organs of 9311 andmutant; D: pollen grains of 9311; E: pollen grains ofmutant. Scale bars: 15 cm (A); 3 cm (B); 2 mm (C); 150 μm (D).

图2 ptc1-2的图位克隆
A:位点粗定位在9号染色体长臂的RM7039和RM257两个标记间; B:基因精细定位至D3102和D3676之间, 物理距离为573 bp; C:位点包含从第15,324,556 bp到第15,583,926 bp共259,370 bp缺失, 该缺失片段包含整个基因。
A: thelocus was first mapped to an interval between RM7039 and RM257 on the long arm of chromosome 9; B:was fine mapped to an interval of 573 base pairs between D1380 and D3676; C: thelocus consisted of a 259,370 base-pair deletion from position 15,324,556 base-pair to position 15,583,926 base-pair. The deletion fragment contained the entire coding region of.

表2 ptc1-2突变体的遗传分析
2.3 突变位点序列克隆及验证
根据9311基因组序列, 在标记D9.168附近开发了10个新标记, 并用50个突变单株分析这些标记的扩增情况。其中标记D27420、D27560、D461、D3102能扩增出条带, 而标记D3676、D5146、D27580、D27590、D27650、D27820不能扩增出条带, 推测可能存在一个大片段缺失。标记D3102和标记D3676之间的物理距离为573 bp (图2-B)。在标记D3102的上游设计3条热不对称PCR特异引物(表1), 随机引物序列参照刘耀光等[29]设计。使用热不对称PCR经过2轮扩增后获得部分较亮的条带(图3-A), 条带经测序分析后发现突变体在9号染色体第15,324,556位碱基到第15,583,926位碱基处存在259,370 bp的碱基缺失。该缺失片段内包含19个完整的开放阅读框(open reading frame, ORF), 其中一个ORF为基因(图2-C)。故将该突变位点命名为。
根据缺失序列, 设计了一组特异的三引物(1664F1, 1664R1, 1664R2)标记(图2-C)。使用该标记对/明恢63的F2分离群体进行PCR扩增, 结果显示所有雄性不育表型的F2植株扩增出的产物均为546 bp, 表明发生了259,370 bp片段的纯合缺失。而表型正常的F2植株扩增出的产物均为811 bp, 或546 bp和811 bp两种带型(图3-B), 表明不存在259,370 bp片段的缺失或只有一条染色体带有259,370 bp片段的缺失。这个结果表明259,370 bp片段的缺失与不育表型共分离。
2.4 ptc1-2核不育系的转育
为了分析隐性核不育基因对杂种优势的影响, 本研究以为供体, 通过回交转育的方法将位点导入到C815S和五丰B中, 分别得到的核不育系C815G和五丰G。在C815G和五丰G中,位点被剔除。如图4所示, C815G与C815S (图4-A~C), 以及五丰G和五丰A (图4-F~H)的株高、穗长、叶色、抽穗期、小穗、小花等农艺性状均无明显差别。统计分析显示, C815G和C815S, 五丰G和五丰A在株高、抽穗期、穗粒数、穗长、粒长和粒宽等性状上均无显著差异(表3)。值得注意的是C815S (图4-D)、C815G (图4-E)和五丰G (图4-J)均为无花粉型不育系, 五丰A (图4-I)为花粉败育型不育系。用182对多态标记检测C815G和五丰G的遗传背景, 回复率分别达到了95.4%、96.7%。

图3 ptc1-2位点侧翼序列的分离及共分离分析
A:位点两侧基因组序列分离第2轮TAIL-PCR扩增结果; B:突变体的共分离验证。雄性不育表型的F2植株扩增出的产物长546 bp, 而表型正常的F2植株扩增出的产物长811 bp或同时有546 bp和811 bp两条带。M为D2000 marker。
A: the second round of TAIL-PCR results for isolation of genomic sequences flanking thelocus; B: co-segregation analysis of thelocus with the male sterile phenotype. All PCR products of F2sterile plants were 546 bp in length. The size of PCR products of F2fertile plants was either 811 bp, or 546 bp, and 811 bp. M: DNA 2000 bp marker.
2.5 核不育系的配合力分析
为了分析转育后不育系的配合力是否发生了改变, 用C815G、C815S、及五丰G和五丰A分别作为母本与15个测试父本, 按照NCII设计进行配组, 获得2套NCII组合。对这2个NCII群体进行10个农艺性状的表型考察及配合力分析, 结果显示, 除株高外, 2对母本配制的杂交组合间表型没有显著差异(表4)。但值得注意的是, 个别父本配制的杂交组合结实率有较大提高, 例如, 五丰A/R9773的结实率只有63.5%, 而五丰G/R9773的结实率却提高到92.9%。

图4 C815G和五丰G的表型
A: 抽穗期C815S和C815G的植株; B: C815S和C815G的小穗; C: C815S和C815G花器官; D: C815S的花粉碘染; E: C815G的花粉碘染; F: 抽穗期五丰A和五丰G的植株; G: 五丰A和五丰G的小穗; H: 五丰A和五丰G花器官; I: 五丰A的花粉碘染; J: 五丰G的花粉碘染。标尺: 10 cm (A, F); 0.5 cm (B, C, G, H); 200 μm (D, E, I, J)。
A: phenotypes of C815S and C815G plants at heading stage; B: spikelets of C815S and C815G; C: floral organs of C815S and C815G; D: pollen grains of C815S; E: pollen grains of C815G; F: phenotypes of Wufeng A and Wufeng G plants at heading stage; G: spikelets of Wufeng A and Wufeng G; H: floral organs of Wufeng A and Wufeng G; I: pollen grains of Wufeng A; J: pollen grains of Wufeng G. Scale bars: 10 cm (A, F); 0.5 cm (B, C, G, H); 200 μm (D, E, I, J).

表3 C815S、C815G、五丰A和五丰G的农艺性状分析
方差分析结果如表5和表6。除株高性状以外, 母本间的差异对杂交组合其他9个性状的影响并不显著(>0.05), 说明C815G和五丰G分别与不育系C815S和五丰A基本不存在差异。同时根据NCII的方差分析, 本研究估算了父母本的表型贡献率, 发现无论是在以C815S和C815G为母本配制的组合中, 还是在以五丰A和五丰G为母本配制的组合中, 株高表型变异的主要提供者是父本, 分别为43.67%和21.32%, 而母本材料对株高表型的变异贡献仅占4.68%和11.80%。说明尽管母本间的差异显著影响配组材料间的株高表型, 但其在决定表型变异程度上依然很小。综上, NCII的方差分析说明, 利用进行育性改良并未明显改变原有不育系的性状。

表4 C815G和五丰G配制的杂交组合的表型
*表示差异达到0.05显著水平; C815S/+、C815G/+、五丰A/+和五丰G/+分别表示C815S、C815G、五丰A、五丰G配制的杂交组合。
*indicates significant differences at the 0.05 probability levels; C815S/+, C815G/+, Wufeng A/+, and Wufeng G/+ indicate the hybrids of C815S, C815G, Wufeng A, and Wufeng G, respectively.
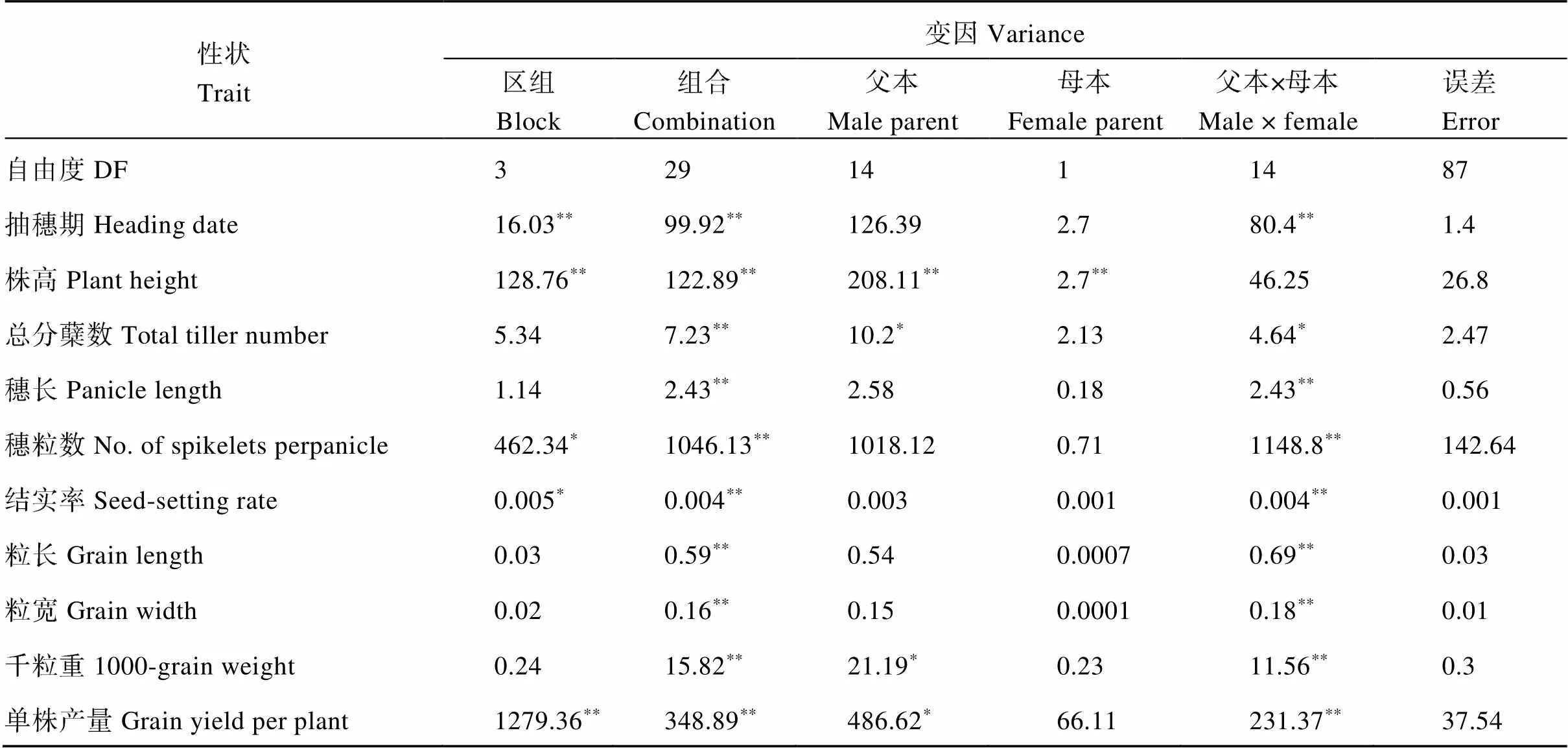
表5 C815S和C815G的田间配合力方差分析
**、*分别表示差异达到0.01和0.05显著水平。
**and*indicate significant differences at the 0.01 and 0.05 probability levels, respectively.

表6 五丰A和五丰G的田间配合力方差分析
**和*分别表示差异达到0.01和0.05显著水平。
**and*indicate significant differences at the 0.01 and 0.05 probability levels, respectively.
此外, 本研究计算了C815S与C815G, 五丰A与五丰G的一般配合力相对效应值, 如表7所示。C815S与C815G、五丰A与五丰G的一般配合力相对效应值在所有性状上差异都不大。上述结果表明, 母本的一般配合力相似。
3 讨论
利用图位克隆的方法, 本研究从9311辐射诱变突变体中克隆了一个新的突变位点。该突变位点是一个259.37 kb的大片段缺失, 包括在内的19个ORF均位于该缺失区段内。前人的报道中,编码一个PHD锌指蛋白, 参与花粉外壁的形成和绒毡层的发育。突变后造成水稻雄性不育, 但对其他农艺性状没有明显影响[22]。因此推测的雄性不育表型是由缺失造成。除外, 另外18个基因的缺失并未造成明显突变表型, 表明这些基因可能为水稻的非必需基因。Wang等[34]分析3010份水稻品种重测序数据发现, 有37.9%的基因为非必需基因, 这些基因通常会在不同个体中出现或缺失, 但不影响个体的生长发育。因此,的大片段缺失可能并不影响其在生产上应用。
配合力是衡量一个材料是否具有杂种优势的重要指标, 它的测定方法包括双列杂交法、顶交法和多系测交法, 其中不完全双列杂交法(NCII)是不育系配合力测定的有效方法[35]。为了探究核不育系对杂种优势的影响, 本研究设计了2组NCII交配试验, 分别分析了C815G与C815S, 五丰G与五丰A的配合力情况。2组结果均显示除株高1个性状外, 其它9个性状在母本间的差异均不显著, 表明不育系改良前后配合力水平相似。为了确定杂交组合中株高差异的主要来源, 本研究估算了2组群体中父母本对株高变异的贡献率, 结果显示母本材料对株高表型的变异贡献仅占4.68%和11.80%, 而父本贡献率达到43.67%和21.32%, 表明组合间的显著差异主要来源于父本。本研究使用了15个不同来源的恢复系作为测试亲本, 其遗传基础广泛, 更能有效降低与被测亲本间的互作效应, 从而提高配合力测定水平[36]。

表7 田间一般配合力相对效应值
目前杂交水稻生产中常用的三系和两系不育系都有缺陷, 如育性不稳定, 可利用种质资源狭小, 制种成本高等。发展新的育种、制种技术成为杂交水稻产业发展的迫切需求[37]。隐性核不育系具有恢复基因广泛存在, 育性稳定等特点, 可以很好的克服三系和两系不育系的缺点[14-15]。在本研究中五丰G与五丰A配制的杂交组合的平均结实率虽然没有显著差异, 但个别组合如五丰G/R9773的结实率比五丰A/R9773的结实率提高了近30%。一个可能的解释是使用位点替换三系不育系的核质互作不育系统后, 解除了恢复系和不育系的恢保关系限制, 从而提高了F1代的结实率。但考虑到五丰G的转育过程, 五丰G遗传背景中不可避免的会带有少量9311的遗传背景, 因此也不能完全排除少量9311遗传背景的导入对结实率产生了影响。鲍海滢等[38]利用100个AFLP标记分析3个中国春小麦的BC9近等基因系, 发现它们仍有约0.22%的背景差异, 表明遗传差异仍然会存在于表型十分相似的植株里。使用更多的三系恢复系与五丰G和五丰A配组进行结实率分析, 将进一步验证隐性核不育系在大幅增加恢复基因来源和提高种质资源利用率方面的优势。此外, 五丰G为无花粉型不育, 比碘败型的五丰A不育更彻底, 同时育性也不受光温环境的影响, 显示出隐性核不育系在杂交稻制种安全性方面的优势。
4 结论
本研究利用图位克隆的方法从一个籼稻9311辐射诱变突变体中鉴定了一个新的等位突变位点。位点控制雄性不育表型, 不育性状不受光温环境影响, 也不影响水稻其他农艺性状。利用位点创制的隐性核不育系C815G和五丰G保持了相应三系和两系不育系的配合力, 显示了核不育系具有与两系和三系不育系相当的杂种优势潜力。本研究为核不育系的利用提供了理论依据, 也提供了新的基因和材料资源。
致谢:中国科学院亚热带农业生态研究所孙亮副研究员给予本文细致的修改, 谨此致谢。
[1] Khush G S. What it will take to feed 5.0 billion rice consumers in 2030., 2005, 59: 1–6.
[2] 余四斌, 熊银, 肖景华, 罗利军, 张启发. 杂交稻与绿色超级稻. 科学通报, 2016, 61: 3797–3803.
Yu S B, Xiong Y, Xiao J H, Luo L J, Zhang Q F. Hybrid rice and green super rice., 2016, 61: 3797–3803 (in Chinese).
[3] Tester M, Langridge P. Breeding technologies to increase crop production in a changing world., 2010, 327: 818–822.
[4] Normile D. Agricultural research: reinventing rice to feed the world., 2008, 321: 330–333.
[5] Wang H, Deng X W. Development of the “Third-Generation” hybrid rice in China., 2018, 16: 393–396.
[6] Tang H, Luo D, Zhou D, Zhang Q, Tian D, Zheng X, Chen L, Liu Y G. The rice restorerfor wild-abortive cytoplasmic male sterility encodes a mitochondrial-localized PPR protein that functions in reduction oftranscripts., 2014, 7: 1497–1500.
[7] Luo D, Xu H, Liu Z, Guo J, Li H, Chen L, Fang C, Zhang Q, Bai M, Yao N, Wu H, Wu H, Ji C, Zheng H, Chen Y, Ye S, Li X, Zhao X, Li R, Liu Y G. A detrimental mitochondrial-nuclear interaction causes cytoplasmic male sterility in rice., 2013, 45: 573–577.
[8] 任光俊, 颜龙安, 谢华安. 三系杂交水稻育种研究的回顾与展望. 科学通报, 2016, 61: 3748–3760.
Ren G J, Yan L A, Xie H A. Retrospective and perspective on indica three-line hybrid rice breeding research in China., 2016, 61: 3748–3760 (in Chinese).
[9] 袁隆平. 水稻的雄性不孕性. 科学通报, 1966, 17(4): 185–188.
Yuan L P. Hybrid rice and green super rice., 1966, 17(4): 185–188 (in Chinese).
[10] Fan Y, Zhang Q. Genetic and molecular characterization of photoperiod and thermo-sensitive male sterility in rice., 2017, 31: 1–12.
[11] Hu Z, Tian Y, Xu Q. Review of extension and analysis on current status of hybrid rice in China., 2016, 31: 1–8.
[12] 袁隆平. 两系法杂交水稻研究的进展. 中国农业科学, 1990, 23(3): 1–6.
Yuan L P. Progress of two-line system hybrid rice breeding., 1990, 23(3): 1–6 (in Chinese with English abstract).
[13] 袁隆平. 第三代杂交水稻初步研究成功. 科学通报, 2016, 61: 3404–3404.
Yuan L P. Third-generation hybrid rice preliminary research success., 2016, 61: 3404–3404 (in Chinese).
[14] Wan X, Wu S, Li Z, Dong Z, An X, Ma B, Tian Y, Li J. Maize genic male-sterility genes and their applications in hybrid breeding: progress and perspectives., 2019, 12: 321–342.
[15] Wu Y, Fox T W, Trimnell M R, Wang L, Xu R, Cigan A M, Huffman G A, Garnaat C W, Hershey H, Albertsen M C. Development of a novel recessive genetic male sterility system for hybrid seed production in maize and other cross-pollinating crops., 2015, 14: 1–9.
[16] Chang Z, Chen Z, Wang N, Xie G, Lu J, Yan W, Zhou J, Tang X, Deng X W. Construction of a male sterility system for hybrid rice breeding and seed production using a nuclear male sterility gene., 2016, 113: 14145–14150.
[17] 马西青, 方才臣, 邓联武, 万向元. 水稻隐性核雄性不育基因研究进展及育种应用探讨. 中国水稻科学, 2012, 26: 511–520.
Ma X Q, Fang C C, Deng L W, Wan X Y. Research progress and breeding application of recessive genic male sterility genes in rice., 2012, 26: 511–520 (in Chinese with English abstract).
[18] Jung K H, Han M J, Lee Y S, Kim Y W, Hwang I H, Kim M J, Kim Y K, Nahm B H, An G. Riceis a major regulator of early tapetum development., 2005, 17: 2705–2722.
[19] Yang Z, Sun L, Zhang P, Zhang Y, Yu P, Liu L, Abbas A, Xiang X, Wu W, Zhan X, Cao L, Cheng S., encoding a PHD-finger transcription factor, regulates Ubisch bodies and pollen wall formation in rice., 2019, 99: 844–861.
[20] Li N, Zhang D S, Liu H S, Yin C S, Li X X, Liang W Q, Yuan Z, Xu B, Chu H W, Wang J, Wen T Q, Huang H, Luo D, Ma H, Zhang D B. The ricegene is required for tapetum degradation and anther development., 2006, 18: 2999–3014.
[21] Han Y Y, Zhou H Y, Xu L, Liu X Y, Fan S X, Cao J S. The zinc-finger transcription factorand its orthologs in Cruciferae which are required for pollen development., 2018, 503: 998–1003.
[22] Niu N, Liang W, Yang X, Jin W, Wilson Z A, Hu J, Zhang D. EAT1 promotes tapetal cell death by regulating aspartic proteases during male reproductive development in rice., 2013, 4: 1–11.
[23] Li H, Yuan Z, Vizcay-Barrena G, Yang C, Liang W, Zong J, Wilson Z A, Zhang D.encodes a PHD-finger protein that is required for tapetal cell death and pollen development in rice., 2011, 156: 615–630.
[24] Yang Z, Liu L, Sun L, Yu P, Zhang P, Abbas A, Xiang X, Wu W, Zhang Y, Cao L, Cheng S.functions as a transcriptional activator to regulate programmed tapetum development and pollen exine formation in rice., 2019, 99: 175–191.
[25] Springer N M, Stupar R M. Allelic variation and heterosis in maize: How do two halves make more than a whole?, 2007, 17: 264–275.
[26] Huang X, Yang S, Gong J, Zhao Q, Feng Q, Zhan Q, Zhao Y, Li W, Cheng B, Xia J, Chen N, Huang T, Zhang L, Fan D, Chen J, Zhou C, Lu Y, Weng Q, Han B. Genomic architecture of heterosis for yield traits in rice., 2016, 537: 629–633.
[27] 龙湍, 安保光, 李新鹏, 张维, 李京琳, 杨瑶华, 曾翔, 吴永忠,黄培劲. 籼稻9311辐射诱变突变体库的创建及其筛选. 中国水稻科学, 2016, 30: 44–52.
Long T, An B G, Li X P, Zhang W, Li J L, Yang Y H, Zeng X, Wu Y Z, Huang P J. Construction and screening of an irradiation- induced mutant library ofrice 93-11., 2016, 30: 44–52 (in Chinese with English abstract).
[28] Michelmore R. Molecular approaches to manipulation of disease resistance genes., 1995, 33: 393–427.
[29] Liu Y G, Chen Y. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences., 2007, 43: 649–656.
[30] 张华丽, 陈晓阳, 黄建中, 鄂志国, 龚俊义, 舒庆尧. 中国两系杂交水稻光温敏核不育基因的鉴定与演化分析. 中国农业科学, 2015, 48: 1–9.
Zhang H L, Chen X Y, Huang J Z, E Z G, Gong J Y, Shu Q Y. Identification and transition analysis of photo-/thermo-sensitive genic male sterile genes in two-line hybrid rice in China., 2015, 48: 1–9 (in Chinese with English abstract).
[31] Griffing B. Concept of general and specific combining ability in relation to diallel crossing systems., 1956, 9: 463–493.
[32] 黄远樟, 刘来福. 作物数量遗传学基础六、配合力: 不完全双列杂交. 遗传, 1980, 2(2): 45–48.
Huang Y Z, Liu L F. The basis of quantitative genetics in crops Ⅵ. Combining ability: incomplete diallel cross., 1980, 2(2): 45–48 (in Chinese).
[33] Tang Q Y, Zhang C X. Data Processing System (DPS) software with experimental design, statistical analysis and data mining developed for use in entomological research., 2013, 20: 254–260.
[34] Wang W, Mauleon R, Hu Z, Chebotarov D, Tai S, Wu Z, Li M, Zheng T, Fuentes R R, Zhang F, Mansueto L, Copetti D, Sanciangco M, Palis K C, Xu J, Sun C, Fu B, Zhang H, Gao Y, Zhao X, Shen F, Cui X, Yu H, Li Z, Chen M, Detra J, Zhou Y, Zhang X, Zhao Y, Kudrna D, Wang C, Li R, Jia B, Lu J, He X, Dong Z, Xu J, Li Y, Wang M, Shi J, Li J, Zhang D, Lee S, Hu W, Poliakov A, Dubchak I, Ulat V J, Borja F N, Mendoza J R, Ali J, Li J, Gao Q, Niu Y, Yue Z, Naredo M E, Talag J, Wang X, Li J, Fang X, Yin Y, Glaszmann J C, Zhang J, Li J, Hamilton R S, Wing R A, Ruan J, Zhang G, Wei C, Alexandrov N, McNally K L, Li Z, Leung H. Genomic variation in 3,010 diverse accessions of Asian cultivated rice., 2018, 557(7703): 43–49.
[35] Comstock R E, Robinson H F, Harvey P H. A breeding procedure designed to make maximum use of both general and specific combining ability., 1949, 41: 360–367.
[36] Matzinger D F. Comparison of three types of testers for the evaluation of inbred lines of corn., 1953, 45: 493–495.
[37] 邓兴旺, 王海洋, 唐晓艳, 周君莉, 陈浩东, 何光明, 陈良碧, 许智宏. 杂交水稻育种将迎来新时代. 中国科学: 生命科学, 2013, 43: 864–868.
Deng X W, Wang H Y, Tang X Y, Zhou J L, Chen H D, He G H, Chen L B, Xu Z H. Hybrid rice breeding welcomes a new era of molecular crop design.(Vitae), 2013, 43: 864–868 (in Chinese with English abstract).
[38] 鲍海滢, 刘秉华, 王山荭, 杨丽, 夏兰芹. 矮败小麦近等基因系的分子检测. 作物学报, 2001, 27: 541–543.
Bao H Y, Liu B H, Wang S H, Yang L, Xia L Q. Molecular assessment of NILs of dwarfing sterile wheat., 2001, 27: 541–544 (in Chinese with English abstract).
Creation and combining ability analysis of recessive genic sterile lines with a newlocus in rice
LI Jing-Lin, LI Jia-Lin, LI Xin-Peng, AN Bao-Guang, ZENG Xiang, WU Yong-Zhong, HUANG Pei-Jing, and LONG Tuan*
Hainan Bolian Rice Gene Technology Co., Ltd., Haikou 570203, Hainan, China
Cytoplasmic male sterile (CMS) lines and photoperiod/thermo-sensitive genic male sterile (PTGMS) lines are widely used as female parents in the commercial production of rice hybrid seeds. however, both systems have their intrinsic defects such as low usage of germplasm resources and unstable sterility. Recessive genic male sterile (GMS) lines, which overcome the problems of CMS and PTGMS lines, have played a key role in the development of next generation technologies for rice hybrid seed production. In this study, a GMS mutantwithout pollen grains was identified from an irradiation-induced mutant library of 9311. Using a map-based cloning approach, a 257.37 kb deletion region was detected, which contained entire coding region ofon chromosome 9. PCR co-segregation analysis showed that the male sterility was completely associated with thedeletion region. Thedeletion locus was then introgressed into a PTGMS line C815S and a CMS maintainer line Wufeng B by marker-assisted backcrossing. Corresponding GMS lines C815G and Wufeng G were obtained at BC3F3generation, which showed the phenotypical similarity to the C815S and Wufeng B lines, respectively. Combining ability tests revealed that C815G and Wufeng G had the same combining ability as C815S and the CMS line Wufeng A in conventional field, respectively. These results indicated thatwas a new allele of, which could be applied for breeding GMS linesand be the potential of GMS lines in rice hybrid seed production.
rice; male sterile;; map-based cloning; backcrossing; combining ability test
10.3724/SP.J.1006.2021.02076
本研究由中国水稻研究所水稻生物学国家重点实验室开放课题项目(20190203)资助。
This study was supported by the Open Project of State Key Laboratory of Rice Biology Foundation of China Rice Research Institute (20190203).
龙湍, E-mail: longtuan2001@aliyun.com, Tel: 0898-66184571
E-mail: 250864463@qq.com
2020-11-15;
2021-03-19;
2021-04-06.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20210406.1628.004.html
