血清神经调节蛋白-1的水平与创伤性颅脑损伤后癫痫形成的相关性研究
2021-08-31姜黎梅王英关建兵
姜黎梅 王英 关建兵
(宝鸡市人民医院神经内科,陕西 宝鸡 721000)
创伤性颅脑损伤(TBI)是受到外力引起的脑部损伤,在临床上是常见的急重性病症,直接可以引起语言障碍和某侧肢体功能降低,很有可能危及生命[1]。TBI后引起癫痫病症的几率不一,病情的发生程度直接影响患者的康复情况,也间接反应患者心理和行为能力及身体状态的主观评价[2]。神经调节蛋白-1(NRG-1)是含有表皮内源性生长因子一类的营养因子,在神经系统发育中起到的重要调节作用,与疾病引起的异常的神经发育有密切相关[3]。NRG-1能够对胶质细胞起到调节细胞生化和分化,进而可以调节沿胶质细胞迁移的小脑颗粒细胞,并发挥参与轴突生长、突触神经、神经元迁移的形成过程[4]。有研究[5]发现,在TBI过程中减轻血脑屏障破坏,具有神经保护作用,但是,目前保护的机理尚不清楚。对此本实验研究血清NRG-1水平与TBI后癫痫形成的相关性。
1 资料与方法
1.1一般资料 选取2018年1月至2020年12月到我院住院康复治疗的创伤性颅脑损伤患者96例,患者均经影像CT和MRI诊断颅脑损伤,其中男64例,女32例,年龄35~55岁,平均(45.16±2.14)岁。受伤原因多以交通事故为主占68.4%,摔倒占29.6%,其他占2.0%。部分患者住院期间有癫痫发作情况,无诱因发作2次以上患者诊断为颅脑损伤后癫痫45例(癫痫组),其中男24例,女21例,年龄35~45岁,平均(40.23±0.31)岁;患者未发生癫痫病症51例(非癫痫组),其中男29例,女22例,年龄40~55岁,平均(46.11±0.41)岁。纳入标准:均经影像学检查确诊;无心肺肝肾等重要脏器严重疾病者;均经过患者及家属同意,并签署知情同意书。排除标准:有严重性肝肾疾病和合并症者;既往有癫痫发作史者;对研究项目不配合的患者;出现严重性营养不良者。本研究取得我院伦理委员会批准。
1.2方法 (1)血清NRG-1浓度测定:采集患者住院第1、3、6天期间的肘部静脉血各5 mL,置入抗凝无菌试管中,使用酶联免疫吸附法(ELISA)按照试剂盒说明书进行(购自武汉默沙克生物科技有限公司),首先用离心机(3 000 r/min)离心20 min后,静止10 min,吸取上清液备用。取上清液2 mL用PBS缓冲液充分对细胞悬液稀释到5 mL后,并将每毫升的细胞浓度稀释到80万个左右。在通过对细胞稀释、冷冻、融化反复进行5次,促使细胞遭到破坏,使其释放细胞内部成分,对破坏的细胞使用试剂盒密封板进行封膜处理,同时加入稀释后的洗涤液,放置于温度37℃以下的室温内,静止30 min后,轻轻地剥离密封板封膜,倒掉多余洗涤液,然后进行干燥处理,这样的过程反复进行3次后,向试剂盒的每个孔中添加酶标试剂50 μL(空孔除外),静止10 min后,再向每孔先后加入A和B显示液各50 μL,对试剂盒轻轻晃动使其液体充分混合均匀,放置在室温37℃内进行避光处理,让其显色15 min后,使用终止液注入每孔进行终止反应,观察颜色的变化,用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中血清NRG-1浓度。(2)结构影像学检查:所有患者进行头颅CT及磁共振成像(MRI)测定(根据MR成像出脑内损伤立体定位严重情况),明确颅内血管、脑组织损伤及软化灶程度等情况。(3)格拉斯哥预后量表(GCS)评价标准[6]:13~15分预后良好,12分以下为预后不良。
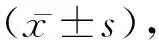
2 结 果
2.1两组患者临床资料情况分析 两组患者的年龄、性别、GCS评分、肺部感染率比较差异无统计学意义(χ2=0.774、0.154、1.413、3.581,P>0.05);而两组患者的颅脑损伤部位、癫痫发作类型、癫痫持续时间、机械通气率比较差异均有统计学意义(χ2=8.750、6.076、8.036、8.571,P<0.05)。见表1。
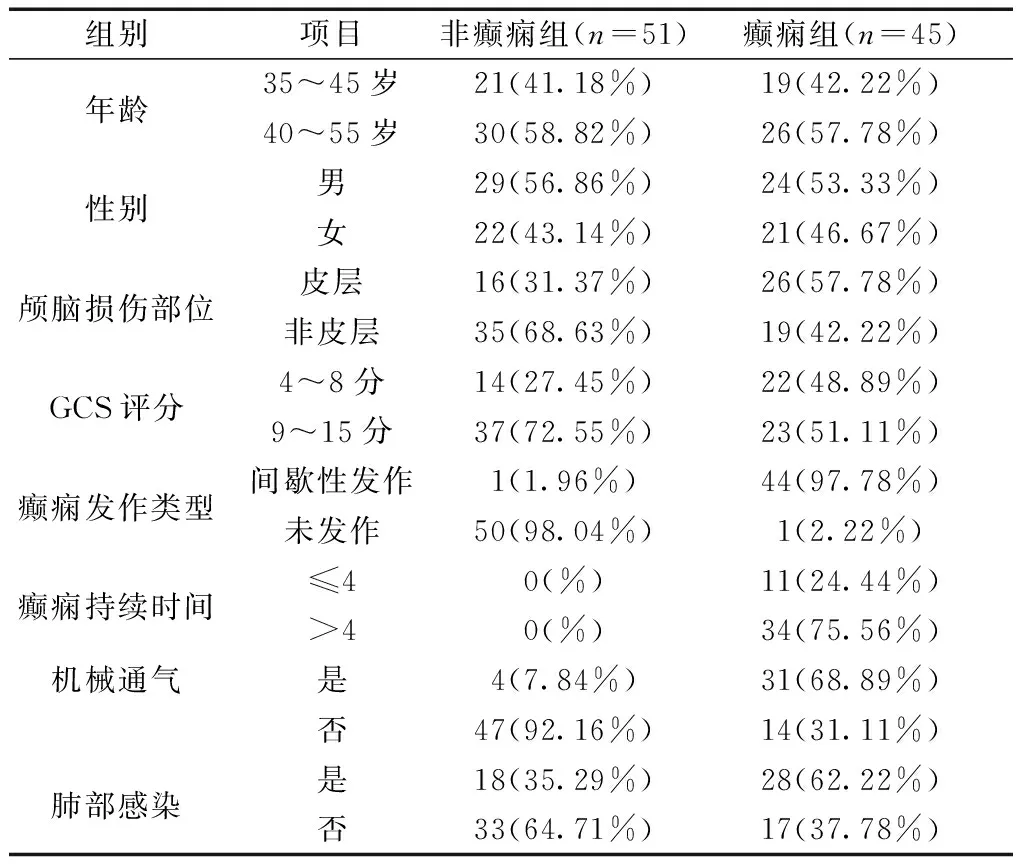
表1 两组患者临床资料情况对比[n(%)]
2.2两组患者血清NRG-1情况分析 在第1、3、6天入院时非癫痫组患者的血清NRG-1分别为(0.685±0.312)pg/mL、(0.513±0.168)pg/mL、(0.396±0.121)pg/mL,癫痫组患者为(1.986±0.113)pg/mL、(1.734±0.168)pg/mL、(1.589±0.146)pg/mL。癫痫组患者血清NRG-1水平高于非癫痫组(P<0.05)。
2.3TBI后癫痫患者与NRG-1的有关分析 结果显示血清NRG-1是影响颅脑损伤后癫痫患者发作的主要因素。见表2。
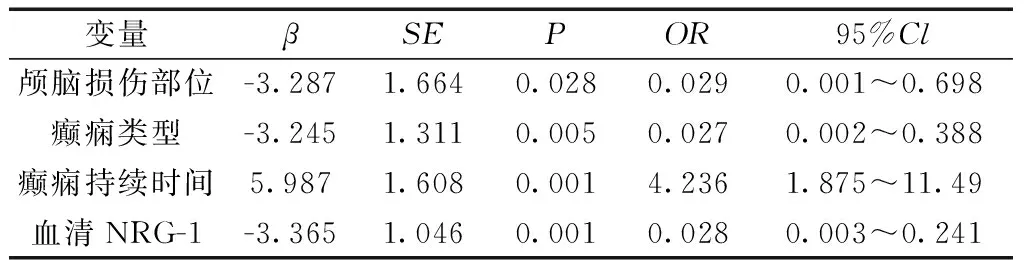
表2 创伤性颅脑损伤后癫痫患者的logistic回归分析
3 讨 论
TBI触发了一系列动态的潜在的长期病理生物学反应,使TBI成为神经疾病的主要危险因素,例如创伤后癫痫病[7]。对大脑的突然机械冲击会导致宏观及微观结构的变化,包括对轴突、神经胶质细胞和脉管系统的伤害,以及新陈代谢和水调节异常,继发性损伤过程是高度复杂的生物学反应,重要的是这些病理生物学机制的发生和程度(例如炎症,细胞增殖,突触重塑)在伤害时间方面存在很大差异[8]。创伤后癫痫病,其特征是反复发作的创伤性癫痫,可能在受伤后的不同时间发生。但有的患者在受伤后几分钟内发生的癫痫发作,一个月或更长时间后还在间歇性发作,早期的癫痫是受到刺激和异常阈值改变,可能会直接由身体物理伤害引起的脑神经信号异常。随之而来的出血、脑水肿、代谢紊乱和配对的能量产生改变,使得细胞外离子环境过多的谷氨酸释放使[9]。由于神经蛋白的结构和分子机制发生的变化,造成癫痫发作的原因,可能由初始物理损坏和随后的继发性伤害过程,产生的胶质细胞疤痕、异常突触和神经网格的异常重新布置有关,最终导致兴奋性信号和抑制性信号之间的不平衡受累于无故引起反复癫痫发作[10]。
TBI后癫痫的最重要因素是脑损伤区域的海马部位神经兴奋电位发生异常的紊乱,使得神经兴奋性放电遭到非蛋白质神经元抑制信号的控制,造成神经元兴奋性过度放电,引起癫痫疾病的产生[11]。NRG-1与高度表达酪氨酸激酶受体的非蛋白质神经元相互作用。在创伤性颅脑损伤患者的癫痫病灶中,酪氨酸激酶的表达下降。L.Zimmermann等[12]研究表明选择性敲除非蛋白质神经元的酪氨酸激酶受体的小鼠,更容易发生癫痫发作。NRG-1能诱导己分化的少突胶质细胞发生表型逆转,表现为髓鞘碱性蛋白的表达缺失、巢蛋白的再表达、肌动蛋白的重排和突起数量的减少,并基因敲除神经元阳性的作用,从而使酪氨酸激酶充分发挥抑制癫痫发作,使神经元蛋白质与酪氨酸激酶的激活后,形成内源性负反馈机制,从而抑制癫痫的发生。本研究发现,癫痫组患者血清NRG-1水平高于非癫痫组(P<0.05),血清NRG-1是影响颅脑损伤后癫痫患者发作的主要因素。
综上所述,NRG-1是一种细胞间信号转导蛋白,由神经胶质细胞和神经元产生,与酪氨酸激酶家族的受体结合,对神经系统起到保护的重要作用。TBI后癫痫患者的损伤脑区附近神经元表达随即上调,其病理学机制和生理学过程十分复杂,NRG-1的作用的环节和信号转导机制,以及与其他神经营养因子的相互作用,值得深入研究具有重要的临床意义。对于颅脑损伤部位、GCS评分、机械通气时间等因素对于癫痫形成的相关性仍有待进一步研究。
