免疫检查点抑制剂疗效预测分析及结合中医证型的Nomogram 图构建
2021-08-24彭心怡孔燕妮
李 妍 彭心怡 孔燕妮 郭 勇
近年来,实体肿瘤治疗领域有57 种免疫检查点抑制剂进入了17 种肿瘤治疗的审批流程,其中有7种分别针对程序性死亡受体1(Programmed Death 1/Ligand 1,PD1/PDL1)的单克隆抗体药物被美国FDA批准[1-2]。临床研究注册数据(Clinicaltrials.gov)显示,在过去2 年里,进入临床试验的免疫检查点治疗项目数逐年增加,但速率正在减缓[3],年龄、既往接受化疗的线数、体力、肿瘤分期、病理分级均可能影响免疫治疗疗效[4-5]。目前临床试验的亚组数据或免疫治疗相关数据不够充分,尚缺乏真实世界样本进一步证实临床病理特征联合临床参数在常见实体肿瘤免疫检查点抑制剂疗效预测中的作用。本研究将基于单中心真实世界临床患者应用免疫检查点抑制剂过程中的临床参数、免疫代谢相关指标以及中医证型的参数做进一步数据分析,构建COX 比例风险回归模型及列线(Nomogram)图,预测免疫检查点抑制剂疗效构建结合中医证型参数的个体化模型。
1 资料与方法
1.1 研究对象 2019 年2 月—2021 年2 月于浙江中医药大学附属第一医院肿瘤内科接受免疫检查点抑制剂治疗的常见实体恶性肿瘤患者53 例。
1.2 纳入及排除标准 纳入标准:(1)病理诊断明确为恶性肿瘤,中医辨证分型参照《GB/T 16751.2-1997 中医临床诊疗术语证候部分国家标准(GB)[6]》《中医诊断学》[7];(2)美国癌症联合会(American Joint Committee on Cancer,AJCC 第7 版分期制定的TNM分期[8])为Ⅳ期的患者;(3)在入组时间内初次接受免疫检查点抑制剂单用或联合治疗;(4)有完整的代谢、免疫、中医证型随访数据。排除标准:(1)随访数据不完整;(2)30 天内接受免疫检查点抑制剂治疗;(3)有其他重要脏器器质性病变,如心、肺、肾损害。
1.3 方 法 提取每例患者的年龄、性别、T 分期、N分期和M 分期[8]、客观缓解时间、既往接受治疗情况、联合治疗情况、免疫检查点抑制剂用药、瘤种、中医证型、外周血免疫相关指标(调节性T 细胞Treg、CD3+CD4+、CD3+CD8+、自然杀伤细胞NK cells)、前白蛋白(prealbumin,PAB)、淀粉样蛋白a(serum amyloid A protein,SAA)、乳酸脱氢酶、铁蛋白、中性粒细胞与淋巴细胞比率(neutrophil/lymphocyte ratio,NLR)、血小板与淋巴细胞比率(platelet/lymphocyte ratio,PLR)等临床及实验室指标进行相关因素分析。
1.4 统计学方法 应用SPSS 24.0 软件及R 语言对数据进行统计学分析,采用Kaplan-Meier 曲线分析计算风险评分对肿瘤患者免疫检查点抑制剂应用客观化解时间获益的单变量因素,并使用Log-rank 检验对Kaplan-Meier 曲线进行评估,检验水准α=0.05(双尾)。使用COX 风险比例模型分析多变量因素,并协助构建Nomogram 图[9]。使用R 语言3.2.4 构建Nomogram 图并计算C 指数。
2 结果
2.1 一般情况 在初次免疫检查点抑制剂应用期间出现进展的21 例患者中:男16 例(76%),女5 例(24%);年龄:≤50 岁1 例(4.8%),50~70 岁10 例(47.6%),≥70 岁10 例(47.6%);疾病缓解时间:≤90天8 例(38.1%),90~200 天10 例(47.6%),≥200 天3 例(14.4%);联合治疗情况:单用免疫治疗2 例(9.6%),联合化疗12 例(57.1%),联合靶向治疗7 例(33.3%),联合化疗及靶向治疗0 例;治疗线数:一线应用免疫药物6 例(28.6%),二线应用6 例(28.6%),三线应用1 例(4.8%),三线及以上应用8 例(38.1%);治疗期间中医证型主要为阴虚证6 例(28.6%),脾虚证13 例(61.9%),血瘀证2 例(9.5%);瘤种分布情况:肺癌8 例(38.1%),肠癌3 例(14.3%),胰腺癌3 例(14.3%),消化系统神经内分泌癌1 例(4.8%),肝癌1 例(4.8%),胃癌5 例(23.8%)。
在初次免疫检查点抑制剂应用期间未出现进展的32 例患者中:男20 例(62.5%),女12 例(37.5%);年龄:<50 岁4 例(12.5%),50~70 岁21 例(65.6%),≥70 岁7 例(21.9%);疾病缓解时间:<90 天15 例(46.9%),90~200 天9 例(28.1%),≥200 天8 例(25.0%);联合治疗情况:单用免疫治疗6 例(18.8%),联合化疗9 例(28.1%),联合靶向治疗13例(40.6%),联合化疗及靶向治疗4 例(12.5%);治疗线数:一线应用免疫药物9 例(28.1%),二线应用3例(9.4%),三线应用9 例(28.1%),三线以上应用11例(34.4%);治疗期间中医证型主要为阴虚证11 例(34.4%),脾虚证19 例(59.4%),血瘀证2 例(6.2%);瘤种分布情况:肺癌11 例(34.3%),肠癌5 例(15.6%),胰腺癌4 例(12.5%),消化系统神经内分泌癌2 例(6.3%),肝癌1 例(3.1%),胃癌6 例(18.8%),其他瘤种3 例(9.4%)。
2.2 免疫检查点抑制剂应用过程中临床参数的单因素分析 53 例肿瘤患者中,对所有14 项临床参数进行单因素COX 回归分析,发现PAB(P=0.003),SAA(P=0.046)与恶性肿瘤患者免疫检查点抑制剂客观缓解时间相关。见表1。
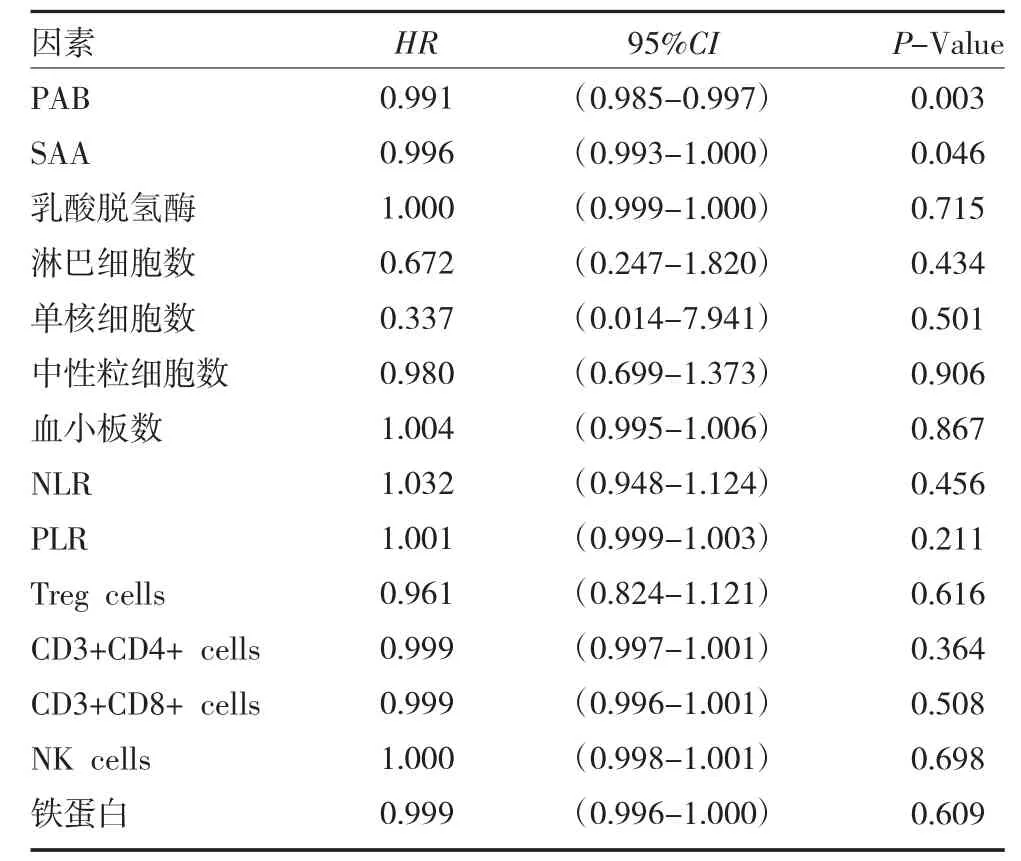
表1 53 例肿瘤患者免疫检查点抑制剂应用临床参数的单因素分析
2.3 多因素分析以评估免疫检查点抑制剂应用中客观缓解出现进展的独立危险因素 根据单因素COX回归分析结果,取P 值<0.1 的PAB、SAA 进一步行多因素回归构建生存风险模型(R 语言rms 程序包),并得到生存风险回归模型(风险评分RISK-Score=PAB×0.01498-SAA×0.00318),计算所有患者客观缓解时间获益风险评分见表2。

表2 多因素分析评估客观缓解出现进展的独立危险因素
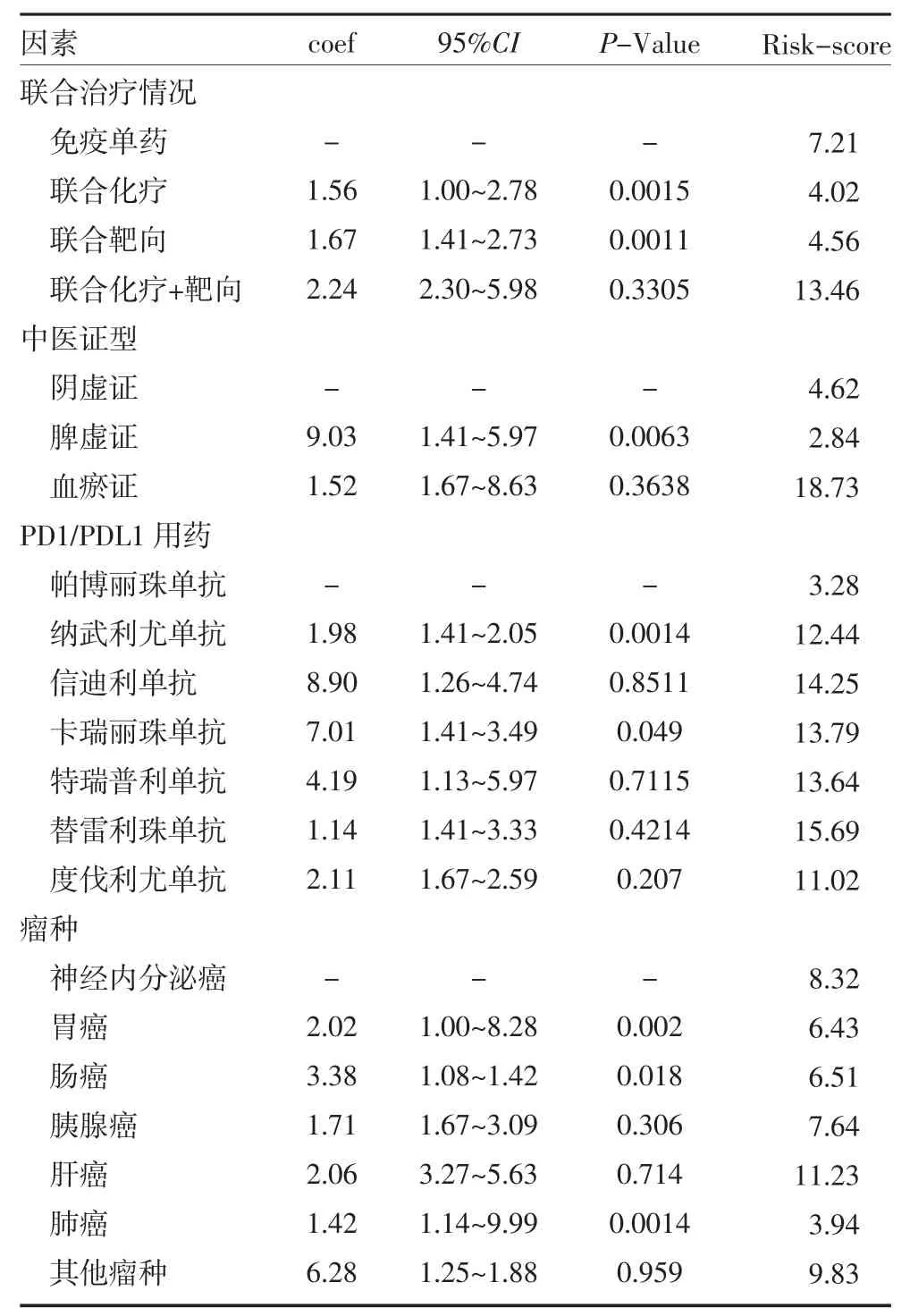
表2 多因素分析评估客观缓解出现进展的独立危险因素(续)
2.4 基于COX 多因素回归分析的Kaplan-Meier 生存分析 使用R 语言survival 及survminer 程序包对COX 多因素回归分析得到的RISK 风险分值进行Kaplan-Meier 生存预测,根据风险评分预测公式计算每个患者的风险评分,然后以中位数为cut-off 值,将所有患者分为高低危组(见图1),在53 例恶性肿瘤应用免疫检查点抑制剂患者中,高危组患者预后显著差于低危组,log-rank.P=0.001153。
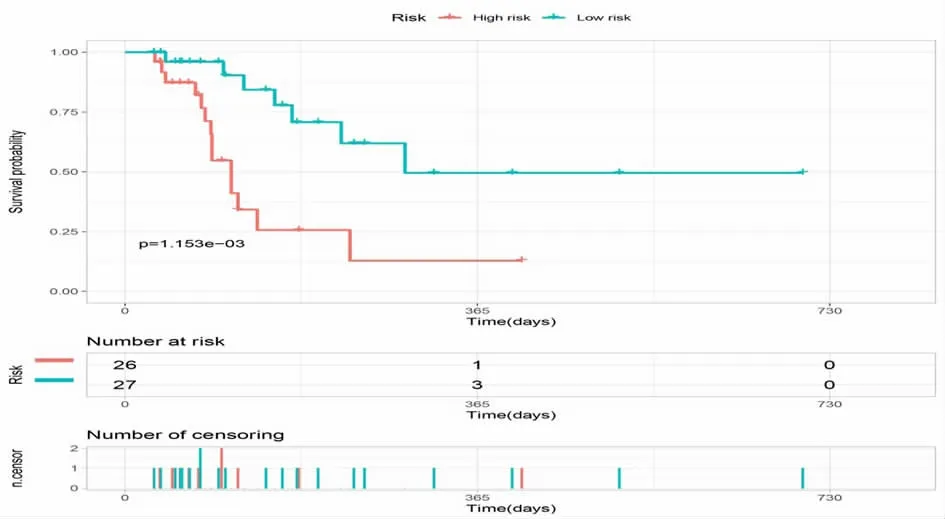
图1 对风险评分RISKSCORE 进行高低危分组后的Kaplan-Meier 生存曲线
2.5 Nomogram 图的构建 基于COX 分析得到的与免疫检查点抑制剂用药客观缓解时间有获益相关的P<0.05 的独立风险因素:年龄、T 分期、N 分期、治疗线数、联合治疗情况、中医证型、风险评分纳入进一步的模型构建,构建Nomogram 图,由于本研究入组的均为Ⅳ患者,故仅将年龄、联合治疗情况、中医证型、风险评分等因素列入COX 回归分析并构建Nomogram 图从而预测免疫检查点抑制剂客观缓解时间(见图2),采用Bootstrap 法对Nomogram 图进行内部验证,自抽样次数B=1000,验证结果显示,C 指数为0.7309(95%CI 为0.6391~0.8228),有良好的预测价值。
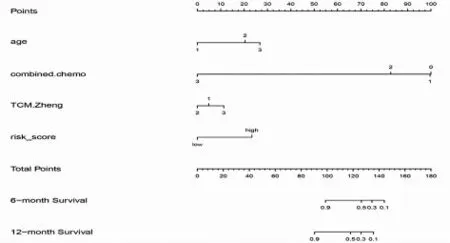
图2 结合中医证型的Nomogram 模型对肿瘤患者免疫检查点抑制剂客观缓解时间6 个月~1 年的预测
3 讨论
由于肿瘤内在机制的异质性及患者宿主个体差异,很多患者对免疫检查点治疗的响应性并不如预期高,肿瘤本身、肿瘤微环境以及宿主因素的复杂性均可能影响免疫治疗应答[10-13]。临床研究设计可能也只能纳入有限且检测标准不一致的分子标志物,如肿瘤突变负荷(tumor mutational burden,TMB)、PD1/PDL1 表达、错配修复缺陷(different mismatch repair,dMMR)状态等[14]。因而,采用明确的分子标志物联合临床参数协助预测免疫检查点抑制剂的疗效将有一定临床意义。国内肿瘤治疗的中医药参与度极高,有研究证实中医药对肿瘤的获益体现在不同方面,如保护放化疗后正常组织和细胞损伤、增强化放疗效力、减轻瘤周组织炎症状态、提高患者体力状态、改善患者生活质量及延长晚期患者生存时间[15]。结合中医证候及代谢营养免疫状态等临床参数所建立的预测模型,有望成为潜在的免疫检查点抑制剂疗效预测的个体化工具。
临床通常根据患者现有的分子表达如PD1/PDL1、TMB、dMMR 状态来判断免疫检查点抑制剂的可能获益,而在宿主因素及肿瘤微环境因素上常常依据疾病分期及常规实验室检查作出经验性判断,尚未见可靠的评分系统来预测疗效。本研究针对真实世界中正在接受免疫检查点抑制治疗的常见恶性实体肿瘤患者,所有的临床数据都是前瞻性收集并储存于本中心临床资料数据库,包括结合中医证型的临床病理学数据,常规检查中易获取的随访期间外周血代谢、营养及免疫参数以及客观缓解时间的结局数据,通过R 语言进行COX 生存单因素及多因素分析可能影响免疫检查点抑制剂客观缓解时间的临床参数特征,进一步构建有中医特征及临床可及参数的个体化Nomogram 预测模型。我们对14 项临床参数进行单因素COX 回归分析发现PAB(P=0.003)与SAA(P=0.046)与客观缓解时间获益有关;进一步行多因素COX 回归分析结果表明,年龄(P<0.01),T 分期(P<0.01),N 分期(P<0.01),治疗线数(P<0.01),联合治疗情况(P<0.01),中医证型(P<0.01),不同免疫检查点抑制剂(P<0.01)及瘤种(P<0.01)是患者获得客观缓解时间获益的独立预后影响因素。采用相关因素构建Nomogram 图提示脾虚证的风险评分较阴虚证低,血瘀证的风险评分最高,联合治疗的风险评分也低于单药,内部验证的C 指数为0.7309(95%CI 为0.6391~0.8228),表现出良好的预测价值。
既往研究显示,对免疫检查点抑制剂治疗有反应患者的基线中位单核细胞计数和中性粒细胞计数均低于无反应患者(P<0.05),提示外周血单核细胞和中性粒细胞计数对晚期非小细胞肺癌患者免疫治疗反应具有一定预测价值[16]。相较于以往的研究,未研究通过外周血的髓系细胞数、代谢状态、免疫细胞数、营养状态来评估免疫检查点抑制剂的预测价值,且结合中医证型的特征纳入Nomogram 建模有一定创新。由于本次研究的病例数来自单中心,数量较少,因而仅仅探索性运用回归模型及Nomogram 图进行数据疗效预测,在今后的工作中可以继续积累数据,完善模型评估及内外部验证,为免疫检查点抑制剂的应用提供可靠的预测工作。
