α1-抗胰蛋白酶抑制高糖诱导大鼠视网膜Müller细胞凋亡实验研究
2021-08-20田蕴霖白淑玮
田蕴霖,白淑玮,邵 娟
(西安市人民医院 西安市第四医院眼科,陕西 西安 710004)
Müller细胞与感光细胞以及其它的神经元紧密相连,是一种损伤诱导的干细胞。其也为贯穿视网膜全层的放射状胶质细胞,可通过降解谷氨酸等作用,发挥保护神经元的作用[1-2]。绝大多数活化的Müller细胞都停留在幼稚阶段,但是周围环境的变化可影响Müller细胞功能[3]。视网膜病变是临床上比较常见的眼科疾病,多为高糖诱发而产生[4]。特别是高糖可破坏血-视网膜屏障,引起脉络膜毛细血管与视网膜血管灌注不足,促使Müller细胞凋亡[5]。当前视网膜病变的治疗方法比较多,其中手术治疗具有比较好的效果,但是为有创性操作,可能对患者的预后产生负面影响。常规药物治疗在一定程度上能减缓视网膜病变病程进展,但是患者的复发率比较高[6]。α1-抗胰蛋白酶(α1-antitrypsin,AAT)属于丝氨酸蛋白酶抑制剂家族,主要在肝细胞中合成,由394个氨基酸组成,具有丝氨酸蛋白酶抑制剂的作用[7-8]。信号转导及转录活化因子3(Signal transducers and activators of transcription 3,STAT3)是一类DNA结合蛋白,可表达于眼上皮细胞中,也可参与细胞凋亡等过程[9-10]。本文具体探讨了AAT抑制高糖诱导大鼠视网膜Müller细胞凋亡的效果与机制,希望为视网膜病变的治疗提供更好的方法。
1 材料与方法
1.1 实验材料 大鼠视网永生化膜Müller细胞系购自上海生命科学院,用含有10%胎牛血清的RPMI-1640培养基在37 ℃、5%CO2培养箱中进行培养。RPMI-1640高糖培养基、胎牛血清购自美国Gibco公司、MTT检测试剂盒购于美国Promega公司,Annexin V-FITC PI检测试剂盒购于美国Invitrogen公司,外源性AAT购自美国Corning公司,兔抗人一抗与二抗购自英国Abcam公司,青-链霉素购于美国Gbico公司。
1.2 细胞分组与处理 待Müller细胞密度达到80%时,用0.25%胰蛋白酶消化细胞,取对数期生长细胞进行试验。将细胞分为三组:模型组、试验A组、试验B组,分别加入不同浓度的外源性AAT 100 μl(加药浓度分别为0、10、100 pg/ml),处理不同时间点换回高糖培养基进行培养。
1.3 MTT法检测细胞增殖 将细胞浓度调整至1×105个/ml,在96孔板培养,加入20 μl 0.5 mg/ml MTT,培养6 h后再向每孔加入150 μl DMSO,震荡培养10 min后,使用酶标仪检测细胞光密度(波长=540 nm),检测与计算细胞增殖指数。
1.4 流式细胞仪检测细胞凋亡 将细胞浓度调整至1×103个/ml,采用200 μl结合缓冲液重悬细胞,然后再加入5 μl PI与的10 μl Annexin V-FITC,暗室下室温反应15 min,采用BD公司的流式细胞仪检测凋亡指数。
1.5 Transwell小室法检测细胞侵袭 在Transwell上室当中添加Müller细胞100 μl,在下室添加600 μl培养基,培养6 h固定并染色微孔膜下层细胞,在400倍光学显微镜下进行观察,计算细胞侵袭指数。
1.6 Western blot法检测蛋白表达 收取细胞后消化后提取细胞的总蛋白,上样20 μg蛋白进行电泳,转膜后进行4 ℃过夜封闭,在含有相应一抗溶液的抗体孵育盒中(稀释比例为1∶1000)进行孵育,4 ℃过夜,洗涤3次后,再将膜孵育二抗中(稀释比例为1∶5000),室温孵育1 h,洗涤3次后进行暗室曝光,检测GAPDH、STAT3蛋白相对表达水平。上述实验都重复3次,取平均值作为最终值。
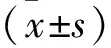
2 结 果
2.1 三组细胞增殖指数对比 处理3、6 h后,试验A组、试验B组的细胞增殖指数均高于对照组(均P<0.05),试验B组高于试验A组(P<0.05),见表1。

表1 三组不同时间点细胞增殖指数对比(%)
2.2 三组细胞凋亡指数对比 处理3、6 h后,试验A组、试验B组的细胞凋亡指数均低于对照组(均P<0.05),试验B组低于试验A组(P<0.05),见表2。

表2 三组不同时间点细胞凋亡指数对比(%)
2.3 三组细胞侵袭指数对比 处理3、6 h后,试验A组、试验B组的细胞侵袭指数均高于对照组(均P<0.05),试验B组高于试验A组(P<0.05),见表3。

表3 三组不同时间点细胞侵袭指数对比(%)
2.4 三组STAT3蛋白相对表达水平对比 处理3、6 h后,试验A、B组的STAT3蛋白相对表达水平均低于对照组(均P<0.05),试验B组低于试验A组(P<0.05),见表4。

表4 三组不同时间点STAT3蛋白相对表达水平对比
3 讨 论
Müller细胞对于维持视网膜的生长与发育具有重要的作用,在内外在各种因素的影响下,当机体视网膜受损时,比如高血糖可破坏血-视屏障功能,可损伤视网膜血管系统。不过此时环视网膜Müller细胞可大量活化和增殖,逆分化为视网膜干细胞,在一定程度下可替代损伤的细胞,促进恢复视网膜功能[11-12]。但是很多Müller细胞的功能受限,为此在高糖环境下提高Müller的增殖能力具有重要价值[13]。
AAT是机体血清中最丰富的蛋白酶抑制因子之一,主要由肝脏产生。AAT一般还具有较强的血管通透性,在Müller细胞中也有一定的表达,并且对视网膜组织具有一定的保护作用[14]。AAT也为一个急性反应蛋白,当人在处于感染或者炎症发生时,血清中 AAT的浓度会出现明显升高[15]。本研究显示处理3、6 h后,试验A组、试验B组的细胞增殖指数、侵袭指数高于对照组,试验B组高于试验A组。从机制上分析,AAT可以激活 MAPK信号通路,从而促进纤维细胞的增殖,可缓解高血糖引发的视网膜屏障功能紊乱及血管异常新生,提高Müller的增殖与侵袭能力[16]。
高糖环境可导致视网膜外层细胞的破坏,促进Müller细胞凋亡,使得内层视网膜皱褶、萎缩,从而导致视网膜功能下降甚或丧失[17-18]。AAT是由内胚层上皮细胞产生和分泌的一种糖蛋白,突变型p53能够上调AAT的表达,导致恶性肿瘤的发生发展,且与恶性肿瘤的不良预后有关[19]。AAT也能够促进血管生成素样蛋白4的表达,增强肿瘤的血管生成能力[20]。本研究显示处理3、6 h后,试验A组、试验B组的细胞凋亡指数低于对照组,试验B组低于试验A组,表明AAT能高糖诱导大鼠视网膜Müller细胞的凋亡。当前也有研究显示AAT可导组细胞可以通过调控 NF-κB信号通路,从而抑制上皮细胞炎症因子的表达,改善患者的病情[21]。
STAT3可在多种细胞、组织、器官中进行表达,在人类定位于第12号染色体,STAT3蛋白分子量为84~113 kDa,由750~850个氨基酸组成[22]。STAT3蛋白结构域中包括亮氨酸拉链结构(bZIP),可以通过其bZIP结合其他含bZIP蛋白调控转录,从而发挥相关疾病的调控作用[23-24]。本研究显示处理3、6 h后,试验A组、试验B组的STAT3蛋白相对表达水平低于对照组,试验B组低于试验A组,表明AAT的应用能抑制STAT3的表达,从而保护机体免除炎性因子的损坏,抑制炎症反应。不过本研究没有进行动物模型分析,且没有设置空白对照组,将在后续研究中进行探讨。
综上所述,AAT可抑制高糖诱导大鼠视网膜Müller细胞的凋亡,促进细胞增殖与侵袭,其作用机制可能与抑制STAT3表达有关。
