紫苏组织培养的研究
2021-08-19杨红媛张厚德朱煜景迟昕宜牛锐利谭冰宗宪春
杨红媛,张厚德,朱煜景,迟昕宜,牛锐利,谭冰,宗宪春
(牡丹江师范学院生命科学与技术学院,黑龙江 牡丹江 157011)
紫苏(PerillafrutesceusL.Britt)为唇形科(Labiatae)一年生草本植物,具特异芳香,是我国传统的药食、油料作物,也是卫生部第一批规定的既是药品又是食品的60种作物之一,是一种极具开发利用的天然产物。目前有关紫苏组织培养及快繁技术虽然取得了一些进展,但如何建立起一套完善的高频的紫苏离体快繁体系研究的还不够深入。本研究以紫苏为材料,通过对其子叶、下胚轴、幼嫩叶片最佳外植体的筛选、愈伤组织诱导、不定芽分化及生根培养,建立紫苏的离体培养再生体系,为紫苏种质资源保存及快速繁殖提供理论依据和技术支撑。
1 材料与方法
1.1 实验材料
本文使用的紫苏种子购买于牡丹江花鸟鱼市场,产于哈尔滨金龙农业有限公司。所使用的激素:6-BA(6-benzylaminopurine,6-苄基嘌呤)、NAA(1-naphthyla-cetic acid,萘乙酸),IAA(Indolyl-3-acetic acid,吲哚乙酸)均为北京拜尔迪生物技术有限公司产品。
1.2 实验方法
1.2.1 不同消毒时间处理对紫苏种子萌发的影响。将紫苏种子在清水中浸泡6 h,然后放入0.1%的升汞中分别消毒4、6、8、10、12 min;然后将种子取出,用无菌水冲洗5次,再将种子播种在装有事先配制好的MS培养基的培养瓶中。整个过程均在无菌超净工作台进行。培养15 d后观察并统计种子的污染率和发芽率。筛选消毒的最佳时间。
1.2.2 培养基种类不同对紫苏种子萌发的影响。用0.1%的升汞对紫苏种子消毒8 min,无菌水冲洗5次后将种子分别播种到盛有MS和1/2MS培养基中进行培养,15 d后观察并计算种子的发芽率。筛选适合种子生长的最佳培养基。
1.2.3 愈伤组织诱导。下胚轴长约4 cm、子叶展开时,将下胚轴切成1.0 cm的小段,将子叶切成0.5 cm×0.5 cm的小块。将无菌苗的幼叶也切成0.5 cm×0.5 cm的小块,然后接种在6-BA(1.0、2.0、3.0 mg/L)和NAA(0.1、0.2、0.3 mg/L)不同配比的MS诱导培养基中,见表2-1。每种培养基接20个外植体,每处理重复3次。3 d后观察外植体的变化和愈伤组织的生长状况。35 d后计算愈伤组织的诱导率。
1.2.4 愈伤组织的分化培养。将子叶和叶片形成的愈伤组织转接至6-BA(1.0、2.0、3.0 mg/L)和NAA(0.1、0.2、0.3 mg/L)不同配比的MS诱导培养基中,具体见表1。每种培养基分别接种20个愈伤组织,重复相同处理程序,共3次。成长35 d后观察培养基,比较来自不同外植体(子叶,叶片)的愈伤组织分化情况,并计算不同外植体的愈伤组织的分化率。
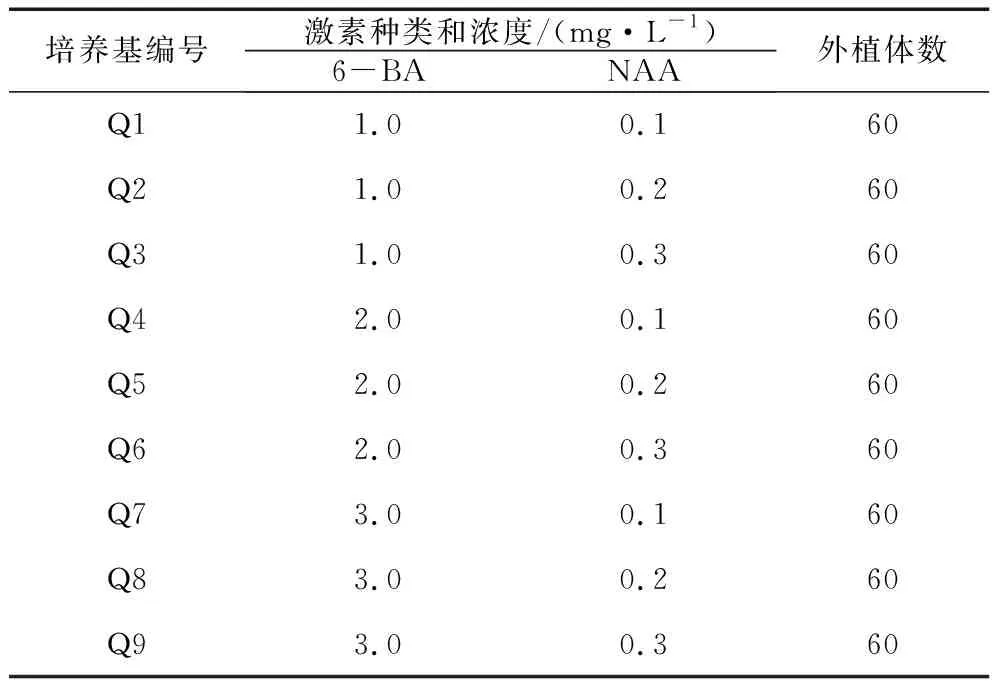
表1 愈伤组织诱导和分化培养基的激素组成
1.2.5 试管苗的生根。当不定芽长至约2~3 cm高时,转到附加不同激素IAA(0.1、0.2、0.3 mg/L)、NAA(0、0.1、0.2、0.3 mg/L)的1/2MS生根培养基中进行诱导生根,20 d后统计根的生长情况并计算生根率。
1.3 培养条件
本试验以MS为基本培养,添加相同种类的植物激素,控制唯一变量为激素浓度。其它附加物为30 g/L的蔗糖,6 g/L的琼脂。用1 mol/LNaOH溶液或1 mol/LHCl调节pH至5.8左右。培养条件:(25±2)℃,光照强度1600 Lx,光照时间12 h/d。
1.4 数据处理
萌发率=(萌发的种子数/接种的种子数)×100%。
污染率=(接种污染数/接种总数)×100%。
出愈率=(有愈伤组织形成的外植体数/接种外植体数)×100%。
分化率=(有芽形成的外植体数/接种的愈伤组织数)×100%。
生根率=(有根形成的芽数/接种芽数)×100%。
测试结果的基本数据由Excel处理,使用Spss统计软件对测试数据进行分析。
2 结果与分析
2.1 不同消毒时间处理对紫苏种子萌发的影响
不同消毒时间对紫苏种子萌发的影响见表2。从数据统计结果不难发现,种子的消毒时间不同,后期的萌发率亦不同。用0.1%升汞消毒总时长为4 min时萌发率为76%,污染率为30%;消毒总时长为6 min时种子的萌发率为88%,污染率为11%、消毒总时长达到8 min时萌发率最好,为94%,污染率最低,为6%;然而当升汞消毒时间大于8 min时,种子萌发率开始降低。污染率又逐渐升高。因此,本试验无菌接种时采用0.1%升汞消毒8 min。
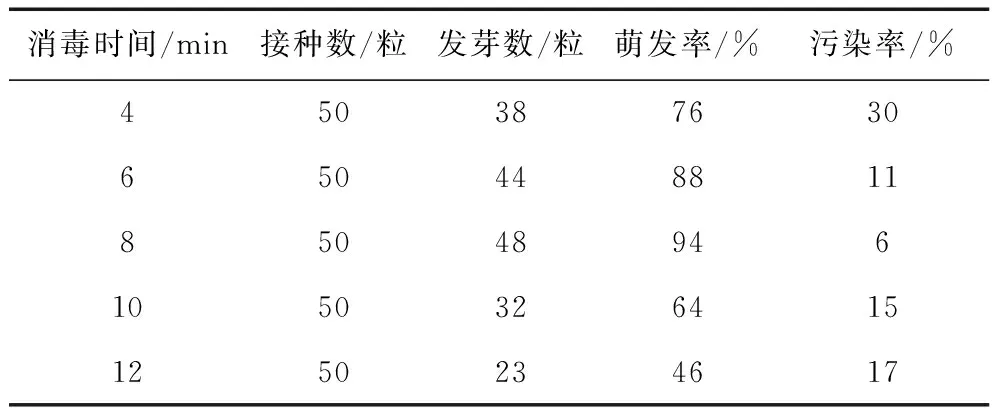
表2 不同消毒时间对紫苏种子萌发的影响
2.2 不同培养基对紫苏种子萌发的影响
紫苏种子经8 min消毒后接种在MS和1/2MS培养基中,两种培养基对种子萌发的影响见表3。由此表可知,种子在两种培养基中的萌发率差异不大,也就是说在不同培养基中的萌发率基本相同,但在1/2MS培养基中的芽纤细,故本试验所采用的外植体均来自MS培养基上培养的无菌苗。
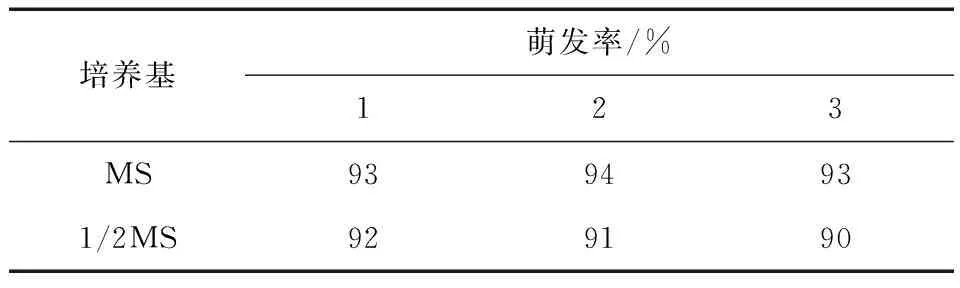
表3 不同培养基对紫苏种子萌发的影响
2.3 不同培养基对紫苏不同外植体愈伤组织诱导的影响
2.3.1 不同培养基对叶片愈伤组织诱导的影响。将紫苏叶片剪成0.5 cm×0.5 cm小块后接入到Q1-Q9培养基中,叶片在不同的培养基中培养,3 d后观察发现叶片向背面卷曲,10 d左右,从叶片边缘渐渐出现愈伤组织,颜色呈现绿色或浅绿色。从表4可以发现,叶片在不同培养基中培养,其愈伤组织生长状况和诱导率有所不同。在培养基Q9即6-BA3.0 mg/L+NAA 0.3 mg/L培养基时,其愈伤组织生长旺盛、诱导率最高,为97.5%;在Q1培养基即6-BA1.0 mg/L+ NAA0.1 mg/L培养基上愈伤组织生长一般、诱导率相对较低,只有45%。因此,从愈伤组织诱导率和生长状况来看,诱导紫苏叶片愈伤组织最佳培养基为MS+6-BA3.0 mg/L+NAA0.3 mg/L,愈伤组织诱导率最高,为97.5%。
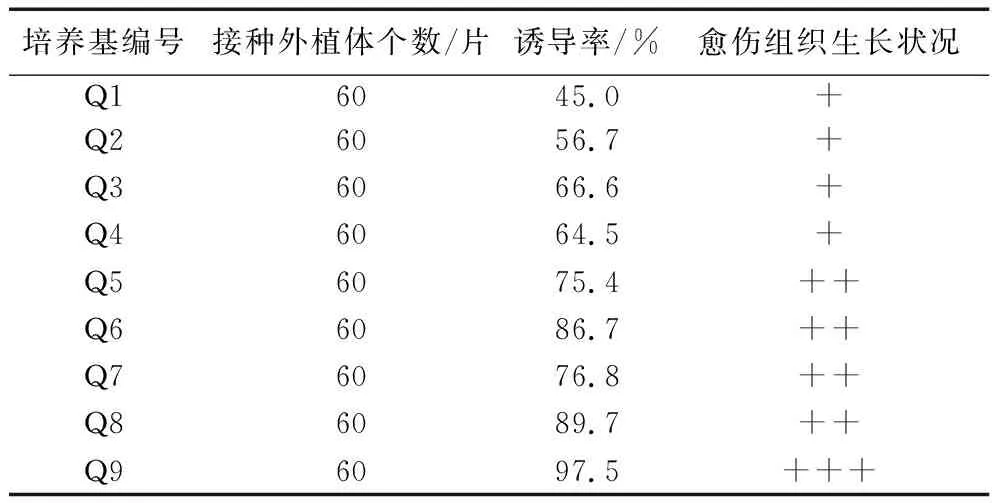
表4 不同培养基对叶片愈伤组织诱导的影响
2.3.2 不同培养基对下胚轴愈伤组织诱导的影响。将紫苏的下胚轴切成1.0 cm的小段后接入到Q1-Q9培养基中进行培养。培养5 d后,下胚轴两端略微膨大,颜色变浅,10 d后部分外植体开始形成愈伤组织。培养28 d后观察发现,(见表5)。由表5可知,不同培养基其愈伤组织的诱导率和生长状况不同。接种于Q8培养基时,即6-BA3.0 mg/L+NAA 0.2 mg/L培养基时,外植体下胚轴的愈伤组织生长较旺盛、诱导率相对较高为83.3%,因此确定下胚轴诱导愈伤组织的最佳培养基为Q8,即MS+ 6-BA3.0 mg/L + NAA0.2 mg/L。
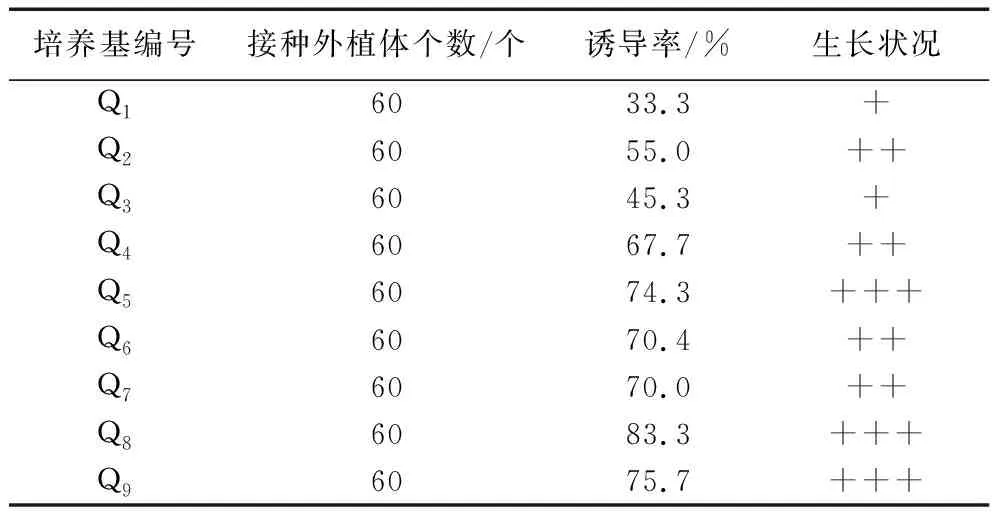
表5 不同培养基对下胚轴愈伤组织诱导的影响
2.3.3 不同培养基对子叶愈伤组织诱导的影响。将紫苏子叶剪成0.5 cm×0.5 cm小块后接入到Q1-Q9培养基中进行培养,6 d后子叶膨大,10 d后其边缘形成少量愈伤组织。培养35 d观察,不同培养基对子叶愈伤组织诱导率和生长状况影响见表6。由此表可知,子叶愈伤组织诱导最佳培养基为Q9,即MS+ 6-BA 3.0 mg/L + NAA 0.3 mg/L,愈伤组织诱导率最高,为91.7%。
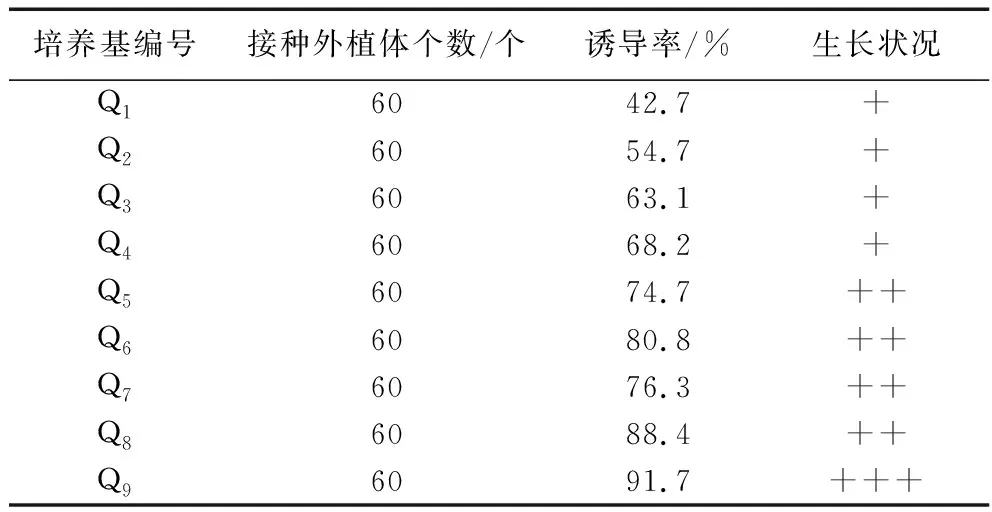
表6 不同培养基对子叶愈伤组织诱导的影响
2.3.4 细胞分裂素6-BA和生长素NAA对愈伤组织诱导的影响。在不同浓度6-BA和NAA配比的培养基上,大部分外植体都有所生长,培养6 d时,外植体与培养基接触部位开始膨大或弯曲,下胚轴两端颜色变浅。10 d时,子叶、下胚轴和幼嫩叶片均有愈伤组织出现,35 d左右,不同浓度6-BA和NAA处理的外植体,在出愈率、生长状况已表现出明显的差异(见图1)。从出愈时间看,下胚轴出愈伤组织时间略早,但从诱导率及愈伤组织的生长状况看,幼嫩叶片愈伤组织的诱导率高于子叶和下胚轴。当6-BA浓度分别为 1.0、2.0、3.0 mg/L 时,可以发现,三种外植体的愈伤组织诱导率随着NAA浓度的增加呈现上升趋势。当NAA浓度分别为0.1、0.2、0.3 mg/L 时,三种外植体的愈伤组织诱导率随着6-BA浓度的增加呈现上升趋势。在同一培养基(6-BA和NAA的配比相同)中培养三种不同的外植体,愈伤组织诱导率表现为叶片>子叶>下胚轴;当6-BA浓度为3.0 mg/L时,NAA浓度为0.3 mg/L 时表现更为明显。
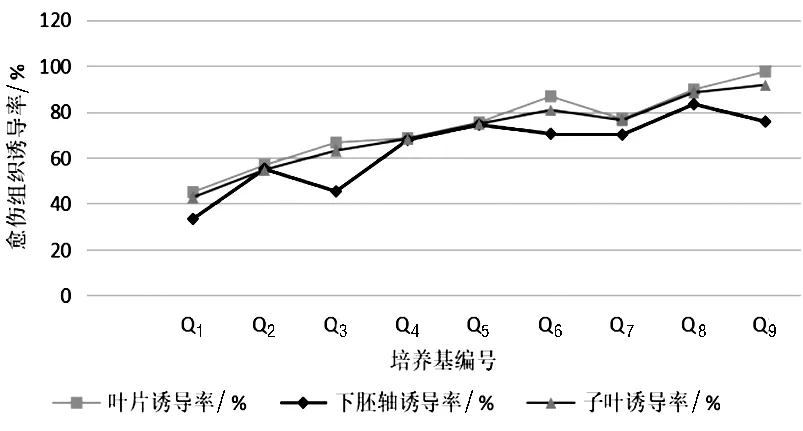
图1 细胞分裂素及生长素对愈伤组织诱导的影响
综合考虑,进行紫苏组织培养时,外植体选取其子叶和叶片较为适合。因其具有较高的诱导率。适宜的培养基为:6-BA3.0 mg/L+ NAA0.3 mg/L,诱导率叶片为97.5%,子叶为91.7%。
2.4 不同培养基对紫苏愈伤组织分化的影响
将紫苏子叶和幼嫩叶片诱导出的愈伤组织接入到原培养基相对应的Q1-Q9培养基中培养。25 d后,两种不同外植体愈伤组织分化情况见表7。从表中分化率可以看出:不同的培养基,其愈伤组织的分化率也不同。在同一水平细胞分裂素6-BA(1 mg/L、2 mg/L或3 mg/L)的作用下,叶片和子叶形成的愈伤组织的分化率随着NAA浓度增加呈现逐渐上升的趋势,形成生长健壮的不定芽;当NAA浓度一定时,随着6-BA浓度增加,愈伤组织的分化率逐渐上升。6-BA浓度为3 mg/L,NAA浓度为0.3 mg/L时,此时分化率达到峰值,分化出的不定芽生长健壮,叶片分化率为68.11%,子叶分化率为58.57%,均维持在较高水平,而叶片的分化率要优于子叶。因此应选择高浓度的6-BA(3 mg/L)和较高浓度的生长素NAA(0.2 mg/L)组合进行愈伤组织的分化培养。紫苏叶片和子叶愈伤组织分化的最佳培养基是Q8。即MS+6-BA3 mg/L+NAA 0.2 mg/L为筛选紫苏愈伤组织分化的最佳培养基。
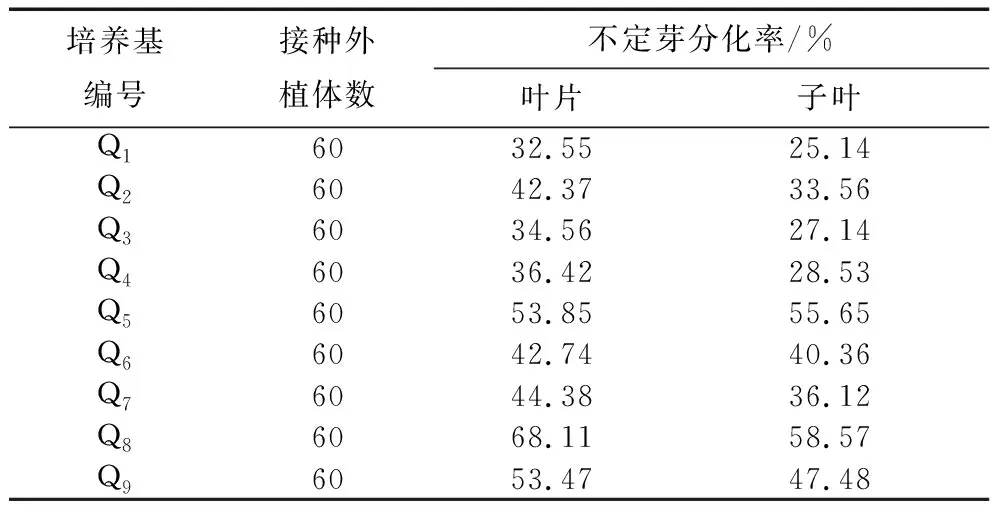
表7 不同培养基对子叶和叶片愈伤组织分化的影响
2.5 生根培养基的筛选
将生长状况良好株高2~3 cm的不定芽,接至R1-R7的生根培养基中进行生根培养。从表8可知:不含生长素的1/2 MS培养基生根率较低,生长素NAA对于紫苏不定芽的生根效果高于IBA。当NAA的浓度为0.1 mg/L时,所有不定芽都能成功生根。且根系发达,主根明显。因此,R2培养基即MS+NAA0.1 mg/L为最佳生根培养基。
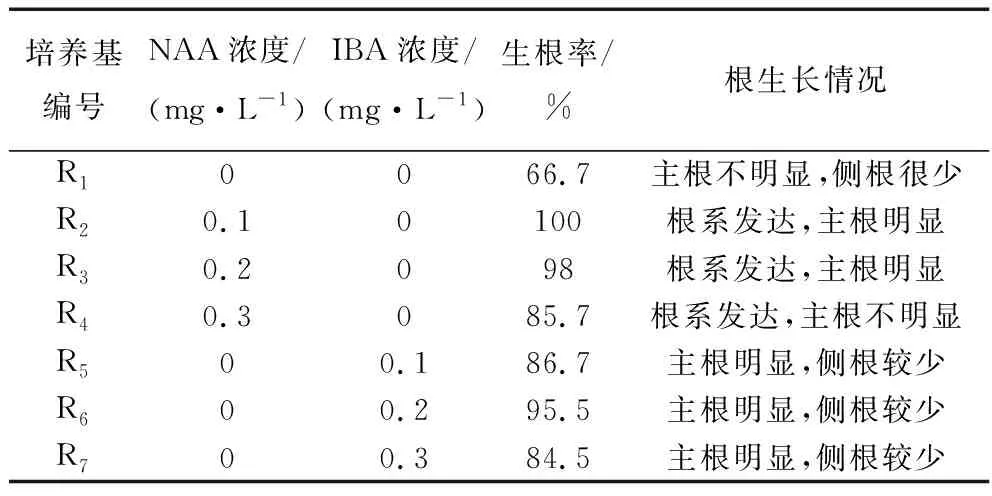
表8 不同培养基对生根的影响
3 结论
通过对紫苏子叶、下胚轴、幼嫩叶片最佳外植体的筛选、愈伤组织诱导、不定芽分化及生根培养,建立了紫苏的离体培养再生体系。紫苏种子萌发最佳培养基为MS培养基;最佳消毒方法为0.1% 升汞消毒8 min。此时种子萌发率最高达96 %。离体培养最佳外植体为叶片。紫苏叶片和子叶诱导愈伤组织的最佳培养基为MS+ 6-BA3.0 mg/L+NAA0.3 mg/L,诱导率分别为97.5%和91.7%;愈伤组织分化的最佳培养基为MS+6-BA 3.0 mg/L+NAA 0.2 mg/L,叶片优于子叶。最佳生根培养基为1/2MS+NAA0.1 mg/L,生根率为100%。
