绵羊基因表达定量分析内参基因的筛选
2021-08-15周胜花薛丽娜宋献艺
周胜花,薛丽娜,宋献艺
(山西农业大学动物科学学院,山西太谷 030801)
实时荧光定量PCR(Quantitative Real-Time PCR,qRT-PCR)是一种广泛应用于转录水平上对mRNA 表达量进行定量分析的技术,有定量准确、特异性强、灵敏度高等优点[1-2]。qRT-PCR 包括绝对定量PCR 和相对定量PCR。在相对定量PCR 中,为得到准确结果,常常需要引入内参基因用以修正不同样本初始模板纯度和浓度以及反转录扩增效率等差异[3]。内参基因是一类在不同条件下仍能在所有组织内恒定表达的基因,这类基因在所有组织中都有较高的表达量[4-5]。常见的内参基因有甘油醛-3-磷酸脱氢酶基因(GAPDH)、18S 核糖体RNA 基因(18S rRNA)、β2-微球蛋白(B2M)、beta-肌动蛋白基因(ACTβ)等[6-8]。然而,随着人们认识的深入,便发现内参基因表达并非绝对的稳定,只有在特定条件下表现出相对的稳定[9]。因此,在进行定量分析前筛选稳定表达的内参基因对于实验结果的准确性具有重要意义。目前,已有大量关于内参基因筛选的研究,可为进行绵羊不同组织稳定表达内参基因的筛选提供参考[10-13]。
广灵大尾羊是一种肉毛兼用型的优良地方绵羊品种[14]。目前,已有大量通过分子生物技术手段开展关于肉质、皮毛相关优质基因挖掘、分子机制的研究,但在这些研究中关于内参基因稳定性的研究未见报道。本研究利用qRT-PCR 对6 种常见的内参基因进行表达量分析,并运用GeNorm、NormFinder 及BestKeeper 综合分析了以上基因在广灵大尾羊皮毛、肉质性状及脂肪代谢相关组织包括皮肤、背部最长肌、肾周脂肪、肝脏中的稳定性,以期筛选出最佳的内参基因,而使后续基因的定量表达研究获得更为准确可靠的数据。
1 材料与方法
1.1 实验动物 随机选取同一饲喂条件下的6 月龄广灵大尾羊6 只,公母各半,屠宰并采集同一位置的背部最长肌、肾周脂肪、肝脏组织及净毛后的皮肤组织,迅速投入液氮中,随后保存于超低温冰箱。
1.2 实验方法
1.2.1 总RNA 的提取和cDNA 的合成 提取总RNA 前将各组织粉碎,用液氮研磨皮肤组织,背部最长肌、肾周脂肪、肝脏组织用磁珠粉碎仪研磨。后续提取步骤参见Eastep®Super 总RNA 提取说明书进行。用Nanodrop-2000c 仪测定RNA 质量,将质量合格的各样本RNA 浓度均稀释成100 ng/μL。反转录实验参照GoScript™ Reverse Transcription System 试剂盒使用说明构建体系,其中含有1 μg RNA。随后置于PCR 仪中,反应条件:25℃ 5 min,42℃ 6 min,70℃ 15 min。反应后的产物-20℃保存。
1.2.2 引物设计及其特异性验证 在NCBI 上查找并获得GAPDH、18S rRNA、B2M、ACTβ、RPLPO、YWHAZ基因mRNA 序列,随后将序列上传至Primer 5.0 软件设计引物,引物序列见表1。为验证引物的特异性,参照2×Taq PCR MasterMix 的使用指南构建PCR 反应体系,随后置于PCR 仪中,反应条件设置为:94℃ 5 min;94℃ 30 s,60℃30 s,72℃30 s,共35 个循环;72℃5 min。琼脂糖凝胶电泳检测PCR 产物。

表1 绵羊各候选内参基因的引物序列
1.2.3 标准曲线的构建和实时荧光定量PCR 检测 将cDNA 按照10-1~10-5稀释成5 个梯度作为反应的模板,每个模板重复3 次,通过Rotor-Gene Q 荧光定量PCR仪分别扩增GAPDH、18S rRNA、ACTβ、RPLPO、YWHAZ基因,构建标准曲线。以50 倍稀释后的cDNA 作为模板检测4 个组织中6 个内参基因的表达丰度,每个样本重复3 次。qRT-PCR 实验反应体系的构建依据为QuantiNova SYBR Green PCR Kit 说明:上下游引物(10 μmol/μL)各0.4 μL,2×SYBR Green PCR Master Mix 10 μL,cDNA 模板2 μL,补充水至20 μL。反应条件设置为:95℃,2 min;95℃,5 s;60℃,20 s;共30 个循环;熔解反应的温度从60℃升至95℃,每5 s上升1℃。
1.3 统计分析 将梯度稀释的cDNA 定量扩增结果的Ct值导入Excel 表格,分别以Log(起始浓度)和循环数为横纵坐标,构建标准曲线,统计6 个内参基因标准曲线的斜率和相关系数(R2),根据公式E%=(10-1/斜率-1)×100%计算扩增效率。
本实验每个组织中6 个样本,每个样本重复3 次,进行qRT-PCR 实验,将结果导入Excel 表格,每个样本的3 次重复的Ct 值取几何平均值,然后将平均Ct值中最小的设置为1,采用2-ΔCt(ΔCt=样本Ct 值-最小Ct 值)公式计算相对表达量,数据导入geNorm和NormFinder 中,得出候选内参基因稳定性值及最佳内参基因的个数。将定量结果的Ct 值数据导入BestKeeper,得出各内参基因的稳定性值。
2 结果与分析
2.1 总RNA 质量检测及候选内参基因的PCR 结果 核酸质量检测结果显示,所有样本的总RNA 浓度在200~3 000 ng/μL,其中肝脏的浓度最大,均大于2 000 ng/μL,皮肤、肾周脂肪、肝脏组织的浓度均在250 ng/μL 左右。所有样本A260/A280 值均在2.0 左右。
以皮肤cDNA 为模板,PCR 扩增6 个候选内参基因片段,经电泳检测(图1)发现,GAPDH、18S rRNA、B2M、ACTβ、RPLPO、YWHAZ基因的片段大小与预期片段大小一致且为单一条带,说明以上引物扩增专一。
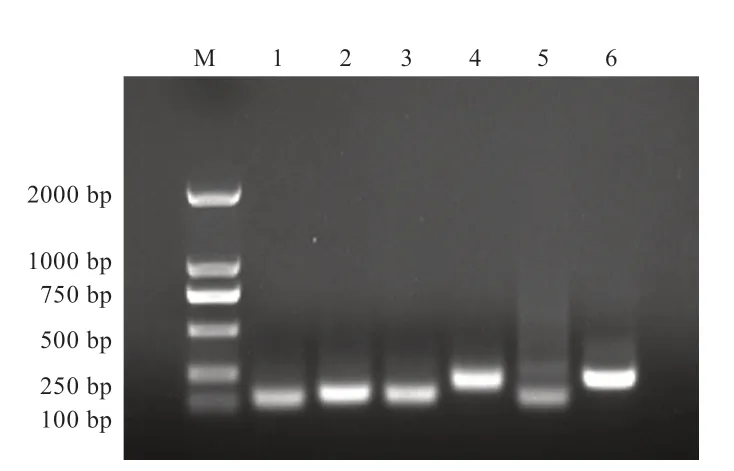
图1 6 个内参基因PCR 产物琼脂糖凝胶电泳图
2.3 标准曲线的构建 由表2 可知,各内参基因的斜率在-3.1~-3.5,扩增效率在95%~108%,R2均大于99%,说明Log(起始浓度)与循环数具有良好的线性关系,引物的扩增效率较好。

表2 绵羊6 个候选内参基因引物扩增参数
2.4 候选内参基因的稳定性评价
2.4.1 4 个组织中6 个内参基因Ct 值分析 如图2 所示,内参基因的平均Ct 值为11.2~25.9。18S rRNA是4 个组织中表达量最高的内参基因(平均Ct=11.7),而YWHAZ是表达量最低的内参基因(平均Ct=24.2),B2M在4 个组织中的稳定性最好。
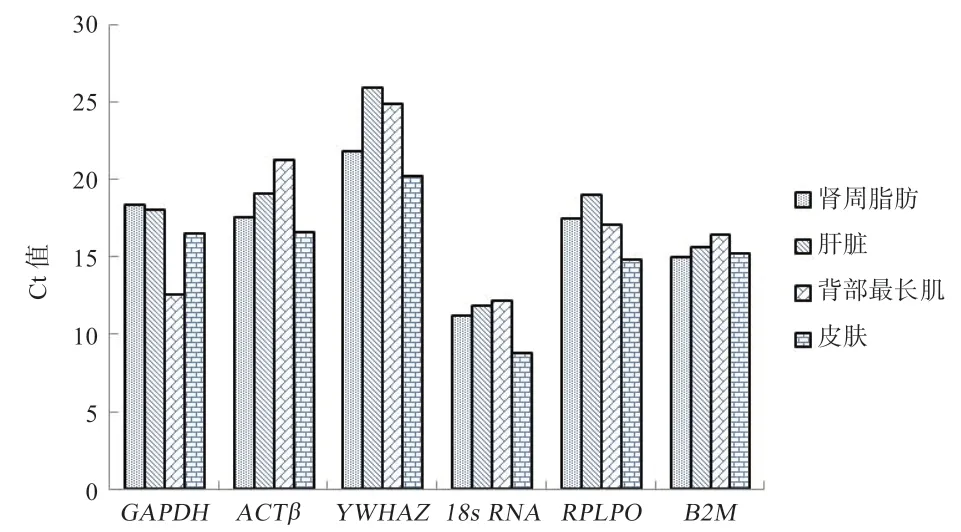
图2 绵羊6 个候选内参基因不同组织中Ct 值比较
2.4.2 geNorm 分析 经geNorm 软件分析可知内参基因的稳定性M 值和变异V 值,M 值越大内参基因稳定性越差,V 值可决定最佳内参基因的个数,一般认为Vn:Vn+1小于0.15,则最佳内参基因个数为n 个[15]。geNorm 分析结果得出各候选内参基因的数值及排序见表3,在绵羊背部最长肌中内参基因稳定性排序为18S rRNA<ACTβ<RPLPO<B2M<GAPDH=YWHAZ,GAPDH和YWHAZ适合作为内参基因。在绵羊肾周脂肪中内参基因稳定性排序为18S rRNA<YWHAZ<RPLPO<B2M<ACTβ=GAPDH,ACTβ和GAPDH适合作为内参基因。在绵羊肝脏中内参基因稳定性排序为18S rRNA<YWHAZ<B2M<GAPDH<ACTβ=RPLPO,ACTβ和RPLPO适合作为内参基因。在绵羊皮肤组织中内参基因稳定性排序为ACTβ<RPLPO<YWHAZ<B2M<GAPDH=18S rRNA,GAPDH和18S rRNA适合作为内参基因。在4 个组织中内参基因稳定性的排序为GAPDH<YWHAZ<ACTβ<B2M<18S rRNA=RPLPO,18S rRNA和RPLPO适合作为内参基因。以上结果中V2:V3均小于0.15,因此合适的内参基因个数均为2(图3)。
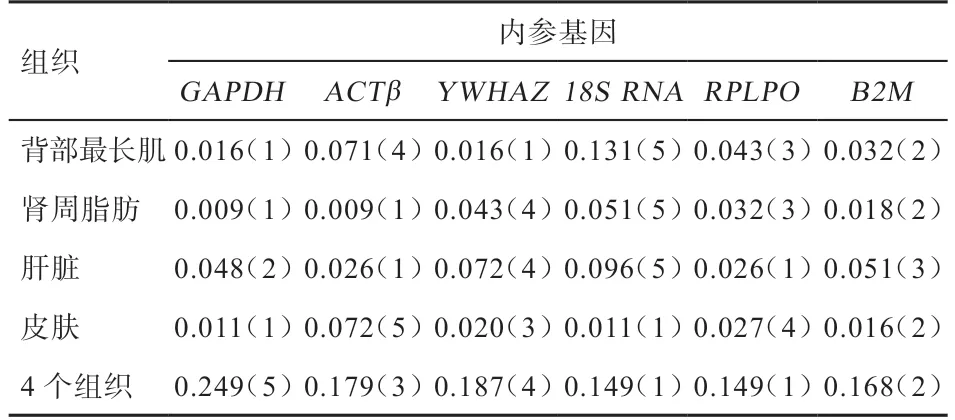
表3 geNorm 软件分析各候选内参基因稳定值M 及排序

图3 geNorm 软件分析候选内参基因的配对差异值V
2.4.3 NormFinder 分析 NormFinder 可计算出基因表达稳定值(S 值)且选出1 个最佳的内参基因。其中S 值越小,稳定性越好[15]。如表4 所示,在绵羊背部最长肌中内参基因稳定性的排序为18S rRNA<ACTβ<YWHAZ<RPLPO<B2M<GAPDH,GAPDH适合作为内参基因。在绵羊肾周脂肪中内参基因稳定性的排序为18S rRNA<YWHAZ<RPLPO<B2M<ACTβ<GAPDH,GAPDH适合作为内参基因。在绵羊肝脏中内参基因稳定性的排序为18S rRNA<B2M<ACTβ<YWHAZ<GAPDH<RPLPO,RPLPO适合作为内参基因。在绵羊皮肤组织中内参基因稳定性的排序为ACTβ<YWHAZ<RPLPO<GAPDH<B2M<18S rRNA,18S rRNA适合作为内参基因。在4 个组织中内参基因稳定性的排序为GAPDH<ACTβ<YWHAZ<18S rRNA<B2M<RPLPO,RPLPO适合作为内参基因。

表4 NormFinder 软件分析候选内参基因稳定值S 及排序
2.4.4 BestKeeper 分析 利用BestKeeper 软件可计算出内参基因的标准偏差(Standard Deviation,SD),SD值越小,稳定性越好[15]。BestKeeper 分析得出各候选内参基因的数值及排序结果(表5)表明,在绵羊背部最长肌中的排序为18S rRNA<B2M<RPLPO<YWHAZ<ACTβ<GAPDH,GAPDH适合作为内参基因。在绵羊肾周脂肪中排序为18S rRNA<B2M<YWHAZ<ACTβ<RPLPO<GAPDH,GAPDH适合作为内参基因。在绵羊中的排序为B2M<ACTβ<GAPDH<18S rRNA<YWHAZ<RPLPO,RPLPO适合作为内参基因。在绵羊皮肤组织中的排序为RPLPO<YWHAZ<18S rRNA<B2M<GAPDH,GAPDH适合作为内参基因。在4 个组织中的排序为GAPDH<YWHAZ<RPLPO<ACTβ<18S rRNA<B2M,B2M适 合作为内参基因。
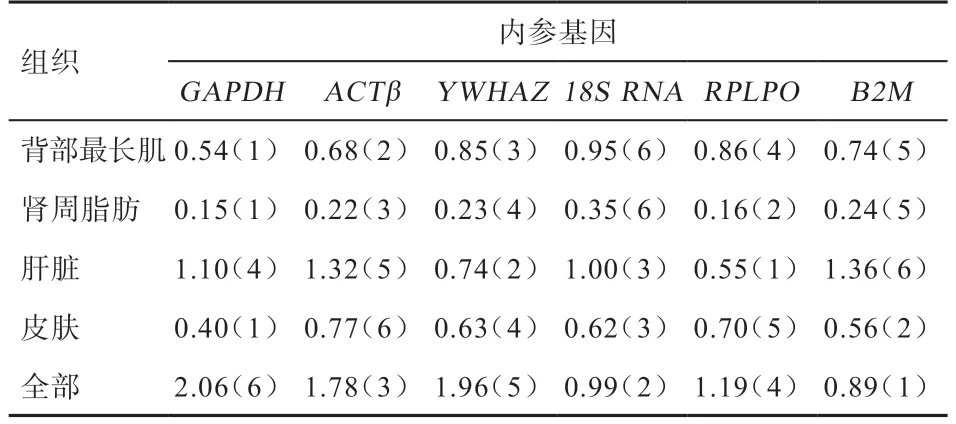
表5 BestKeeper 软件分析候选内参基因的标准偏差SD 及排序
3 讨 论
荧光定量PCR 是目前分子生物学研究中进行定量检测基因表达的一种可靠的技术,大量关于分子机制研究的科研工作均需要这项技术进行基因表达差异分析以探究某一分子机制的真实面目。齐波等[16]研究11 个候选基因在猪不同组织中的表达发现,肌肉组织中TBP基因和RPL14基因稳定性最好,而在肺脏组织中B2M基因和HPRT1基因最为稳定,说明在不同组织中内参基因的稳定性不同。陈瑞等[17]分析6 个内参基因在家兔不同发育阶段中的稳定性发现,在家兔胚胎期的心、肝和肾脏组织中表达最稳定的是GAPDH,而在幼龄期和成年期的3 个组织中HPRTI表达最为稳定。这说明不同发育阶段最为稳定的内参基因不同。对于细胞而言,在不同的体外培养条件下,内参基因的表达量也会有所改变。如Schmittgen 等[18]研究发现用血清培养成纤维细胞后,ACTβ基因和GAPDH基因的表达量均有不同程度的增加。Hamalainen 等[19]研究表明,在体外培养辅助性T 细胞分化时,GAPDH基因表达量有显著变化。因此,在基因定量分析前需要进行内参基因稳定性分析,选择出在该研究条件下稳定表达的内参基因,以确保定量结果的数据准确性。
目前在绵羊不同组织中进行基因定量表达分析时,多使用ACTβ和GAPDH作为内参基因。如孙国虎[20]研究背最长肌中基因差异表达时,选用的内参基因是ACTβ。高燕等[21]分析肝脏中基因差异表达时选用的内参基因是GAPDH。赵帅平等[22]分析绵羊不同组织中TRA2B基因差异表达时选用的是ACTβ基因校正定量结果。本研究结果表明,当对绵羊不同背部最长肌样本之间基因表达差异分析时,GeNorm、NormFinder及BestKeeper 3 个软件均显示GAPDH表达稳定性最好,可以作为内参基因;在绵羊肾周脂肪中最佳的内参基因样本之间基因表达差异分析时,3 个软件均显示GAPDH表达稳定性最好,可以作为内参基因;当对绵羊不同皮肤样本之间基因表达差异分析时,GeNorm 和NormFinder 软件均显示18S rRNA表达稳定性最好,而GeNorm 和BestKeeper 软件显示GAPDH表达稳定性最好。郑嫩珠等[23]研究表明GAPDH是校正色素沉积相关基因TYR、MITF和ASIP最优的内参基因,因此对于皮肤中关于色素相关基因的研究选择GAPDH校正。当对绵羊4 个组织之间基因表达差异分析时,GeNorm 和NormFinder 软件均显示RPLPO表达稳定性最好,而BestKeeper 软件显示B2M表达稳定性最好。这可能是由于3 款软件采用不同软件运算方法,导致候选内参基因的稳定性排序稍有不同[24]。因此,为获得更准确、更可靠的荧光定量PCR 实验数据,应该考虑到实际应用中的具体要求及实验条件等诸多影响因素,通过严格筛选,最终确定合适的内参基因。
4 结 论
本研究通过GeNorm、NormFinder 和BestKeeper 软件综合分析了绵羊4 个重要的组织中6 种内参基因表达稳定性,结果显示,在绵羊背部最长肌和肾周脂肪中,3 个软件都得出GAPDH表达最稳定;在肝脏中,3 个软件都得出RPLPO表达最稳定;在皮肤中,GeNorm 和NormFinder 均得出18S rRNA表达最稳定,而GeNorm和BestKeeper 均得出GAPDH表达最稳定,所以可选取以上2 个基因作为该条件下的校正基因。比较4 个组织中表达最稳定的基因时,GeNorm 和NormFinder 均得出RPLPO表达最稳定,而BestKeeper 得出B2M表达最稳定,所以可选取以上2 个基因作为该条件下的校正基因。
