小麦赤霉病新抗源W01的抗性及相关经济性状分析
2021-08-13司红起
赵 荣,蔡 华,司红起
小麦赤霉病新抗源W01的抗性及相关经济性状分析
赵 荣1, 2,蔡 华3*,司红起2
(1. 滁州职业技术学院,滁州 239000; 2. 安徽农业大学农学院,合肥 230036; 3. 滁州学院生物与食品工程学院,滁州 239000)
为鉴定小麦赤霉病新抗源W01的抗性,溯源其抗性基因,综合评价其育种利用价值,以高产、中感赤霉病的扬麦15为母本,分别与W01和苏麦3号组配杂交组合,以两个组合的F2遗传群体为研究对象,比较分析W01和苏麦3号的赤霉病抗性及其与株高、穗数、籽粒之间的关系。结果表明,W01和苏麦3号均含有抗赤霉病主效基因和,抗性均达到抗(R)水平,二者抗性相当。但W01株型紧凑,植株较矮,分蘖力较强,且丰产性和品质均优于苏麦3号。在与扬麦15组配的F2群体中,W01组合的抗性表现突出,中抗(MR)以上单株比例达91%,且整个群体没有感病(S)和高感(HS)单株出现,其抗性的遗传力高于苏麦3号组合,两个遗传群体的赤霉病性状与株高显著正相关,与有效穗数显著负相关。综合结果表明,W01是可以应用于改良小麦赤霉病抗性的优异育种材料。
小麦;赤霉病;抗源;株高
由镰刀菌()引起的小麦赤霉病(head blight, FHB)是一种广泛流行的世界性病害,已成为影响小麦高产、稳产、优质的重要因素。小麦赤霉病主要发生在温暖湿润地区,在我国,尤以南方长江中下游冬麦区发生严重,并正向黄淮麦区、北方麦区、西南和西北麦区扩展[1-3]。赤霉病严重威胁着小麦安全生产,一般流行年份可引起5% ~ 10%的产量损失,大流行年份可导致相当的田块绝收[4]。解决小麦赤霉病最根本的途径是获得赤霉病抗性优异且稳定的抗源[5-8]。
Arthur最早报道小麦不同品种间存在赤霉病抗性差异,此后,许多国家开展了小麦赤霉病抗源的鉴定与筛选工作。已发掘的小麦赤霉病抗源主要来源于东欧、中国、日本及巴西,其中以中国和日本小麦抗性更优[7]。我国的抗源苏麦3号、望水白、温州红和尚、平湖剑子麦等一直推动着小麦赤霉病抗性育种的发展。迄今,苏麦3号仍被认为是最好的赤霉病抗源,是世界各国广泛应用的抗赤霉病育种亲本之一[4, 9-11]。但苏麦3号植株偏高,农艺性状一般,后代抗性选择效果差,高产与高抗难以结合。因此生产上迫切需要发掘和筛选新的小麦赤霉病抗源。W01是以半矮秆、中感赤霉病的扬麦5号为母本,以高秆、高抗赤霉病的日本小麦延冈坊主为父本,F1代经花药培养诱导双单倍体(Double haploid,DH),并经多代选择育成的小麦赤霉病新抗源。本研究以高产、中感赤霉病的扬麦15为母本,分别与W01和苏麦3号组配杂交组合,以两个组合的F2遗传群体为研究对象,解析两个抗源的抗性基因,比较分析F2遗传群体的赤霉病抗性与株高、穗数、粒重等经济性状之间的关系,以期明确抗源W01的利用价值,为小麦抗病育种提供新材料。
1 材料与方法
1.1 供试材料与试验设计
以感赤霉病小麦品种扬麦15为母本,以抗源苏麦3号和W01为父本,组配2个杂交组合,分别为扬麦15/苏麦3号和扬麦15/W01。F1收获后正常秋播,来年春季,对2个F2遗传群体人工接种,进行抗赤性田间鉴定。
田间试验设计为:每个F2群体播种8行,行长20 m,行距0.25 m,按基本苗18万计算播种量,按国家小麦区域试验标准计算有效穗、穗粒数和千粒重,折算理论产量。设置苏麦3号为抗病(R)对照,扬麦15为感病(S)对照,同时种植抗源W01比较观察。
1.2 赤霉病抗性鉴定
1.2.1 抗赤霉病基因分子鉴定 参照TransGen公司(北京)的试剂盒EasyPure Plant Genomic DNA Kit说明书提取W01、苏麦3号和扬麦15共3种基因型小麦叶片基因组DNA。利用苏麦3号区段(GenBank登录号为KX907434)内、的编码区序列,在EnsemblPlants数据库(http://plants.ensembl.org/)中进行比对,获得各基因同源序列,设计特异引物(表1),交由通用生物(滁州)科技有限公司合成。两对引物的PCR扩增反应体系和反应条件一致,混合液总体积为20 μL,DNA模板100 ng,Super Mix混合物10 μL,上下游引物各2 μL,补齐ddH2O至20 μL。PCR反应程序为95 ℃预变性3 min;94 ℃变性30 s,65 ℃退火30 s,68 ℃延伸2.5 min,共35个循环;最后68 ℃延伸7 min,4 ℃保存[12-14]。PCR产物用1%琼脂糖胶进行电泳检测 (120 V,75 mA,30 min),余下样品存放于– 80 ℃超低温冰箱中备用。PCR产物同时送往通用生物(滁州)科技有限公司进行测序,测序结果在NCBI上进行BLAST序列分析,鉴定所扩增结果是否为和基因序列。

表1 用于扩增PFT-1和His-1基因开放阅读框的特异引物
1.2.2 田间接种鉴定 采用小麦初花期单花滴注法进行赤霉病田间接种及抗性鉴定,禾谷镰刀菌孢子液由安徽农业大学植保学院提供,以赤霉病小穗率作为衡量赤霉病抗性分级指标,进行抗性评价[2]。其中,1级为接种小穗发病,穗轴不发病;2级为穗轴发病,但发病小穗数不足全穗的25%;3级为发病小穗数占全穗的25% ~ 50%;4级为发病小穗数占全穗的50%以上。2018—2019年对扬麦15/苏麦3号、扬麦15/W01两个组合的F2遗传群体进行接种鉴定。接种时将混合孢子液稀释至5×105个·mL-1,随机选取扬花初期的单株单穗(株高大于100 cm和小于70 cm的单株,不在选择范围内),挂牌标记株号和日期,用微量加样器滴注10 μL孢子液至麦穗自下而上第5小穗1枚小花中,套袋保湿 3 ~ 4 d,苏麦3号、W01和扬麦5号3个亲本材料,每种接种20穗;扬麦15/苏麦3号、扬麦15/W01两个F2群体,每个群体接种200穗左右。接种21 d后统计病小穗率,计算平均值,病小穗率/%=(病小穗数/总小穗数)×100[15-16]。于成熟期测量两个F2群体接种单株的株高(cm),计算平均值。
1.3 统计分析
根据陆维忠[5]的方法,结合对照苏麦3号和扬麦15的发病情况,将病小穗率在15.0%以下的抗性等级定为抗(R),15.1% ~ 35.0%为中抗(MR),35.1% ~ 50.0%为中感(MS),50.1% ~ 75.0%为感病(S),75.1%以上为高感(HS)。
2 结果与分析
2.1 抗源W01的赤霉病抗性基因分子鉴定
和引物的PCR扩增结果(图1)显示,W01和苏麦3号均扩增出目的基因片段,扬麦15未扩增出目的基因片段。电泳检测结果显示,扩增产物2 000 ~ 3 000 bp,扩增产物1 000 ~ 2 000 bp,与目的基因和片段范围一致。测序结果表明,W01和苏麦3号扩出DNA片段长度一致,扩增产物长为2 273 bp,扩增产物长为1 309 bp,与目的基因序列同源率分别为99.75%和99.86%,表明本次试验获得的基因序列为小麦抗赤霉病基因和片段[12, 17-18]。
2.2 抗源W01的抗性鉴定及部分经济性状分析
3个亲本材料单花滴注接种后21 d,W01和苏麦3号的病小穗率分别为3.3%和3.1%,均达抗(R)水平,扬麦15病小穗率78.4%,达高感(HS)水平,W01和苏麦3号抗性差异不显著,表明W01的赤霉病抗性和苏麦3号相当。同时,W01株型紧凑,分蘖力较强,平均有效穗4.3个,比苏麦3号高24.5%,差异显著,与扬麦15相当;平均株高86.3 cm,比苏麦3号降低37.7%,差异极显著,很好地克服了苏麦3号植株过高易倒伏的缺点;W01纺锤形穗,长芒、白壳、白粒、角质,平均穗粒数35.7,比苏麦3号低3.1%,差异显著,可能与W01穗较小有关;千粒重也较苏麦3号低2.1%,但差异不显著。所有经济指标测算的产量,W01显著高于苏麦3号,与扬麦15相当。上述结果表明,小麦赤霉病新抗源W01克服了苏麦3号植株过高的缺点,且丰产性和品质均优于苏麦3号,是可以应用于改良小麦赤霉病抗性的优异育种材料。
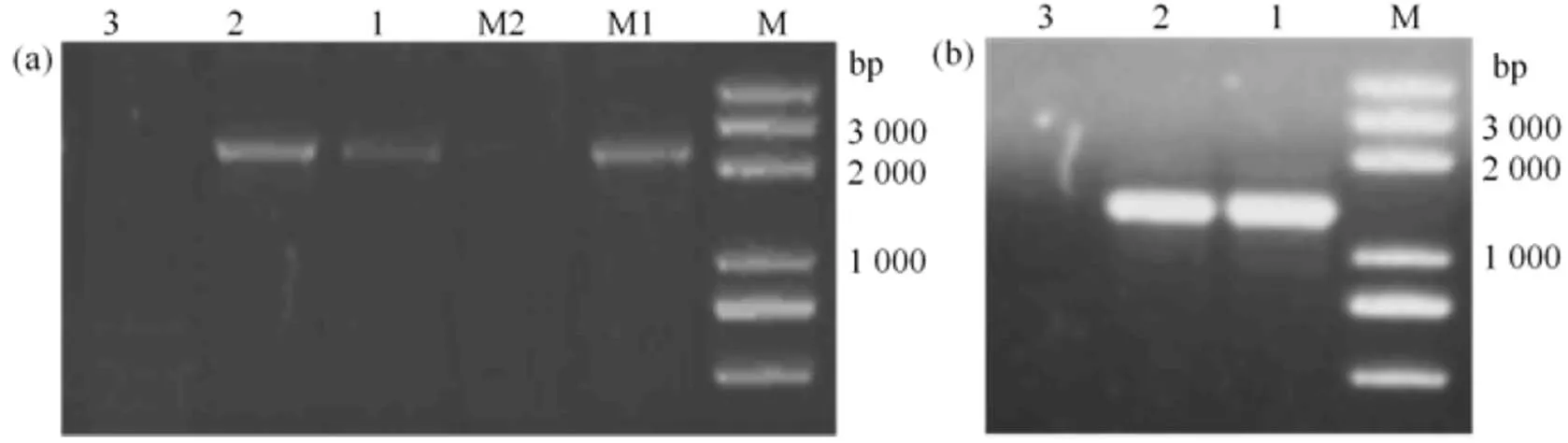
(a)为PFT-1扩增结果;(b)为His-1扩增结果。M为Marker,M1为苏麦3号,M2为无菌水,1为W01,2为苏麦3号,3为扬麦15。
Figure 1 PCR amplification results ofandprimers
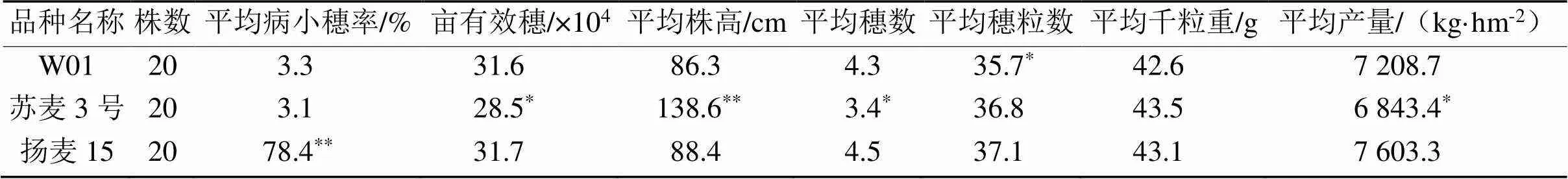
表2 W01和苏麦3号的赤霉病抗性及部分经济性状比较
注:病小穗率在15.0%以下的抗性等级定为抗(R),15.1% ~ 35.0%为中抗(MR),35.1% ~ 50.0%为中感(MS),50.1% ~ 75.0%为感病(S),75.1%以上为高感(HS),下同。*和**分别表示5%和1%水平的显著差异和极显著差异。

表 3 两个F2遗传群体的赤霉病抗性分析
2.3 两个F2遗传群体的赤霉病抗性比较
扬麦15/苏麦3号、扬麦15/W01两个组合的母本均为丰产性较好,但赤霉病抗性较差的扬麦15,父本为赤霉病抗源,组配的目的就是对扬麦15的抗赤性进行遗传改良。2019年对两个组合的F2遗传群体进行单花滴注抗性鉴定,发现两个群体的抗赤性均显著提高,平均病小穗率扬麦15/苏麦3号为20%,达中抗(MR)水平;扬麦15/W01仅为14.7%,达抗(R)级水平。进一步分析发现,W01组合的抗性表现突出,中抗(MR)以上单株比例达91%,且整个群体没有感病(S)和高感(HS)单株出现,表明在随机接种鉴定的单株中,W01组合具有优异的赤霉病抗扩展性。
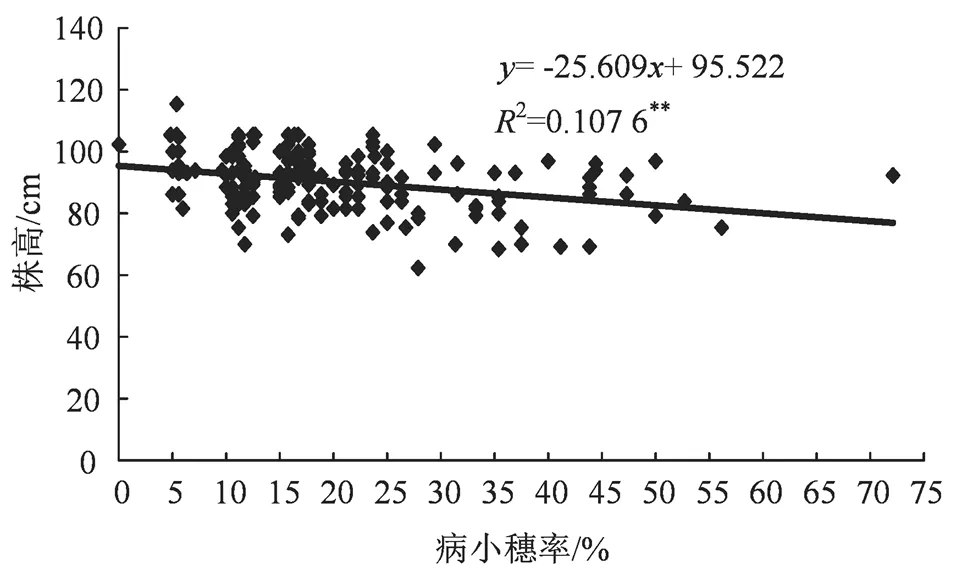
图2 苏麦3号/扬麦15杂交组合F2株高与病小穗率间的关系
Figure 2 Relationship between plant height and spikelet rate of F2in Sumai 3/Yangmai 15 cross combination
2.4 抗性与株高的关联分析
大量赤霉病抗源筛选和抗病育种实践发现,小麦品种的赤霉病抗性与某些性状具有显著的相关性[19-22]。通常情况下,植株越高、小穗着生密度越稀、叶色越淡、穗下节越长的品种,其赤霉病抗性理论上越强。本研究中,扬麦15/苏麦3号、扬麦15/W01两个组合,其F2遗传群体赤霉病抗性与株高之间均表现出正相关趋势,而在病小麦穗率上则表现为,随株高升高,病小穗率逐渐下降(图2和图3)。进一步将病小穗率按抗(R)到感(S)进行分类,两个F2遗传群体的抗性与株高呈现出更显著的正相关关系,W01/扬麦15的F2群体抗性在中抗以上、株高小于90 cm的个体占91%,而对照群体苏麦3号/扬麦15为87.2%(表3和表4)。总体而言,以扬麦15作为共同母本,W01组配的F2群体比苏麦3号表现出更理想的赤霉病抗性,而且株高更趋于合理,理论上可以选育出抗性优良的新品系。

图 3 W01/扬麦15杂交组合F2株高与病小穗率间的关系
Figure 3 Relationship between plant height and spikelet rate in W01/ Yangmai 15 cross combination F2

表4 两个F2遗传群体赤霉病抗性与株高间的关系
3 讨论
小麦的种内和种外存在着丰富的抗病、抗逆种质资源,如何从中鉴定和筛选出赤霉病抗源,是进行小麦赤霉病抗病育种的前提[5]。抗源主要来源于农家品种的收集、国外抗病品种的引进以及对现有品种抗性改良创制的中间材料。本研究中的W01为利用日本抗源延冈坊主对当地小麦品种扬麦5号进行抗性遗传改良获得的中间材料,与苏麦3号不同,W01不仅赤霉病抗性较强,且株型紧凑、植株较矮、有效穗数较多,是理想的赤霉病遗传改良亲本材料。本研究证实,W01不仅当代抗性突出,与扬麦15杂交后的F2代仍有90%单株病小穗率达到35.5%以下的中抗(MR)水平,甚至有62.8%单株达到抗(R)水平。因为小麦赤霉病抗性属于早世代遗传性状,理论上可以从F2群体中结合综合农艺性状筛选出丰产、抗病新品种。目前,我们以W01为亲本,组配了若干组合,已经优选了几十个抗赤霉病新品系,其中滁麦1801(扬麦15/W01)已进入长江中下游区域试验,近3年中国农科院植保研究所提供的赤霉病抗性报告显示,一年高抗(R级,平均严重度1.4,与抗病对照苏麦3号1.27相当),两年中抗(平均严重度分别为1.6和1.7),赤霉病抗性稳定。
大量研究表明,小麦赤霉病抗性与产量、品质等重要性状呈一定水平的负相关关系[15-16, 23-25]。因此,生产上很难培育出既丰产、又抗病、且优质的完美小麦品种,而在产量、品质和抗性三者或两者之间筛选生产上能过得去、没重大缺陷的品种,是目前最常用的育种途径。程顺和等[4]比较研究了小麦赤霉病抗病育种两个途径,一是抗性强、丰产性较差的抗源与丰产亲本杂交,后代在高选择压力下,重点加强对抗性的选择,结果虽然培育了一批抗性强的品系,但都因丰产性差而在区域试验中被淘汰,最终只能作为抗病育种的中间材料加以应用。二是选用综合丰产性状较好、赤霉病抗性较强(MR以上)的亲本互相杂交,后代注重综合性状的选择,兼顾抗性的选择,这样更容易获得理想品种,著名的小麦品种扬麦158就是这样选育出来的[1]。本试验中的W01符合综合丰产性较好、赤霉病抗性较强的特性,按此思路,可以和生产上大面积推广品种杂交,理论上可以从后代中选育出丰产、抗病新品种。
本次试验值得关注的一个问题是,虽然W01抗性较苏麦3号低,但与同一母本扬麦15杂交后的F2群体,其抗性明显优于苏麦3号组合,表明W01抗性向杂交后代传递的稳定性强于苏麦3号,即W01赤霉病抗性的遗传力要强于苏麦3号。贾高峰利用抗病品种望水白和苏麦3号分别与感病品种Alondra's杂交,F1花药培养,经染色体加倍构建了2个DH群体,发现望水白/Alondra's群体赤霉病抗性比苏麦3号/Alondra's群体强,但抗性的稳定性却不如苏麦3号DH群体[26]。即不同抗源在组配杂交组合时,其杂交后代的抗性与抗源亲本的抗性并无相关性,产生这种现象可能因为小麦赤霉病抗性属多基因控制的数量性状基因,不同基因型含有的抗病基因不同,基因间存在加性和上位性效应[27]。抗源W01的抗性遗传可能与此有关。
[1] 程顺和, 郭文善, 王龙俊. 中国南方小麦[M]. 南京: 江苏科学技术出版社, 2012.
[2] 罗明, 蔡华, 余飞宇, 等. 小麦骨干亲本生选6号的赤霉病抗性遗传分析[J]. 麦类作物学报, 2017, 37(12): 1550-1554.
[3] MA H X, ZHANG X, YAO J B, et al. Breeding for the resistance tohead blight of wheat in China[J]. Front Agr Sci Eng, 2019, 6(3): 251.
[4] 程顺和, 张勇, 别同德, 等. 中国小麦赤霉病的危害及抗性遗传改良[J]. 江苏农业学报, 2012, 28(5): 938-942.
[5] 陆维忠. 小麦赤霉病研究[M]. 北京: 科学出版社, 2001: 45-53.
[6] 陆维忠. 小麦赤霉病抗性分子标记的筛选及其利用[J]. 江苏农业学报, 2011, 27(2): 243-249.
[7] 马鸿翔, 周明国, 陈怀谷. 小麦赤霉病[M]. 南京: 江苏凤凰科学技术出版社, 2019: 85-97.
[8] JIA H Y, ZHOU J Y, XUE S L, et al. A journey to understand wheathead blight resistance in the Chinese wheat Landrace Wangshuibai[J]. Crop J, 2018, 6(1): 48-59.
[9] BERRAIES S, KNOX R E, DEPAUW R M, et al. Effectiveness of multigenerational transfer of Sumai 3head blight resistance in hard red spring wheat breeding populations[J]. Can J Plant Sci, 2020, 100(2): 156-174.
[10] SHI S, ZHAO J, PU L, et al. Identification of new sources of resistance to crown rot andhead blight in wheat[J]. Plant Dis, 2020, 104(7): 1979-1985.
[11] HUANG Q L, FATIMA S A, ZHONG S F, et al. Identification of three new resources of resistance tohead blight in wheat[J]. Czech J Genet Plant Breed, 2019, 55(1): 15-19.
[12] 朱展望, 徐登安, 程顺和, 等. 中国小麦品种抗赤霉病基因的鉴定与溯源[J]. 作物学报, 2018, 44(4): 473-482.
[13] 周淼平, 姚金保, 张平平, 等. 黄淮麦区小麦抗赤霉病新种质的创制和筛选[J]. 麦类作物学报, 2018, 38(3): 268-274.
[14] 张宏军, 宿振起, 柏贵华, 等. 利用基因功能标记选择提高黄淮冬麦区小麦品种对赤霉病的抗性[J]. 作物学报, 2018, 44(4): 505-511
[15] 胡文静, 张春梅, 吴迪, 等. 长江中下游小麦抗赤霉病品种的筛选与部分农艺性状分析[J]. 中国农业科学, 2020, 53(21): 4313-4321
[16] 付必胜, 付黎明, 吴燕, 等. 小麦骨干亲本阿夫衍生系赤霉病抗性的关联分析[J]. 植物遗传资源学报, 2018, 19(4): 598-611.
[17] 徐飞, 王俊美, 杨共强, 等. 黄淮冬麦区小麦主栽品种赤霉病综合抗性鉴定及其抗性基因检测[J]. 植物保护, 2020, 46(5): 84-92
[18] SU Z, BERNARDO A, TIAN B, et al. A deletion mutation in TaHRC confers Fhb1 resistance tohead blight in wheat[J]. Nat Genet, 2019, 51(7): 1099-1105.
[19] ELDOLIEFY A E A, KUMAR A, ANDERSON J A, et al. Genetic dissection ofhead blight resistance in spring wheat cv. ‘Glenn’[J]. Euphytica, 2020, 216(5): 1-12.
[20] LI Z Q, MA L, ZHANG Y, et al. Effect of wheat cultivars with different resistance tohead blight on rhizosphereabundance and microbial community composition[J]. Plant Soil, 2020, 448(1/2): 383-397.
[21] CASTRO AVILES A, ALAN HARRISON S, JOSEPH ARCENEAUX K, et al. Identification of QTLs for resistance tohead blight using a doubled haploid population derived from southeastern United States soft red winter wheat varieties AGS 2060 and AGS 2035[J]. Genes, 2020, 11(6): 699.
[22] ZHANG P P, GUO C J, LIU Z, et al. Quantitative trait loci forhead blight resistance in wheat cultivars Yangmai 158 and Zhengmai 9023[J]. Crop J, 2021, 9(1): 143-153.
[23] 张爱民, 阳文龙, 李欣, 等. 小麦抗赤霉病研究现状与展望[J]. 遗传, 2018, 40(10): 858-873.
[24] 关东, 陈莉, 张沙沙, 等. 小麦赤霉病CBR预测模型参数的优化[J]. 安徽农业大学学报, 2014, 41(1): 82-86.
[25] 姚金保, 陆维忠. 中国小麦抗赤霉病育种研究进展[J]. 江苏农业学报, 2000, 16(4): 242-248.
[26] 贾高峰. 普通小麦DH群体赤霉病抗性遗传研究及QTL检测和效应分析[D]. 南京: 南京农业大学, 2005.
[27] 贾高峰, 陈佩度, 秦跟基, 等. 望水白和苏麦3号构建的DH群体赤霉病抗性比较[J]. 作物学报, 2005, 31(9): 1179-1185.
Analysis of resistance and related economic characters of a new wheatblight resistant source W01
ZHAO Rong1, 2, CAI Hua3, SI Hongqi2
(1. Chuzhou Vocational and Technical College, Chuzhou 239000; 2. School of Agronomy, Anhui Agricultural University, Hefei 230036;3. School of Biology and Food Engineering, Chuzhou University, Chuzhou 239000)
In order to identify the resistance of new wheat scab resistance source W01, we traced its resistance genes and evaluated its breeding value. We took the high-yield and moderately susceptible head blight Yangmai 15 as the female parent to hybridized with W01 and Sumai 3, respectively, and two F2 genetic populations of the two combinations were used as the research object to compare and analyze the FHB resistance of W01 and Sumai 3 and its relationship with plant height, spike number and kernel trait. The results showed that both W01 and Sumai 3 contained the main genesandfor FHB resistance, and the FHB resistance reached to R level. However, W01 was of a compact plant type with shorter plants, stronger tillering ability, and it had better yield and quality than Sumai 3. In the F2 population crossed with Yangmai 15, the FHB resistance of W01 combination was prominent, the percentage of single plant above MR reached 91%, there were no single plants of S and HS in the whole population, and the heritability of FHB resistance of W01 combination was higher than that of Sumai 3. The FHB resistance of the two genetic populations was positively correlated with the plant height, and negatively correlated with the number of productive panicles. The results indicated that W01 is an excellent breeding material for improving wheat FHB resistance.
wheat;head blight; resistance source; plant height
S512.103.4
A
1672-352X (2021)03-0339-05
10.13610/j.cnki.1672-352x.20210706.023
2021-7-7 9:57:45
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210706.1700.046.html
2021-03-13
国家重点研发计划项目(2017YFD0100804),安徽省高校自然科学研究重大项目(KJ2020ZD62)和安徽省高校人文社科研究重点项目(SK2018A0876)共同资助。
赵 荣,副教授。E-mail:zhaorong7233@163.com
蔡 华,博士,教授。E-mail:chczh@163.com
