高产碱性纤维素酶细菌的筛选鉴定及其酶学特性与发酵条件研究
2021-08-02马振刚熊亮张真罗堿
马振刚 熊亮 张真 罗堿

摘要:【目的】从自然环境中分离筛选高产纤维素酶的菌株,开展碱性纤维素酶的酶学特性分析,为该菌株及所产纤维素酶的综合开发利用打下基础。【方法】采用羧甲基纤维素钠(CMCNa)平板筛选法筛选纤维素酶高产菌株,利用生理生化分析结合分子生物学法对菌株进行鉴定,并通过3,5-二硝基水杨酸(DNS)法研究其活性特征与发酵条件。【结果】在长期覆盖枯树叶的土壤中分离获得1株高产碱性纤维素酶的菌株,经鉴定该菌株为蜡样芽孢杆菌(Bacillus cereus),名称为B. cereus strain CQNUX 3-1。酶活性分析显示该菌株胞外分泌液具有内切葡聚糖酶、外切葡聚糖酶及β-葡萄糖苷酶的活性,其酶活力分别达107.7、33.1和155.6 U/mL。酶学特征分析表明3种酶组分均具有较好的耐碱和一定的耐高温能力。其中,内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶的最佳反应温度分别为70、60和40 ℃;最佳反应pH分别为8.0、9.0和9.0;Fe3+能增加3种酶的酶活力,而β-葡萄糖苷酶具有较好的EDTA、尿素和Cu2+耐受性。发酵条件对菌株产酶的分析结果表明,该菌株发酵温度在37 ℃較适宜;发酵第4 d时的酶活力达最大值;该菌株能在碱性发酵环境下生长并产酶,在初始pH为7.0时发酵酶活力最高。【结论】筛选获得的纤维素酶高产菌株B. cereus strain CQNUX 3-1所生产的纤维素酶具有较高的反应温度适用性和较强的碱耐受性,菌株发酵产酶温度适中,且有较宽的发酵pH适用范围,可作为碱性纤维素酶生产资源菌株,具有应用于纤维素酶制剂制备与生产、纤维素资源综合利用等领域的潜力。
关键词: 碱性纤维素酶产生菌;筛选鉴定;酶学特性;发酵条件;蜡样芽孢杆菌
中图分类号: S154.39 文献标志码: A 文章编号:2095-1191(2021)03-0722-10
Screening and identification of a strain with high yield of alkaline cellulase and its enzyme characterizations and
fermentation conditions
MA Zhen-gang, XIONG Liang, ZHANG Zhen, LUO Jian
(College of Life Sciences, Chongqing Normal University, Chongqing 401331, China)
Abstract:【Objective】Strains with high yield of cellulase were isolated from the natural environment,and the enzymatic characteristics of screened alkaline cellulase were analyzed which could lay a foundation for the comprehensive development and utilization of the cellulase produced by this strain. 【Method】The carboxymethyl cellulose sodium(CMCNa)plate screening method was used to isolate and screen high yield cellulose-producing strains and then the isolated strains were identified by physiological and biochemical analysis and molecular biology method. The characteristics of enzyme activity and fermentation conditions were studied by 3,5-dinitrosalicylic acid(DNS) method. 【Result】A high alkaline cellulase producing strain was isolated from the soil samples which were long-term covered by rotting leaves and this strain was identified and named as Bacillus cereus strain CQNUX 3-1. The results of enzyme activity tests showed that strain CQNUX 3-1 exhibited the activity of endoglucanase,exoglucanase and β-glucosidase and were 107.7,33.1 and 155.6 U/mL,respectively. Analysis of enzymatic characterization showed that the three enzymes had better alkaline resistance and certain high temperature performance. The optimum reaction temperature of endoglucanase,exoglucanase and β-glucosidase were 70,60 and 40 ℃,respectively. The best reaction pH were 8.0,9.0 and 9.0 respectively. Fe3+ could increase the enzyme activity of three enzymes,while β-glucosidase showed better tolerance to EDTA,urea and Cu2+. The effect of fermentation conditions on the enzyme production showed that the optimum fermentation temperature of the strain was 37 ℃ and the enzyme activity could reach to the maximum after four days fermentation. Finally,the bacteria could grow and produce enzymes under alkaline fermentation environment. Enzyme activity was the best when the initial pH was 7.0. 【Conclusion】A strain with high alkaline cellulase producing is selected. The cellulase produced by B. cereus strain CQNUX 3-1 has high reaction temperature applicability and strong alkali resistance. The strain fermentation enzyme has moderate temperature and has a wide range of fermentation pH. This strain can be used as a alkaline cellulase production resource strain, with the potential for the preparation and production of cellulase preparations and the comprehensive utilization of cellulose resources.
Key words: alkaline cellulase producing strain; screening and identification; enzyme characterization; fermentation conditions; Bacillus cereus
Foundation item: National Natural Science Foundation of China(31770160); Science and Technology Research Project of Chongqing Municipal Education Commission(KJQN201800524)
0 引言
【研究意义】纤维素是自然界中分布最广、储量最多的碳水化合物,占植物界碳含量的50%以上,为地球上最丰富的生物质资源和天然可再生能源物质(高凤菊和李春香,2005;Ragauskas et al.,2006)。但由于植物纤维素具有不溶于水的结晶状刚性结构,且通常被木质素层覆盖或包围,因此其开发利用面临较大困难(高蕾蕾和李迎秋,2017),约有80%纤维素未得到充分利用,对纤维素废弃物的大量丢弃或焚烧处理还带来严重的环境污染问题(师璐等,2017)。目前,降解天然纤维素的方法主要包括酸水解、热化学处理及酶水解法等(刘锁珠等,2017)。其中,酶水解法因具有快速、高效和环保等优点而被广泛应用于环境保护、食品工业、动物生产和中药成分提取等领域(赵君,2017)。尤其是在食品行业领域内,纤维素酶在果蔬加工、白酒酿造、酱油酿造、食醋酿造、啤酒加工、饮料加工和茶叶加工等工艺过程中均具有重要作用(高蕾蕾和李迎秋,2017)。纤维素酶是由多种酶组成的多酶系统,包括纤维二糖水解酶、内切葡聚糖酶(CMCase)和α-葡萄糖苷酶(da Silva Delabona et al.,2012;Shanmugapriya et al.,2012)。但酶水解法在应用过程中易受底物、反应条件和酶活力等因素的影响,致使酶在诸多生产环境下无法有效水解纤维素而导致纤维素转化率和降解物回收效率降低(Mojovi? et al.,2006;Eijsink et al.,2008)。因此,開发获得高活力且对pH、温度、离子及添加物等反应条件具有较好耐受性的纤维素酶对提高酶水解法工作效率具有重要意义。【前人研究进展】产纤维素的真菌包括曲霉属、镰刀菌属、青霉菌属和木霉属,是获得水解植物纤维素所需的酶复合物的来源(da Silva Delabona et al.,2012)。其中,里氏木霉在工业乙醇生产业、食品业、饲料生产行业、纺织品和纸浆纸张生产领域已有推广应用(Fischer et al.,2020);但丝状真菌(包括曲霉属、青霉属和木霉属等)因生长较慢、菌体产色、纤维素酶产物抑制及低酶活力等(Lo et al.,2005),在一定程度上限制了其在纤维素酶生产和纤维质降解等领域的推广与应用(闫训友等,2004;文少白等,2010)。细菌因具有生长快、增殖周期短、代谢能力强等特点已成为获得微生物源纤维素酶的理想来源之一(Rajendran et al.,2019)。至今,越来越多产纤维素酶的细菌菌株被筛选获得,包括芽孢杆菌属(Bacillus)(Hassan and Sohail,2020)、梭菌属(Clostridium)(Gaur and Tiwari,2015)等均已用于生产纤维素酶。新的纤维素产生菌株,如藤黄色杆菌(Luteibacter)(李正风等,2020)和纤维单胞菌(Cellulomonas)(Shi et al.,2020)等也陆续被筛选得到。作为菌株资源的筛选来源,土壤(Reddy et al.,2018)、沙漠 (Shi et al.,2020;Thamer and Pravej,2020)及垃圾堆(Ma et al.,2015)、肠道和粪便(Peristiwati et al.,2018;Rajendran et al.,2019)、秸秆堆肥(李正风等,2020;Mohammadipour et al.,2020)等越来越受到研究人员的关注。其中,土壤作为资源微生物筛选的宝库已成为各类微生物资源的重要筛选来源。Alvarado等(2020)利用新方法从土壤中分离出对革兰氏阴性和革兰氏阳性测试菌具有拮抗活性的放线菌;Rushabh等(2020)从番茄根际土壤中分离得到1株能产生吲哚-3-醋酸的细菌,并通过薄层色谱和高效液相对产物性质进行分析;Casta?eda-Cisneros等(2020)从山谷农业土壤中分离出链霉菌,并对其产生的内切葡聚糖酶(CMCase)和木聚糖酶(Xyl)的产量进行评价;Koul等(2021)从桑树组织和根际土壤中分离得到2株蛋白酶产生菌。另外,具有降解农药莠去津(Ye et al.,2016)、产生生物活性代谢物(Awad et al.,2018)、降解淀粉(Gudeta,2018)等能力的微生物也从土壤样品中被筛选获得。【本研究切入点】由于不同行业中纤维素酶的反应条件迥异,生产条件也较苛刻,迫切需要在苛刻或极端条件下能有效降解的纤维素酶。已报道纤维素酶产生菌的发酵条件与酶反应条件较温和,而针对高产量的极端条件纤维素降解菌的研究报道极为少见。【拟解决的关键问题】通过平板筛选法,利用细菌鉴定结合分子生物学鉴别系统鉴定分离获得高产碱性纤维素酶菌株,并对该菌株的纤维素酶类型、产酶发酵条件和粗酶的最适反应条件进行全面分析,为该菌株及所产纤维素酶的综合开发利用打下基础。
1 材料与方法
1. 1 试验材料
1. 1. 1 样品来源 土壤样品采集于重庆师范大学(大学城校区)树林下长期堆积腐烂枯叶的区域,分三点取样,采样深度10 cm。
1. 1. 2 培养基 (1)羧甲基纤维素筛选培养基:羧甲基纤维素钠5.0 g,K2HPO4 1.0 g,MgSO4·7H2O 0.5 g,蛋白胨1.0 g,琼脂20.0 g,NaCl 0.5 g,NaH2PO4 1.0 g,刚果红0.2 g,蒸馏水1000 mL。(2)初步发酵培养基:CMCNa 5.0 g,蛋白胨2.5 g,酵母膏0.5 g,MgSO4 0.3 g,KH2PO4 2.0 g,NaCl 1.0 g,(NH4)2SO4 1.0 g,CaCl2·2H2O 0.3 g,FeSO4·7H2O 0.005 g,MnSO4 0.0016 g,ZnCl2 0.0017 g,CoCl2 0.0017 g,蒸馏水1000 mL,自然pH。(3)LB固体培养基:胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 10.0 g,琼脂20.0 g,蒸馏水1000 mL。(4)β-葡萄糖苷酶筛选培养基:含0.1%七叶苷和0.05%柠檬酸高铁铵的LB的培养基。
1. 1. 3 试剂 (1)常用试剂:七叶苷和柠檬酸高铁铵购于Sigma公司,刚果红、滤纸和CMCNa购自生工生物工程(上海)股份有限公司。(2)DNS试剂:称45.5 g酒石酸钾钠加入125 mL热水中,搅拌溶解后加入1.575 g的3,5-二硝基水杨酸和65.5 mL的2 mol/L NaOH,再加入1.25 g重蒸酚和1.25 g亚硫酸钠,搅拌溶解,冷却,用蒸馏水定容至250 mL,贮存在棕色瓶中备用。
1. 2 试验方法
1. 2. 1 纤维素酶产生菌初步筛选 取5.0 g样品加入到495 mL蒸馏水中,37 ℃摇床振荡15 min后静置30 min,取100 μL悬浊液加入到900 μL灭菌水中,混匀,稀释至10-1;各吸取50 μL 10-1浓度的土样悬浊液,将稀释液涂布在羧甲基纤维素琼脂筛选培养基上,放置于37 ℃恒温箱中培养24 h后,观察菌落生长情况及透明水解圈大小。
1. 2. 2 筛选平板复筛 观察在筛选培养基上周围有明显透明水解圈的菌落,挑取透明圈直径与菌落直径比较大的菌株进行多次重复划线纯化,置于37 ℃恒温箱中培养24 h直到获得纯菌株。将纯化后的菌株接种至液体LB培养基中,于37 ℃、150 r/min条件下振荡培养至浑浊,4 ℃保存备用。
1. 2. 3 菌株形态学观察与生理生化分析 取分离菌株划线接种在固体LB培养基上以获取单菌落,观察菌落特征,包括颜色、光泽、表面状况、形状、大小和质地等特征(张纪忠,1990)。生理生化特征分析主要参照《伯杰氏系统细菌学手册》和《微生物学实验手册》(周德庆,1986;Sneath et al.,1986)。
1. 2. 4 基于16S rDNA序列的系统进化分析 以分离菌株总DNA为模板,采用细菌16S rDNA序列的通用引物8F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-ACGGTTACCTTGTTACGACTT-3')进行16S rDNA序列PCR扩增。PCR扩增程序:95 ℃预变性5 min;94 ℃ 40 s,55 ℃ 30 s,72 ℃ 90 s,进行32个循环;72 ℃延伸10 min;4 ℃ 保存(陈丽燕等,2011)。PCR产物送至生工生物工程(上海)股份有限公司进行序列测定。测序获得的序列通过NCBI在线BLAST程序进行同源检索并下载同源序列,使用ClustalX进行多重序列比对,并通过MEGA 7.0中的邻接法(Neighbor-joining,NJ)构建系统发育进化树。
1. 2. 5 纤维素酶粗酶液制备 将分离菌株按20%的比例接种到含250 mL发酵培养基的锥形瓶中,于30 ℃、170 r/min条件下振荡培养1~6 d。每天取出1瓶发酵液,10000 r/min离心3 min,收集上清液即为细胞胞外酶液。
1. 2. 6 3,5-二硝基水杨酸(DNS)法测定酶活力
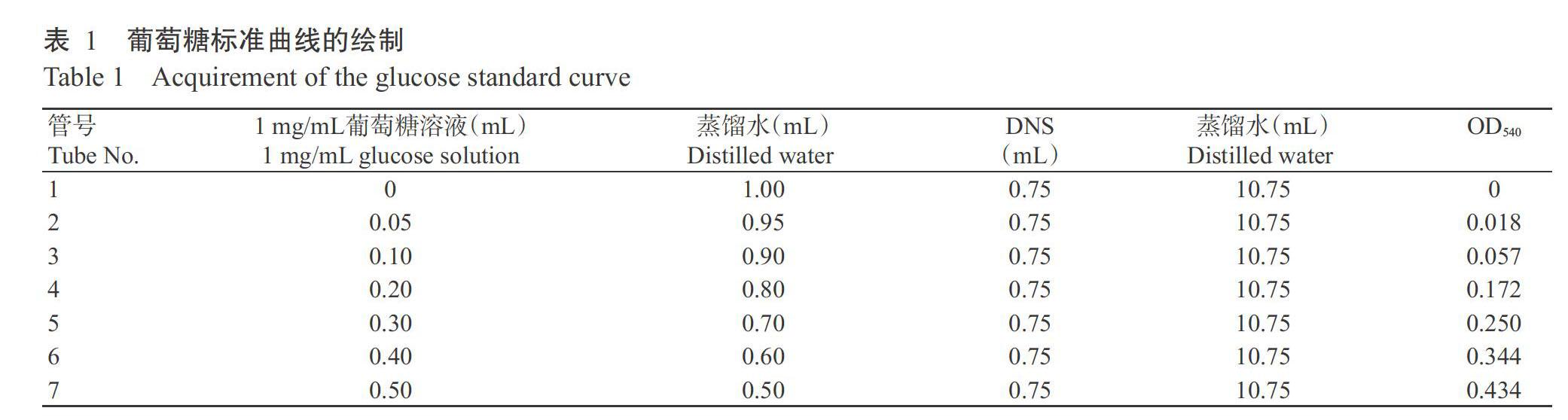
(1)葡萄糖标准曲线绘制:准确称取104.8 mg恒重葡萄糖,用蒸馏水溶解并定容于100 mL容量瓶中,配制成1 mg/mL标准葡萄糖溶液,作为標准葡萄糖母液备用。按照表1完成各试剂的添加及反应,冷却后分别在540 nm下比色,记录吸光值(OD540),绘制葡萄糖标准曲线。
(2)菌株酶活力测定:分别以羧甲基纤维素钠、滤纸和七叶苷为底物测定纤维素酶各组分(内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶)的酶活力(Kirstahler et al.,2015)。0.5 mL菌体发酵上清液加入1.0 mL底物反应液,再加入0.5 mL pH 7.0的磷酸盐缓冲液,在35 ℃水浴下反应30 min;加入1.0 mL DNS显色反应液,沸水浴10 min,终止反应。冷却后补足至5.0 mL,540 nm波长下测定OD540。酶活力定义:在35 ℃下,1.0 mL酶液每分钟水解底物生成1 μg葡萄糖的酶量,称为1个酶活力单位,以U/mL表示。
1. 2. 7 反应条件对菌株酶活力的影响 取发酵培养2 d后离心收集的上清液作为粗酶液,保持反应pH为7.0,测定不同反应温度(10、 20、30、40、50、60、70、80和90 ℃)对纤维素酶活力的影响。收集发酵4 d后的粗酶液,在40 ℃反应条件下测定不同反应pH(5.0、6.0、7.0、8.0、9.0、10.0和11.0)对酶活力的影响。取发酵培养2 d后离心收集的上清液作为粗酶液,在温度40 ℃和pH 7.0条件下,分别配制含有不同离子或化合物(K+、Ca2+、Fe3+、Mg2+、Ba2+、Cu2+、Na+、Zn2+、EDTA和尿素)的反应缓冲液,测定不同添加物对纤维素酶活力的影响。纤维素酶各组分的酶活力测定按前述方法进行,每组试验均设3次独立重复。
1. 2. 8 菌株发酵条件优化 将分离菌株按2%的接种量接种于发酵培养基中进行产酶条件优化。在180 r/min转速的振荡培养条件下,分别测定培养基初始pH(4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0)、培养温度(20、25、30、35、40和45 ℃)及培养时间(1、2、3、4、5、6和7 d)对菌株产纤维酶活力的影响。
1. 3 统计分析
每个试验条件下计算获得3组平行试验数据,使用SPSS 22.0对不同试验条件下所获取的数据进行T检验,使用GraphPad Prism 5进行图表制作。
2 结果与分析
2. 1 纤维素酶产生菌的筛选与分离结果
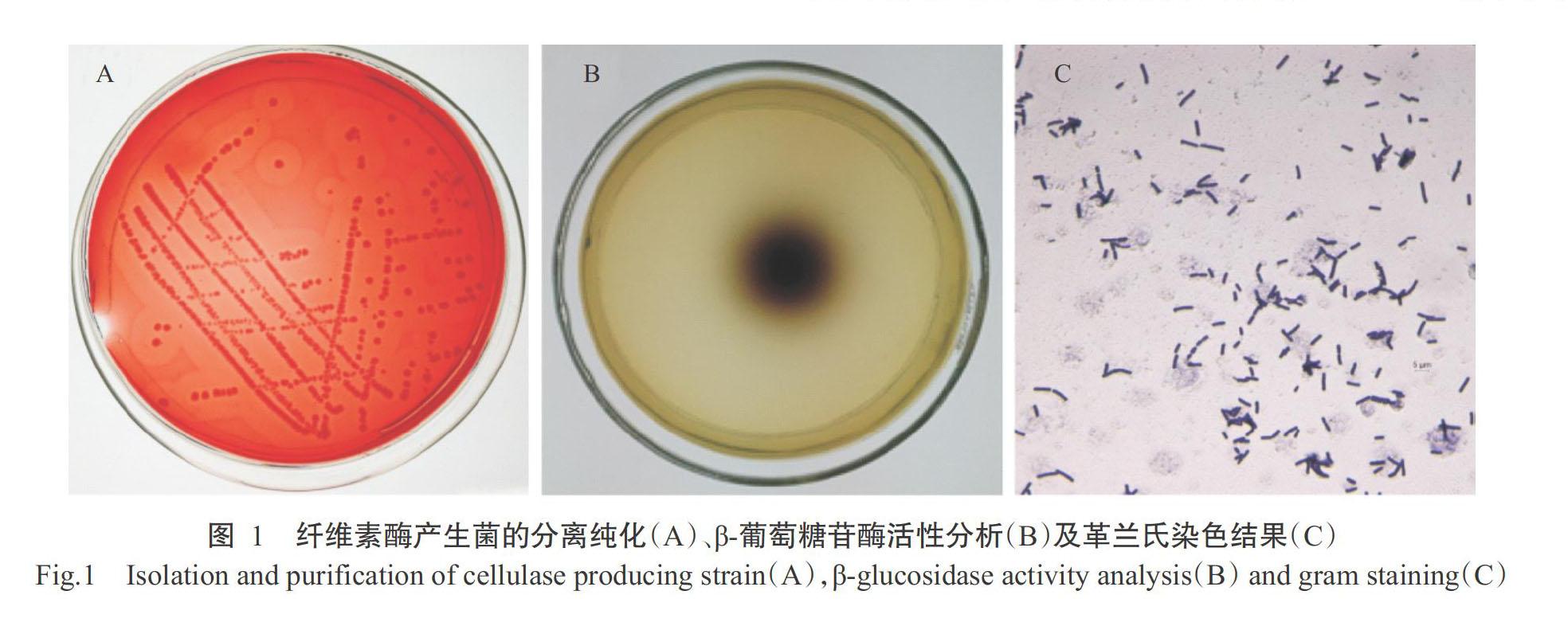
收集到的土壤样品按前述方法进行稀释,均匀涂布于以CMCNa为唯一碳源的筛选培养基上,37 ℃培养72 h后,挑选透明圈直径(H)和菌落直径(C)比值最大的分离菌株进行反复划线纯化,如图1-A所示。结果表明,该分离菌株的H/C为5.08。在β-葡萄糖苷酶筛选培养基上菌落周围能产生黑圈(图1-B),表明其具有产生β-葡萄糖苷酶的能力。
2. 2 分离菌株的鉴定结果
2. 2. 1 菌落形态及生理生化鉴定 对纯化获得的细菌单菌落进行形态学观察,其菌落为白色,偏大,扁平,圆形,边缘不规则,不分泌色素(图1-A)。显微镜观察发现,其菌体呈长杆状,革兰氏阳性菌,无荚膜(图1-C)。随后,对分离菌株进行葡萄糖发酵、硝酸还原等生理生化鉴定,结果(表2)表明,该菌株为革兰氏阳性菌,菌体为长杆状,能利用葡萄糖、蔗糖、果糖,可水解淀粉,七叶苷、接觸酶、尿素分解和硝酸还原试验等呈阳性,甲基红(M.R)反应和V-P试验呈阴性。各项生理生化指标特征与芽孢杆菌属的代表种一致(周德庆,1986)。
2. 2. 2 基于16S rDNA序列的系统发育分析 提取分离菌株的基因组作为模板(图2-A),采用细菌16S rDNA序列的通用扩增引物进行PCR扩增,扩增产物单一,且其分子量约1.6 kb,结果如图2-B所示。
对PCR产物进行测序,获得长度为1516 bp的DNA序列(GenBank登录号MW314599)。多重序列比对分析结果表明,分离菌株的16S rDNA序列与B. cereus strain 55-4的16S rDNA具有最高的序列同源性。从GenBank中下载获得系统发育分析所需的同源基因序列,使用ClustalX进行多重序列对比后,用MEGA 7.0构建系统发育进化树,约束条件为Bootstrap方法1000个重复检测。结果(图2-C)表明,分离菌株与B. cereus的不同分离菌株聚为一枝,且与B. cereus strain 55-4进化距离最近。
综上所述,分离菌株的菌落形态、生理生化特征与芽孢杆菌属一致,16S rDNA序列与B. cereus strain 55-4的同源性达99%,在系统发育进化树中与B. cereus菌株能聚为一枝,表明其进化关系较近。因此,确定分离菌株为蜡样芽胞杆菌(B. cereus),其名称为B. cereus strain CQNUX 3-1。
2. 3 纤维素酶各组分的酶活力分析结果
2. 3. 1 葡萄糖标准曲线 按前述方法,利用分光光度法获得以葡萄糖浓度为横坐标、OD540为纵坐标所得的标准曲线回归方程为:y=0.8996x-0.0051,R2=0.9957。
2. 3. 2 不同底物条件下酶活力的测定 根据前述方法取发酵第4 d的粗酶液,底物分别为羧甲基纤维素钠、滤纸和七叶苷,分别测定内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶的酶活力。结果表明,粗酶液对3种底物均具有分解作用,其中降解七叶苷的β-葡萄糖苷酶活力高达155.6 U/mL,降解CMCNa的内切葡聚糖酶活力为107.7 U/mL,降解滤纸的外切葡聚糖酶活力为33.1 U/mL。
2. 4 反应条件对CQNUX 3-1菌株酶活力的影响
2. 4. 1 反应温度对纤维素酶各组分酶活力的影响
取发酵培养2 d后离心收集的上清液作为粗酶液,保持反应pH为7.0,测定不同反应温度对纤维素酶活力的影响,结果(图3-A)表明,温度对纤维素酶各组分酶活力的影响有所不同。其中,β-葡萄糖苷酶最适反应温度为40 ℃,随着反应温度的增加,其酶活力明显下降,但直至温度达80 ℃时仍能保留69%左右的酶活力,约为79.3 U/mL;而外切葡聚糖酶和内切葡聚糖酶受反应温度影响小,其最适温度分别为60和70 ℃。
2. 4. 2 反应pH对纤维素酶各组分酶活力的影响
收集发酵4 d后的粗酶液,在40 ℃的反应条件下测定不同反应pH对酶活力的影响,结果(图3-B)表明,β-葡萄糖苷酶酶活力最高,其最适反应pH为9.0;内切葡聚糖酶最适反应pH为8.0,且在pH达10.0时,仍保留92%的酶活力;外切葡聚糖酶活力受pH影响较低,在pH 7.0~9.0时酶活力相对较高。
2. 4. 3 离子和添加物对纤维素酶各组分酶活力的影响 取发酵培养2 d后离心收集的上清液作为粗酶液,在温度为40 ℃和pH为7.0的条件下,分别配制含有各种离子的反应缓冲液,测定不同离子及添加物对纤维素酶活力的影响,结果(图3-C)表明,Ca2+、Fe3+和Cu2+离子可显著促进内切纤维素酶的活力,K+、Ca2+、Fe3+、Mg2+和Ba2+可增加β-葡萄糖苷酶的活力,仅Fe3+能促进外切葡聚糖酶的活力。可见,Fe3+在CQNUX 3-1菌株纤维素酶的应用过程中可作为极佳的酶活力促进离子。此外,Cu2+对外切葡聚糖酶有显著的抑制作用,另外2种酶则具有良好的Cu2+耐受能力;β-葡萄糖苷酶对EDTA和尿素也具有较好的耐受性。
2. 5 发酵生产条件的优化
2. 5. 1 发酵时间对酶发酵的影响 制备发酵培养基,于37 ℃、150 r/min的恒温摇床上对CQNUX 3-1菌株分别发酵培养2、3、4、5和6 d,离心获得培养上清液作为粗酶液。在pH 7.0、40 ℃条件下反应,测定发酵时间对产纤维素酶各组分酶活力的影响,结果(图4-A)表明,内切葡聚糖酶和β-葡萄糖苷酶在发酵第4 d酶活力最高,缩短或延长发酵时间均使得酶活力明显降低;而外切葡聚糖酶在发酵第2~3 d时酶活力较高,随着发酵时间的延长,酶活力有较小程度的降低。因此,该菌株发酵的最佳时间应控制在4 d。
2. 5. 2 初始pH对酶发酵的影响 使用具有不同初始pH的发酵培养基,于37 ℃、150 r/min的恒温摇床上进行发酵,分析初始pH对酶发酵的影响,结果(图4-B)表明,β-葡萄糖苷酶在发酵初始pH为7.0时的酶活力最高,且在pH 7.0~9.0时酶活力较稳定;而当pH达12.0时酶发酵受到明显影响。外切葡聚糖酶在pH为5.0的条件下酶活力最高,pH 9.0~10.0时的酶活力为最高酶活力的77%,当pH达12.0时酶发酵受到明显抑制。内切葡聚糖酶的活力在发酵pH为5.0时最高,其酶活力受发酵初始pH的影响较小。
2. 5. 3 发酵温度对酶发酵的影响 分别在不同温度下对菌株进行发酵培养4 d,粗酶液在pH 7.0、40 ℃的条件下反应,测定不同发酵温度对纤维素酶各组分酶活力的影响,结果(图4-C)表明,β-葡萄糖苷酶和外切葡聚糖酶的最佳发酵温度为37 ℃,在42 ℃时仍能分别获得90%和66%的酶活力;而内切葡聚糖酶的最适发酵温度为30 ℃,其在37 ℃发酵可保留57%的酶活力。温度低于25 ℃将不利于纤维素的发酵生产。CQNUX 3-1菌株的最佳发酵条件符合工业上通过液体发酵获得纤维素的发酵要求(闫训友等,2004)。
3 讨论
纤维素作为最常见的有机聚合物,被认为是通过生物转化生产不同产品的最重要自然可再生资源(Rajendran et al.,2019),但目前约有80%的纤维素尚未得到充分利用而被废弃,进而引起环境污染等问题(Ragauskas et al.,2006;Illavarasi,2014)。微生物的酶解已被广泛用于降解天然纤维素(Robson and Chambliss,1989),寻求高产纤维素酶生产微生物菌株成为高效降解纤维素的有效方法(Kersten and Cullen,2007)。本研究利用CMCNa平板筛选法,从长期覆盖腐烂枯叶的土壤中筛选获得1株高产碱性纤维素酶的菌株,经鉴定为蜡样芽孢杆菌,命名为B. cereus strain CQNUX 3-1。目前,产纤维素酶微生物的报道包括放线菌、细菌和真菌等,其中放线菌因其产酶量低而研究较少;真菌中的丝状真菌因产酶活力较强而备受关注;而细菌也因为产量不高、产酶组分单一、分泌性差等原因很少在工业中被应用,但细菌因其较快的發酵速度、较低的发酵营养条件要求等也具有较大的应用潜力。尤其是污物纤维素类分解和饲料发酵等环节均在氧含量较低或缺氧的条件下进行,此时厌氧及兼性厌氧型产纤维素酶细菌更具应用价值。出芽孢的细菌因能形成芽孢而对酸、碱和高温环境耐受性较强,具有更高的工业生产应用潜力(吴敏峰等,2006)。因此,具有分泌能力且高产纤维素酶的出芽孢型细菌资源筛选对有效降解纤维素具有重要意义。目前,蜡样芽胞杆菌(Bacillus cereus)已被报道能分泌产生蛋白酶(陈营等,2001)、胶原酶(李晔等,2016)和脂肪酶(韩雪和童攀,2017)等,是胞外酶生产的重要菌种资源。但蜡样芽胞杆菌产纤维素酶的研究较少,已报道的蜡样芽胞杆菌菌株产酶的活力并不高,主要集中在4.95~66.22 U/mL(禤金彩等,2014;汪彬等,2016)。相对而言,CQNUX 3-1菌株具有较佳的纤维素酶生产能力,致使其在纤维素的生物转化过程中具有更佳的应用潜力。
对菌株产生的纤维素酶组分分析结果表明,CQNUX 3-1菌株具有较高的内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶3种酶活力,分别达107.7、33.1和155.6 U/mL。近几年,已报道来自自然界中的纤维素酶生产菌种达200多种(文少白等,2010),其中细菌种类繁多,包括纤维杆菌(Cellulomonas)、纤维粘菌(Cytophaga)及芽孢杆菌(Bacillus)等(刘娣,2008;陈丽燕等,2011),其内切葡聚糖酶(或CMCase)活力为17.08~358.276 U/mL(何楠等,2017;罗奉奉等,2017);而自然菌种经诱变选育后其CMCase活力可达453.2 U/mL(郭建强等,2017)。因此,CQNUX 3-1菌株可作为高产纤维素酶菌种诱变选育的重要候选资源。对纤维素酶系各组分的酶学性质进行分析,结果表明内切葡聚糖酶最适反应温度为70 ℃,最适反应pH为8.0;外切葡聚糖酶最适反应温度为60 ℃,在pH 7.0~9.0时酶活力最高;β-葡萄糖苷酶最适反应温度为40 ℃,最适pH为9.0。目前,已报道的微生物源纤维素酶的最适反应温度主要在45~65 ℃(高蕾蕾和李迎秋,2017),表明CQNUX 3-1菌株的纤维素酶具有较好的酶促反应温度适用性,具有作为优良耐热性碱性纤维素酶酶制剂而被应用的前景。一般认为,纤维素酶的最适反应pH在4.0~5.5(张凤梅,2016),而CQNUX 3-1菌株产生的纤维素酶各组分在碱性条件下均表现出较高的酶活力,暗示其在碱性工业生产过程中具有较好的应用性(Long et al.,2020)。此外,Cu2+只对外切葡聚糖酶有显著抑制作用,对其他2种酶的酶活力则具有良好的Cu2+耐受能力,较其他已报道的菌株具有明显优势(赵玉蓉等,2005;Zhang et al.,2008)。同时发现,β-葡萄糖苷酶对EDTA和尿素有较好的耐受性,表明该纤维素酶在洗涤工业和食品加工业废水处理过程中有较好的应用前景。对菌株发酵条件的优化结果表明,CQNUX 3-1菌株各组分酶的最适发酵温度为30~37 ℃,β-葡萄糖苷酶的最适发酵pH为7.0,内切葡聚糖酶和外切葡聚糖酶的最适发酵pH为5.0,且其在pH 7.0~10.0的碱性条件仍具有较高的发酵酶活力。内切葡聚糖酶和β-葡萄糖苷酶的最适发酵时间为4 d,而外切葡聚糖酶在发酵第2~3 d时的酶活力即达最高值。由此可见,CQNUX 3-1菌株具有较好的发酵耐酸碱性,且在较碱性发酵环境中仍具有较好的产酶能力。CQNUX 3-1菌株发酵产酶温度适中,具有较宽的发酵pH条件适应性,使该菌株能更好地适应工业发酵生产条件,提示其具备应用于农业废弃物生物转化、环境纤维质污染物降解和纤维素资源综合利用等领域的潜力,且可为之提供重要的菌株资源(Sadhu and Maiti,2013)。但本研究对该菌株所生产的纯酶分离与酶活力分析尚待推进,后续研究工作将重点开展CQNUX 3-1菌株所产纤维素酶的分离纯化,并对纯酶的比活力、酶活特性及底物降解产物进行分析,为该菌在工业生产中的应用打下更加全面、坚实的基础。
4 结论
筛选获得的纤维素酶高产菌株B. cereus strain CQNUX 3-1所生产的纤维素酶具有较高的反应温度适用性和较强的碱耐受性,菌株发酵产酶温度适中,且有较宽的发酵pH适用范围,可作为碱性纤维素酶生产资源菌株,具有应用于纤维素酶制剂制备与生产、纤维素资源综合利用等领域的潜力。
参考文献:
陈丽燕,张光祥,黄春萍,熊艳,李敏,常丽梅,张晓喻. 2011. 两株高产纤维素酶细菌的筛选、鉴定及酶学特性[J]. 微生物学通报,38(4):531-538. doi:10.13344/j.microbiol.china.2011.04.017. [Chen L Y,Zhang G X,Huang C P,Xiong Y,Li M,Chang L M,Zhang X Y. 2011. Isolation,identification and enzymatic characteristics of cellulose-producing strains with high cellulase activity[J]. Micro-biology China,38(4):531-538.]
陈营,桂远明,胡光源. 2001. 几种离子及有机物对蜡样芽胞杆菌蛋白酶活力的影响[J]. 中国微生态学杂志,13(3):146-148. doi:10.13381/j.cnki.cjm.2001.03.010. [Chen Y,Gui Y M,Hu G Y. 2001. Effects of some ions and organic compounds on protease activities of Bacillus cereus[J]. Chinese Journal of Microecology,13(3):146-148.]
高凤菊,李春香. 2005. 真菌与细菌纤维素酶研究进展[J]. 唐山师范学院学报,27(2):7-10. doi:10.3969/j.issn.1009-9115.2005.02.003. [Gao F J,Li C X. 2005. Studies on cellulase from Eubacterium and Bacterium[J]. Journal of Tangshan Normal University,27(2):7-10.]
高蕾蕾,李迎秋. 2017. 纤维素酶及其在食品行业中的应用[J]. 食品工业,38(2):271-274. [Gao L L,Li Y Q. 2017. Ce-llulase and its application in food industry[J]. The Food Industry,38(2):271-274.]
郭建强,柴秀娟,庞学兵,裴娟,王爱英. 2017. 芽胞杆菌高产纤维素酶菌株的诱变选育与培养基优化[J]. 核农学报,31(2):263-270. doi:10.11869/j.issn.100-8551.2017.02. 0263. [Guo J Q,Chai X J,Pang X B,Pei J,Wang A Y. 2017. Mutation breeding and medium optimization of Bacillus sp. with high cellulase yielding[J]. Journal of Nuclear Agricultural Sciences,31(2):263-270.]
韩雪,童攀. 2017. 一株产脂肪酶蜡状芽孢杆菌的分离鉴定[J]. 江汉大学学报(自然科学版),45(1):68-71. doi:10. 16389/j.cnki.cn42-1737/n.2017.01.011. [Han X,Tong P. 2017. Isolation of a lipase-producing strain of Bacillus cereus[J]. Journal of Jianghan University(Natural Science Edition),45(1):68-71.]
何楠,令利军,冯蕾,苏敏,姚彦敏,宋雪梅. 2017. 1株产纤维素酶细菌的筛選、鉴定及生长特性[J]. 微生物学杂志,37(1):43-49. doi:10.3969/j.issn.1005-7021.2017.01.007. [He N,Ling L J,Feng L,Su M,Yao Y M,Song X M. 2017. Isolation,identification and growth characteristics of a cellulase-producing bacterium[J]. Journal of Microbiology,37(1):43-49.]
李晔,张西轩,曹广秀,张真,阮海华. 2016. 产胶原酶的蜡样芽胞杆菌发酵条件优化及酶的分离纯化[J]. 微生物学通报,43(7):1419-1428. doi:10.13344/j.microbiol.china.150519. [Li Y,Zhang X X,Cao G X,Zhang Z,Ruan H H. 2016. Fermentation optimization and purification conditions for collagenase from Bacillus cereus[J]. Microbiology China,43(7):1419-1428.]
李正风,朱杰,唐丽,董高峰,吴涛,廖头根,张伟,夏玉珍,王奕权,李岩. 2020. 烟草秸秆中产纤维素酶细菌筛选、鉴定及酶活测定[J]. 西南农业学报,33(3):645-650. doi:10.16213/j.cnki.scjas.2020.3.027. [Li Z F,Zhu J,Tang L,Dong G F,Wu T,Liao T G,Zhang W,Xia Y Z,Wang Y Q,Li Y. 2020. Isolation,identification and cellulase enzyme activity determination of cellulase-producing bacteria from tobacco straw[J]. Southwest China Journal of Agri-cultural Sciences,33(3):645-650.]
刘娣. 2008. 秸秆纤维素高效降解真菌的筛选、鉴定及其纤维素酶基因克隆[D]. 北京:中国农业科学院. [Liu D. 2008. Screening,identification and cloning of cellulase gene of straw cellulose degrading fungi[D]. Beijing:Chinese Aca-demy of Agricultural Sciences.]
刘锁珠,李龙,付冠华,王利红,强巴央宗,李家奎. 2017. 藏猪源高产纤维素酶菌株的筛选及鉴定[J]. 西北农林科技大学学报(自然科学版),45(3):43-50. doi:10.13207/j.cnki.jnwafu.2017.03.007. [Liu S Z,Li L,Fu G H,Wang L H,Qiangba Y Z,Li J K. 2017. Screening and identification of high-yield cellulase degrading bacteria strain from Tibetan pigs[J]. Journal of Northwest A & F University(Natural Science Edition),45(3):43-50.]
罗奉奉,张昌伟,莫亚玲,岑忠用. 2017. 桑园土壤中高产纤维素酶菌株的筛选与鉴定[J]. 福建农业学报,32(4):425-430. doi:10.19303/j.issn.1008-0384.2017.04.014. [Luo F F,Zhang C W,Mo Y L,Cen Z Y. 2017. Screening and identification of high cellulase-producing bacteriafrom soil at mulberry fields[J]. Fujian Journal of Agricultural Scien-ces,32(4):425-430.]
师璐,李阳,李国龙,马昕,顾金刚,李顺意. 2017. 高产纤维素酶枯草芽胞杆菌S-16的筛选及其发酵工艺优化[J]. 生物资源,39(2):118-124. doi:10.14188/j.ajsh.2017.02.007. [Shi L,Li Y,Li G L,Ma X,Gu J G,Li S Y. 2017. Screening of high yield cellulase Bacillus subtilis S-16 and optimization of its fermentation process[J]. Biotic Resources,39(2):118-124.]
汪彬,郭照辉,杜东霞. 2016. 纤维素降解菌的分离、鉴定及其产酶特性研究[J]. 湖南农业科学,(9):7-9. doi:10.16498/j.cnki.hnnykx.2016.09.003. [Wang B,Guo Z H,Du D X. 2016. Research on isolation,identification and enzyme production characterization of cellulose degrading bacteria[J]. Hunan Agricultural Science,(9):7-9.]
文少白,李勤奋,侯宪文,李光义,邓晓. 2010. 微生物降解纤维素的研究概况[J]. 中国农学通报,26(1):231-236. [Wen S B,Li Q F,Hou X W,Li G Y,Deng X. 2010. Recent advances in microbial degradation of cellulose[J]. Chinese Agricultural Science Bulletin,26(1):231-236.]
吴敏峰,耿秀蓉,祝小,潘康成. 2006. 产纤维素酶芽孢杆菌的分离鉴定[J]. 饲料工业,27(20):21-24. doi:10.3969/j.issn.1001-991X.2006.20.007. [Wu M F,Geng X R,Zhu X,Pan K C. 2006. Isolation and identification producing cellulase of Bacillus sp.[J]. Feed Industry,27(20):21-24.]
禤金彩,廖龙,龙寒,何秀苗. 2014. 一株产纤维素酶蜡样芽孢杆菌的分离鉴定及酶学性质初步研究[J]. 南方农业学报,45(6):984-988. doi:10.3969/j:issn.2095-1191.2014.6. 984. [Xuan J C,Liao L,Long H,He X M. 2014. Isolation and identification of Bacillus cereus producing cellulase and enzymatic properties analysis[J]. Journal of Sou-thern Agriculture,45(6):984-988.]
閆训友,史振霞,张惟广,刘志敏. 2004. 纤维素酶在食品工业中的应用进展[J]. 食品工业科技,25(10):140-142. doi:10.3969/j.issn.1002-0306.2004.10.052. [Yan X Y,Shi Z X,Zhang W G,Liu Z M. 2004. Progresses in cellulase and its applications in food industry[J]. Science and Technology of Food Industry,25(10):140-142.]
張凤梅. 2016. 微生物纤维素酶的研究概况及应用前景[J]. 青海畜牧兽医杂志,46(3):48-50. doi:10.3969/j.issn. 1003-7950.2016.03.021. [Zhang F M. 2016. Research over-view and application prospect of microbial cellulase[J]. Chinese Qighai Journal of Animal and Veterinary Sciences,46(3):48-50.]
张纪忠. 1990. 微生物分类学[M]. 上海:复旦大学出版社. [Zhang J Z. 1990. Microbiological taxonomy[M]. Shanghai:Fudan University Press.]
赵君. 2017. 纤维素酶的研究与展望[J]. 中国饲料添加剂,(4):9-10. [Zhao J. 2017. Research and prospect of cellulase[J]. Chinese Feed Additive,(4):9-10.]
赵玉蓉,金宏,陈清华,王红权,沈维军,朱立涛. 2005. 金属离子对纤维素酶及木聚糖酶活性影响的研究[J]. 饲料博览,(1):1-3. doi:10.3969/j.issn.1001-0084.2005.01.001. [Zhao Y R,Jin H,Chen Q H,Wang H Q,Shen W J,Zhu L T. 2005. Effects of metal ions on the activity of feed enzymes[J]. Feed Review,(1):1-3.]
周德庆. 1986. 微生物学实验手册[M]. 上海:上海科学技术出版社. [Zhou D Q. 1986. Microbiology laboratory ma-nual[M]. Shanghai:Shanghai Science and Technology Press.]
Alvarado M,Clemente-Casares P,Moreno D A,De Groot P W. 2020. Micromundo upside down:Targeted searching for antibiotics-producing bacteria from soil with reverse antibiosis approaches[J]. Frontiers in Microbiology,11:577550. doi:10.3389/fmicb.2020.577550.
Awad N E,Kassem H A,Hamed M A,El-Feky A M,Elnaggar M A A,Mahmoud K,Ali M A. 2018. Isolation and characterization of the bioactive metabolites from the soil derived fungus Trichoderma viride[J]. Mycology,9(1):1-11. doi:10.1080/21501203.2017.1423126.
Casta?eda-Cisneros Y E,Mercado Y,Anducho-Reyes M A,?lvarez Cervantes J,Ponce-Lira B,Evangelista-Martínez Z,Téllez A. 2020. Isolation and selection of streptomyces species from semi-arid agricultural soils and their potential as producers of xylanases and cellulases[J]. Cu-rrent Microbiology,77(2):3460-3472. doi:10.1007/s00284- 020-02160-7.
da Silva Delabona P,Pirota R D B,Codima C A,Tremacoldi C R,Rodrigues A,Farinas C S. 2012. Using amazon fo-rest fungi and agricultural residues as a strategy to produce cellulolytic enzymes[J]. Biomass and Bioenergy,37:243-250. doi:10.1016/j.biombioe.2011.12.006.
Eijsink V G,Vaaje-Kolstad G,V?rum K M,Horn S J. 2008. Towards new enzymes for biofuels:Lessons from chiti-nase research[J]. Trends in Biotechnology,26(5):228-235. doi:10.1016/j.tibtech.2008.02.004.
Fischer A J,Maiyuran S,Yaver D S. 2020. Industrial relevance of trichoderma reesei as an enzyme producer[M]//Mach-Aigner A R,Martzy R. Methods in Molecular Bio-logy,New York:Humana Press:23-43.
Gaur R,Tiwari S. 2015. Isolation,production,purification and characterization of an organic-solvent-thermostable alkalophilic cellulase from Bacillus vallismortis RG-07[J]. BMC Biotechnology,15(1):19. doi:10.1186/s12896-015-0129-9.
Gudeta D. 2018. Isolation and characterization of starch degrading rhizobacteria from soil of Jimma University Main Campus,Ethiopia[J]. African Journal of Microbiology Research,12(32):788-795. doi:10.5897/ajmr2018.8873.
Hassan M,Sohail M. 2020. Characterization of cellulases from thermophilic bacilli and their application for the saccharification of sugarcane bagasse[J]. Pakistan Journal of Botany,52(5):1785-1791. doi:10.30848/PJB2020-5(39).
Illavarasi S. 2014. Isolation and identification of cellulase producing bacteria from cow dung[J]. Scrutiny International Research Journal of Microbiology and Bio Techniques,1(1):6-12.
Kersten P,Cullen D. 2007. Extracellular oxidative systems of the lignin-degrading basidiomycete phanerochaete chrysosporium[J]. Fungal Genetics and Biology,44(2):77-87. doi:10.1016/j.fgb.2006.07.007.
Kirstahler P,Gunther M,Grumaz C,Lindemann E,Rupp S,Zibek S,Sohn K. 2015. Draft genome sequence of amantichitinum ursilacus igb-41,a new chitin-degrading bacterium[J]. Microbiology Resource Announcements,3(6):e01309-15. doi:10.1128/genomeA.01309-15.
Koul D,Chander D,Manhas R S,Chaubey A. 2021. Isolation and characterization of serratiopeptidase producing bacteria from mulberry phyllosphere[J]. Current Microbiology,78:351-357. doi:10.1007/s00284-020-02280-0.
Lo C M,Zhang Q,Lee P,Ju L K,2005. Cellulase production by Trichoderma reesei using sawdust hydrolysate[J]. Applied Biochemistry and Biotechnology, 122:561-573.
Long C,Ro?sch C,de Vries S D,Schols H,Venema K. 2020. Cellulase and alkaline treatment improve intestinal microbial degradation of recalcitrant fibers of rapeseed meal in pigs[J]. Journal of Agricultural and Food Chemistry,68(39):11011-11025. doi:10.1021/acs.jafc.0c03618.
Ma Z,Tang J,Lan X,Wen H,Chen Q,Li T,Xu J,Li C,Zhou Z. 2015. Isolation of a thermostable alkaline cellulase-producing bacterium strain from a garbage dump[J]. International Journal of Agriculture and Biology,17(3):625-630. doi:10.17957/IJAB/17.3.13.485.
Mohammadipour Z,Enayatizamir N,Ghezelbash G,Moezzi A. 2020. Bacterial diversity and chemical properties of wheat straw-based compost leachate and screening of cellulase producing bacteria[J]. Waste and Biomass Valorization,12:1293-1302. doi:10.1007/s12649-020-01119-w.
Mojovi? L,Nikoli? S,Rakin M,Vukasinovi? M. 2006. Production of bioethanol from corn meal hydrolyzates[J]. Fuel,85(12-13):1750-1755. doi:10.1016/j.fuel.2006. 01.018.
Peristiwati,Natamihardja Y S,Herlini H,2018. Isolation and identification of cellulolytic bacteria from termites gut (Cryptotermes sp.)[J]. Journal of Physics:Conference Series,1013(1):012173. doi:10.1088/1742-6596/1013/1/012173.
Ragauskas A J,Williams C K,Davison B H,Britovsek G J P,Cairney J,Eckert C A,Frederick W J,Hallett J P,Leak D J,Liotta C L. 2006. The path forward for biofuels and biomaterials[J]. Science,311(5760):484-489. doi:10.1126/ science.1114736.
Rajendran S,Croos A M B,Kapilan R. 2019. Isolation of a cellulase producing Bacillus cereus from cow dung[J]. Journal of the National Science Foundation of Sri Lanka,47(2):261-267. doi:10.4038/jnsfsr.v47i2.9168.
Reddy K V,Vijayalashmi T,Ranjit P,Raju M N. 2018. Characterization of some efficient cellulase producing bacteria isolated from pulp and paper mill effluent contaminated soil[J]. Brazilian Archives of Biology and Technology,60:e17160226. doi:10.1590/1678-4324-2017160226.
Robson L M,Chambliss G H. 1989. Cellulases of bacterial ori-gin[J]. Enzyme and Microbial Technology,11(10):626-644. doi:10.1016/0141-0229(89)90001-X.
Rushabh S,Kajal C,Prittesh P,Amaresan N,Krishnamurthy R. 2020. Isolation,characterization,and optimization of indole acetic acid-producing Providencia species(7MM11)and their effect on tomato(Lycopersicon esculentum) seedlings[J]. Biocatalysis and Agricultural Biotechnology,28:101732. doi:10.1016/j.bcab.2020.101732.
Sadhu S,Maiti T K. 2013. Cellulase production by bacteria:A review[J]. British Microbiology Research Journal,3(3):235-258. doi:10.9734/BMRJ/2013/2367.
Shanmugapriya K,Saravana P,Krishnapriya M M,Mythili A,Joseph S. 2012. Isolation,screening and partial purification of cellulase from cellulase producing bacteria[J]. International Journal of Advanced Biotechnology and Research,3(1):509-514.
Shi Y L,Sun Y,Ruan Z Y,Su J,Yu L Y,Zhang Y Q. 2020. Cellulomonas telluris sp. nov.,an endoglucanase-produ-cing actinobacterium isolated from badain jaran desert sand[J]. International Journal of Systematic and Evolutionary Microbiology,70(1):631-635. doi:10.1099/ijsem.0.0038 06.
Sneath P H A,Mair N S,Sharpe E,Holt J G. 1986. Bergeys manual of systematic bacteriology(volume 2)[M]. Baltimore:Williams and Wilkins Company.
Thamer H A,Pravej A. 2020. Isolation and molecular identifications of cellulase producing bacteria from desert soil[J]. Research Journal of Biotechnology,15(3):72-78.
Ye J,Zhang J,Gao J,Li H,Liang D,Liu R. 2016. Isolation and characterization of atrazine-degrading strain Shewanella sp. YJY4 from cornfield soil[J]. Letters in Applied Microbiology,63(1):45-52. doi:10.1111/lam.12584.
Zhang C,Dai L,Yu H,Bo Z,Jin F. 2008. Purification and characterization of piceid-β-glucosidase from Aspergillus oryzae[J]. Process Biochemistry,42(1):83-88. doi:10. 1016/j.procbio.2006.07.019.
(責任编辑 王 晖)
