电镀软金用硫基无氰金配合物电解质研究进展
2021-07-26阳岸恒裴洪营邓志明李安全
阳岸恒,裴洪营,邓志明,朱 勇,李安全,陈 琳
(贵研铂业股份有限公司 稀贵金属综合利用新技术国家重点实验室,昆明 650106)
金的电沉积技术目前已广泛应用于汽车工业、生物医学过程以及电子信息工业[1-3]。由于其良好的导电性和高耐腐蚀性,金镀层常被用来当作一些被动元件的标准材料。根据用途不同,电镀金通常被划分成硬金和软金[4]。
硬金一般是通过将金与镍、钴、铁等金属硬化剂进行共沉积来得到的[5-6];由于其耐机械磨损和较低的接触电阻,主要用来制造珠宝首饰以及继电器和开关的接触材料[7-8]。软金通常是由含有铊、砷、吡啶和其他化合物的溶液电镀而成[9-10],主要用于对延展性、导电性和纯度要求较高的领域,如光电子器件、高频元件、X射线掩模和焊盘等[11-12],大多通过“掩模”电镀技术来进行镀金[13-14],在此过程中,在基板表面涂覆上光刻胶,并选择性地将金电镀到无电阻区域。当达到目标电镀(通常为 5~30 μm)后,剥去光刻胶掩模,并用湿法蚀刻除去金属电镀基底,通过这种“掩模”电镀技术,可以形成具有高纵横比的小特征,与其他微制造方法,例如剥离或蚀刻[15],相比具有一定的优势。
按配合物种类的不同,可将镀金电解质分为氰化物电解质([Au(CN)2]-)和无氰电解质两大类。虽然氰化物镀金工艺具有稳定性高、操作简单、生产成本低、电流效率高、硬度高等优点[16-17]。但[Au(CN)2]-自身存在着一些缺点:如[Au(CN)2]-中的游离氰化物与微电子工业中使用的阳极光刻胶不相容、氰化物溶液剧毒,都影响了其应用[18-20]。
近年来对非氰镀金工艺的研究越来越多[21-25],其中硫基非氰镀金是一项重要的技术。该技术主要包括亚硫酸盐法[26]、亚硫酸盐-硫代硫酸盐混合法[27]和巯基三唑法[28]等。本文对硫基无氰镀金电解质体系的组成、操作条件、电沉积机理进行总结,分析其优缺点,以期对相关技术发展的趋势和方向提供帮助。
1 金及其配合物的稳定性
金在空气和大多数水溶液中都十分稳定,但当水溶液中存在 CN-、SCN-、SO32-、S2O32-和硫脲(tu)等配体,有适当的氧化剂时,金便会通过与它们形成稳定的配合物而溶于其中[29]。金配合物的水溶液是电沉积金的主要场所,了解这些配合物的特性,尤其是它们的稳定性,是研究电沉积金的基础。
由于金离子在水溶液中不稳定,容易发生歧化反应[2],因此,镀金电解液中的金往往以Au(I)配合物形式存在[29-30]。β被称为累积稳定常数:
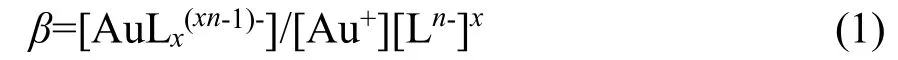
Au(Ⅰ)配合物的累积稳定常数是电沉积金的重要参数(见表1),与配体浓度一起决定了金离子在电沉积过程中能否从配合态被还原[31],因此了解配合物的稳定常数对判断电解液的稳定性十分重要。尽管稳定常数对确定电解液的电化学性质十分重要,但在许多情况下,直接测量稳定常数是不可能的,而近似值是由各种间接方法推导出来的[10,27]。

表1 Au(Ⅰ)配合物的标准稳定常数和标准还原电位Tab.1 The standard stability constants and standard reduction potentials of Au (Ⅰ) complexes[29]
Au(Ⅲ)也能够与C、N、P、S,甚至O等形成稳定的配合物[30]。然而,Au(Ⅲ)配合物远不如相应的Au(Ⅰ)配合物稳定。因此,目前采用Au(III)配合物配制的电解液比较少见[23-24]。
2 亚硫酸金([Au(SO3)2]3-)电解液
2.1 反应机理
早在1842年,人们就已经掌握了使用亚硫酸金盐([Au(SO3)2]3-)镀金的工艺,至今亚硫酸盐仍是合成无氰电解液最常用的金配合物[32-33],图1是采用[Au(SO3)2]3-基电解液制备的不同器件。

图1 [Au(SO3)2]3-镀金圆晶器件的SEM图像 Fig.1 SEM images of [Au(SO3)2]3- gold-plated wafer devices[32-33]
图 1(a)为电镀在铌酸锂晶圆上的金电极,其中金的厚度为35 μm,中间电极在直线区域的宽度为15 μm;图 1(b)为电镀在硅晶圆上的金测试凸点(100×100 μm),金镀层的厚度约为 15 μm。
相比于氰化物,[Au(SO3)2]3-基电解液更容易生产出滑亮、易延展的纯金镀层,且不会出现欠镀现象[34]。这种无氰电解液在微电子和光电子领域同样具有很多优点,例如,它能够令电沉积在硅晶片上的金呈现出更好的厚度均匀性[35]。此外,作为一种无毒的金配合物,处理和处置的标准都要远低于氰化物。
当 pH<7时,[Au(SO3)2]3-会自发的分解成Au+和 SO23-。随后金的沉积通过式(1)进行,SO32-本身也可以通过式(2)分解生成SO2,从而降低电解液的稳定性:

当pH>7时,[Au(SO3)2]3-较为稳定。但大多数光刻胶在碱性环境中并不稳定,会随着电沉积的进行,逐渐溶解于电解液中,从而严重影响镀层的硬度、应力和形貌。因此最好使用可在中性或酸性条件下工作的电解液,以尽量减少光刻胶与其之间的相互作用,从而保持更好的稳定性[36]。
通常来说,只有在过低电位或较高pH值(pH>9)的环境下,[Au(SO3)2]3-配合物才能够直接通过单电子还原得到金镀层,而在pH值较低的环境下,金镀层的形成往往涉及一系列耦合电化学步骤[37],其中,钝化硫膜和吸附物种对金沉积过程十分重要[38]。
[Au(SO3)2]3-基电解液通常是由钠盐或钾盐配制而成的,但也有采用(NH4)3[Au(SO3)2]基电解液的电沉积研究[39]。Green等[40]在研究中证实该电解液同样适用于晶圆电镀方面的应用,如表2所列。即使在没有添加剂且 pH值为 6~7的条件下,由(NH4)3[Au(SO3)2]基电解液得到的镀层同样具有良好的物理性能(例如硬度、应力和粗糙度),且能够实现稳定操作,是传统Na3[Au(SO3)2]基电解液的有效替代品。

表2 (NH4)3[Au(SO3)2]基电解液的组成及操作条件Tab.2 Composition and operating conditions of (NH4)3[Au(SO3)2]based electrolyte[40]
尽管[Au(SO3)2]3-基电解液的历史悠久,但人们对其电沉积的机理依旧存在着一些争议。通常来说,只有在过低电位或较高 pH值(pH>9)的环境下,[Au(SO3)2]3-配合物才能够直接通过单电子还原得到金镀层,而在pH值较低的环境下,金镀层的形成往往涉及一系列耦合电化学步骤[37],其中,钝化硫膜和吸附物种对金沉积过程十分重要[38]。
2.2 成分改变对电解液性能的影响
Morrissey[37]发现同时添加乙二胺和硝基苯,可以通过降低[Au(SO3)2]3-基电解液的pH值,显著的改善它与光刻胶之间的相容性,进而提高其稳定性。溶液中胺-亚硫酸根-金配合物的生成可能是该电解质体系稳定性提高的主要原因。然而,站在环境的角度,使用这类有机添加剂会对电沉积工艺的可持续性造成严重的影响[41]。
此外,学者们还研究了无机金属元素对[Au(SO3)2]3-电解液稳定性的改善。砷(As)元素常被用来充当[Au(SO3)2]3-基电解液中的光亮剂,同时,它对电镀层的硬度、组织和应力都有显著影响[42]。类似地,铊(Tl)元素可以被当作晶粒细化剂添加到电解液中,并通过对电流密度、温度和铊元素浓度的调控,实现在应力几乎为零的条件下进行电沉积金的工艺[9]。虽然,铊和砷的添加能够有效地改善金镀层的拓扑结构,但这些添加剂的毒性较大(铊的致死剂量约为 0.1 mg/m3),导致电解液无法长期循环使用[22]。此外,Watanabe等[43]通过采用含有铈(Ce)离子的[Au(SO3)2]3-基电解液,达到了改善金沉积层的平整度和柔软度,形成微凸点的目的。
3 硫代硫酸金([Au(S2O3)2]3-)电解液
早在1930年代,人们就开发出了[Au(S2O3)2]3-配合物电沉积金工艺[44]。但与[Au(SO3)2]3-基电解液相比,其镀金工艺并没有受到重视。这是由于在中性或弱酸性条件下,电解液中过量的 S2O32-经过质子化后十分容易形成HSO3-和胶体态的硫[44],阻碍了[Au(S2O3)2]3-基电解液的工业发展[45]。随着pH值的进一步降低,HSO3-离子会继续与电解液中的质子结合,形成H2SO3,最终释放出SO2。很明显,以上 2个反应均阻碍了其在金沉积领域的应用[14]。
然而,[Au(S2O3)2]3-配合物在较低的S2O32-浓度和高pH值的环境下较为稳定,稳定常数为1026[46]。Wang等[45]开发出了一种以[Au(S2O3)2]3-和碘化物为配合剂,pH值为9.3的无氰电解液。优化后的电解液在电流密度为 1~5 mA/cm2的条件下,生产出了半光亮、光滑、均匀的金镀层,且电流效率接近100%。此外,Na3[Au(S2O3)2]同样适用于掩模电镀。
Sullivan等[47]研究了[Au(S2O3)2]3-配合物在含有柠檬酸盐缓冲液、过量氯化钾和 pH=6.4的电解液中的还原过程。测定了该配合物的热力学和动力学特性,但并未对镀层的性能以及该方法是否适用于掩模电镀进行评估。此外,作者认为金的沉积是一个通过[Au(S2O3)2]3-配合物直接单电子还原的过程,但其他文献[48]却提出了另外一种机制,即金的沉积是一个[Au(S2O3)2]3-配合物先失去一个 S2O32-配体,随后直接对[Au(S2O3)]-物种进行还原的过程。
4 [Au(SO3)2]3--[Au(S2O3)2]3-混合电解液
4.1 稳定剂的影响
为了进一步提高电解液的稳定性,Alymore等人[46]研究了[Au(SO3)2]3--[Au(S2O3)2]3-混合配合物电解液,图2为以上述混合基电解液作为镀液所获得的金测试结构的 SEM 图像,其中金线的标称宽度分别为6、9和12 μm。图2结果表明,即使不添加任何稳定剂,[Au(SO3)2]3--[Au(S2O3)2]3-混合基电解液同样具有很高的稳定性[49]。而且,这种混合电解液能够在接近中性或弱酸性的条件下使用,有效地改善了其与光刻胶的相容性。此外,电解液中存在的[Au(SO3)2]3-配合物能够将[Au(S2O3)2]3-的分解速率降低,从而大大减小了胶体硫的形成速率,这是混合配体电解液稳定性大幅提高的主要原因[50]。

图2 [Au(SO3)2]3--[Au(S2O3)2]3-混合电解液镀金件的SEM图像Fig.2 SEM image of gold plated sample by using[Au(SO3)2]3--[Au(S2O3)2]3- mixed electrolyte[46]
4.1.1 添加抗坏血酸
Kato等[48]开发出了一种以抗坏血酸为还原剂的[Au(SO3)2]3--[Au(S2O3)2]3-混合基电解液,基本镀液和改进镀液的组成如表3所示。依据混合电势理论,结合金电极上测量的部分极化曲线,Kato探讨了开发这些电解液的可能性。认为[Au(SO3)2]3--[Au(S2O3)2]3-混合配体体系相比于仅使用[Au(S2O3)2]3-或[Au(SO3)2]3-的体系相比,具有更为实用的沉积速率和稳定性。在众多被测试的还原剂中,仅有抗坏血酸、肼和硫脲适合作为电沉积金的还原剂,如图3[48]所示。通过对镀液稳定性、沉积速率和沉积外观的评价,最终选择了抗坏血酸作为[Au(SO3)2]3--[Au(S2O3)2]3-混合镀液的还原剂。
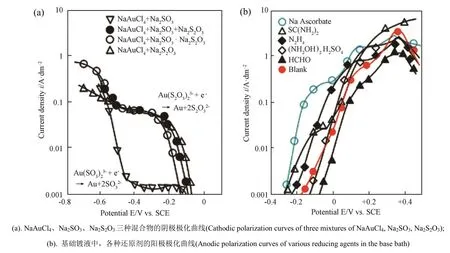
图3 [Au(SO3)2]3--[Au(S2O3)2]3-混合镀液的极化曲线Fig.3 Polarization curve of [Au(SO3)2]3--[Au(S2O3)2]3- mixed bath[48]

表3 抗坏血酸改进的[Au(SO3)2]3--[Au(S2O3)2]3-混合电解液Tab.3 [Au(SO3)2]3--[Au(S2O3)2]3- mixed electrolyte modified by ascorbic acid[48]
4.1.2 添加硫脲
以硫脲作为添加剂的[Au(SO3)2]3--[Au(S2O3)2]3-混合电解液是由日立有限公司的研究人员开发和改进的(见表4)[51]。在电沉积过程中,硫脲会进一步发生反应生成自由基中间体((NH)(NH2)CS),并最终被降解为尿素和双氰胺。(NH)(NH2)CS被认为可以与电解液中的溶解氧反应,并生成甲脒亚磺酸((NH2)2CSO2),这是导致电解液不稳定的主要原因。作为电解液的附加成分,对苯二酚可以在产生(NH2)2CSO2之前迅速与(NH)(NH2)CS发生反应。而且,对苯二酚与(NH)(NH2)CS的反应还能够再一次得到硫脲,因此对苯二酚常常被用来充当硫脲基电解液的稳定剂和回收剂。
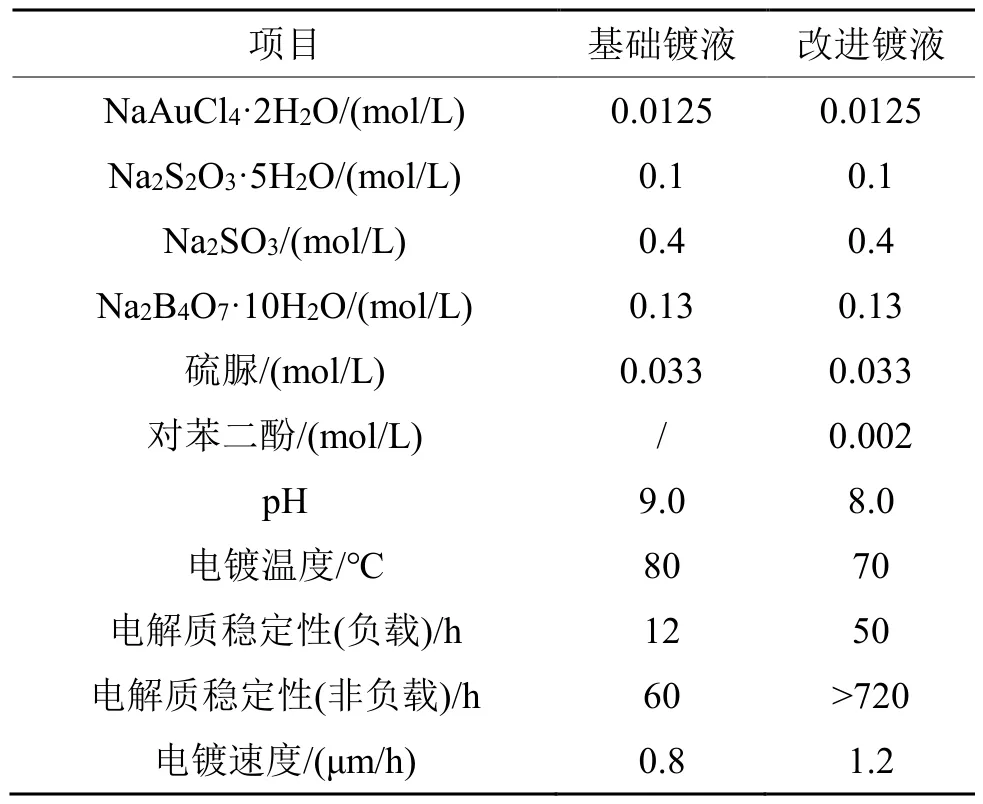
表4 采用硫脲改进的[Au(SO3)2]3--[Au(S2O3)2]3-混合电解液Tab.4 [Au(SO3)2]3--[Au(S2O3)2]3- mixed electrolyte modified with thiourea[51]
4.2 稳定机理
Osaka等[52]研究了从[Au(SO3)2]3--[Au(S2O3)2]3-混合基电解液中将金沉积在硅晶圆上形成微凸点的工艺。该电解液在pH=6,温度为60℃的条件下进行操作时,具有良好的稳定性,不需要添加任何稳定剂来抑制其自发的降解。所沉积的金镀层中含有杂质元素硫,且硬度随硫含量的增加而增加。用燃烧法对金镀层中的硫元素进行分析,结果显示单质硫并非是金镀层中所含硫的形式[14]。此外,在金镀层中硫代硫酸金盐通常以NaAu(S2O3)或Au2S2O3形式存在。如果NaAu(S2O3)是杂质元素硫唯一的存在形式,则理论上金镀层中所含的Na与S的原子比应等于1:2,而在实验中发现该原子比仅为0.1:2。因此,该化合物仅占金镀层中硫总量的10%。即金镀层中包含的大部分杂质硫均以Au2S2O3的形式存在。根据反应(4):
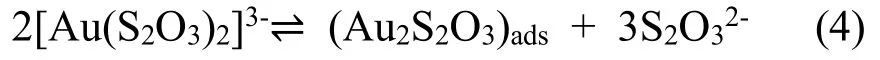
Au2S2O3可能在其中扮演了吸附物种的角色,吸附在了阴极上。随后(Au2S2O3)ads通过电化学还原反应(5):

在阴极上沉积形成了金镀层。根据该反应机理,当电解液中的 S2O32-浓度较低时,反应更倾向于形成(Au2S2O3)ads并吸附在阴极上。但当电解液中的S2O32-浓度很高时,[Au(S2O3)2]3-更倾向于直接通过单电子还原来形成金镀层。因此,电解液中游离的S2O32-浓度越高,金镀层中的含硫量便越少,硬度也会越低[49]。此外,镀层硬度还可以通过使用添加剂或退火来控制。以Tl2SO4的形式引入铊离子作为晶粒细化剂,可降低硬度,改善金镀层的表面形貌[14]。改进后的混合配体电解液可以在中性、低温、稳定的电镀条件下进行软金镀层的沉积。最佳镀金条件下的维氏硬度(HV)约为80,在350℃退火30 min后,维氏硬度下降至50[2]。
Roy[1]发现,Na2SO3在[Au(SO3)2]3--[Au(S2O3)2]3-混合基电解液中起到了酸碱缓冲的作用,维持了电解液的pH值。用滴定管将0.05 mol/L HAuCl4缓慢加入到含有混合配体的电解液中,以避免pH值的快速变化。如果不采用这种方法,电解液的pH值会迅速下降,并沉淀出硫单质,同时释放出 SO2。采用紫外-可见分光光度法分析了混合配体电解液中的金配合物,结果表明,Au(Ⅰ)能够与 S2O32-配合,但并未找到 Au(Ⅰ)与 SO32-配合的证据[14]。
基于这一结果,Liew[53]对该体系的机理提出了另一种看法。认为 Au(Ⅰ)更倾向与稳定常数更高的S2O32-发生配合。与此同时,在中性或弱酸性条件下,[Au(SO3)2]3-可以在电解液中形成高浓度的(HSO3)-,导致式(6):
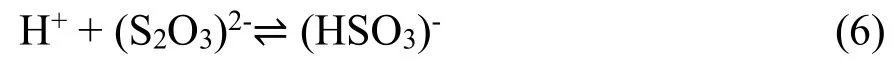
平衡向左移动,进而抑制了单质硫的形成。Au(Ⅰ)通过形成[Au(S2O3)2]3-离子来保持稳定,而过量的HSO3-则避免了硫的沉淀,两种机制相辅相成,有效地改善了电解液的稳定性。Liew等[14]对这种电解液的性能进行了工业测试,结果如表5所列。
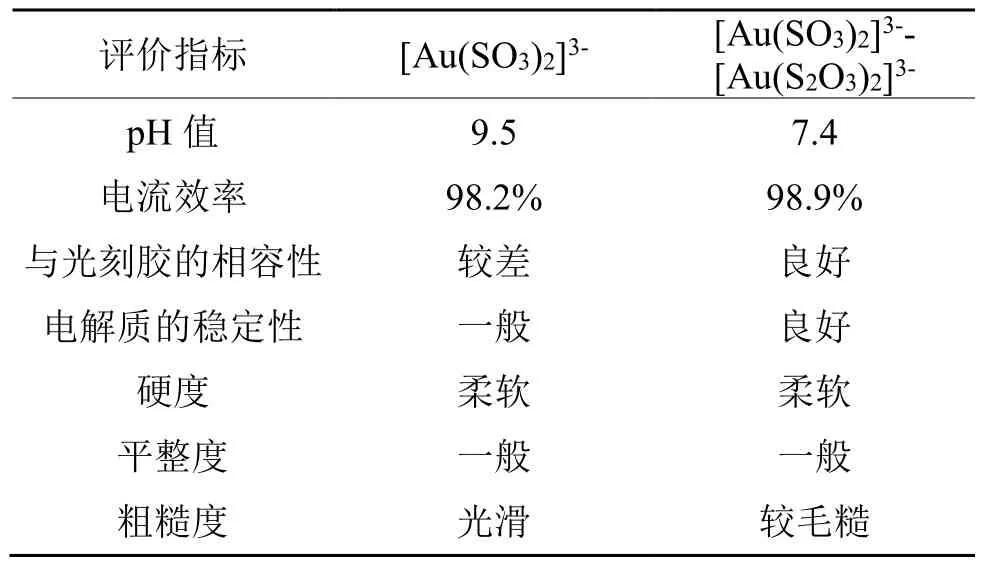
表5 两种电解液工业测试性能比较Tab.5 Comparison of industrial test performance between the two based mixed electrolyte[14]
[Au(SO3)2]3-基电解液一般在电镀过20~25片晶圆片后,便会出现明显的降解现象。但在相同的工艺条件下,[Au(SO3)2]3--[Au(S2O3)2]3-混合基电解液在沉积过30片晶圆片后也未发生明显的降解现象,且在整个电沉积过程中,电解液始终保持无色透明,接近中性(pH=7.4)时没有沉淀的迹象。电镀结束后,通过检查每片晶圆片是否有溶解、开裂或光刻胶脱层的迹象,发现在[Au(SO3)2]3--[Au(S2O3)2]3-混合基电解液中电沉积后,晶圆片上的光刻胶并没有明显的物理变化,该结果说明该电解液与光刻胶之间具有良好的相容性。随后,采用重量法测定了金镀层的电流效率,平均电流效率为 98.9%,略高于[Au(SO3)2]3-基电解液。在 3种不同的电流密度下,[Au(SO3)2]3--[Au(S2O3)2]3-混合基电解液所获得的镀层硬度值为 73~94,比[Au(SO3)2]3-基电镀层的硬度(99~125)低一些。混合电解液所沉积的金镀层的粗糙度在 200~250 nm之间,高于[Au(SO3)2]3-基镀层的平均粗糙度。此外,对金镀层的厚度均匀性和电镀结构的应力也进行了研究,发现其能够满足大多数微电子和光电子应用的要求。
[Au(SO3)2]3--[Au(S2O3)2]3-基混合电解质相比于氰化物电解质同样具有一定的优势(见表6)。从硬度以及与光刻胶兼容性的角度来看,混合电解质更加适用于软金电沉积的过程。
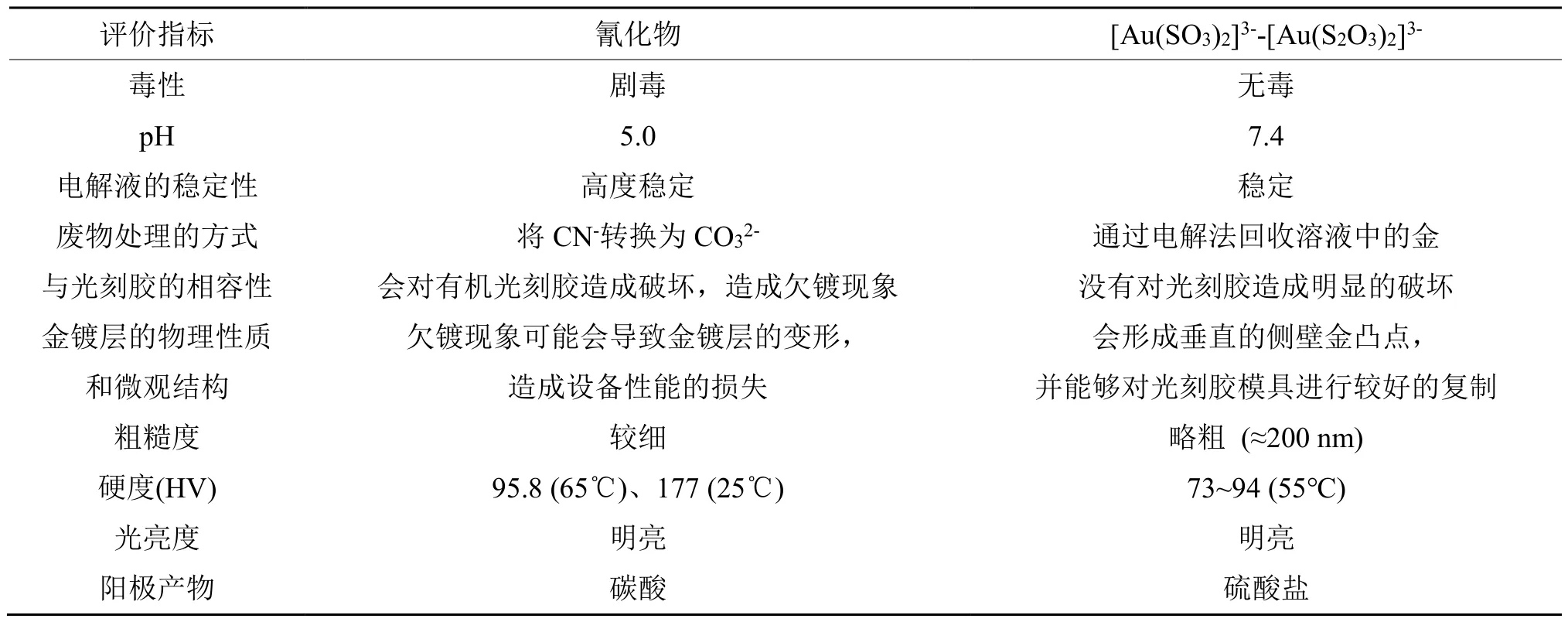
表6 用于软金沉积的氰化物与[Au(SO3)2]3--[Au(S2O3)2]3-基镀金电解液的比较Tab.6 Comparison of cyanide with [Au(SO3)2]3--[Au(S2O3)2]3- based gold plating electrolyte for soft gold deposition[14]
5 其他类型的硫基电解液
5.1 [Au(SO3)2(NO2)]4-基电解液
1970年代末,Hydes等[54]开发了一种基于硝基-亚硫酸金盐([Au(SO3)2(NO2)]4-)配合物的无氰电解液的配制方法。该电解液被认为比传统的[Au(SO3)2]3-基电解液更加稳定。研究结果表明,[Au(SO3)2(NO2)]4-基电解液拥有较高的电流效率(>90%)和均镀性能,可用于沉积厚度较大、光滑、低应力、硬度较低的金镀层。然而,这种电解液并没有在微电子、光电或微系统中得到广泛的应用。
5.2 巯基烷基磺酸配体基电解液
Kimble等[55]还开发了以金(Ⅰ)和巯基烷基磺酸配体(2-巯基乙醇酸(MES)、3-巯基丙酸(MPS)、2,3-二巯基丙基磺酸(DMPS))为基础的镀金电解液。通过与相关金硫醇配合物[56]比较发现,[Au(MES)2]2-和[Au(MPS)2]2-的稳定常数,与[Au(SO3)2]3-和[Au(S2O3)2]3-配合物的稳定常数相当,但要低于氰化物。DMPS和 Au(Ⅰ)也能够形成稳定常数为 logβ=45.5的配合物。这些电解液具有无毒等优点,但其电流效率相对较低(< 40%)。所得到的金镀层光滑且有韧性,但还未对它们在掩模电镀中的适用性进行研究。
5.3 巯基三唑配体基电解液
一些学者对以巯基三唑为基础的电解液进行了研究[28,57-58]。在9个月的稳定性测试实验中,电解液中的金元素并没有明显的降解和沉淀迹象。巯基三唑基电解液的极限电流密度随电解液中的金离子浓度的增加而增加,且其极限电流密度值要低于氰化物。结果(表7)表明,由巯基三唑有机配合物所获得的金沉积层的质量完全可以满足行业要求,其中电流密度对镀层外观和厚度的影响远低于传统的氰化物。这种电解质最引人注目的优点是环保可持续性,即使当电解液中的硫元素发生沉淀,也可以通过简单的加入过氧化氢来对其进行再生。
6 结语
在过去的很长一段时间里,以 KAu(CN)2为代表的传统镀金电解液在电子工业的各种应用中发挥了重要的作用。近年来,对于氰化物电解质体系的质疑声越来越多,这不仅是由于人们对使用有毒物质的意识逐渐提高,而且氰化物与用于高密度电路封装的光刻胶以及其他材料同样存在不相容的现象。硫基无氰电解液作为一种替代得到了研究和应用。

表 7 用于软金沉积的氰化物与巯基三唑配体基镀金电解液的比较Tab.7 Comparison of cyanide and mercaptotriazole ligand-based gold plating electrolyte for soft gold deposition[57]
采用[Au(SO3)2]3-或[Au(S2O3)2]3-作为金的无氰电解质可用于软金的电镀,但这些化合物在单独使用时稳定性较差。含有[Au(S2O3)2]3--[Au(SO3)2]3-的混合配体体系比单独的[Au(SO3)2]3-和[Au(S2O3)2]3-更加稳定。基于[Au(SO3)2(NO2)]4-、[Au(MES)2]2-、[Au(MPS)2]2-、[Au(DMPS)2]2-配体的电解液体系也能够用来沉积软金,但这些镀液体系并没有在微电子、光电或微系统中得到广泛的应用。以巯基三唑配体为基础制备的电解液体系完全能够满足装饰金镀层的质量要求,电流密度对镀层外观和厚度的影响也要低于传统的氰化物镀液。
未来基于无氰配体电解液的软金电镀技术的研究趋势和发展方向应集中于设计和开发新型的配合物和添加剂,同时要对基于无氰配体电解液电镀过程中的机理进行深入的研究,因为它不仅能够说明镀液组分和添加剂的作用,而且还可以促进基于无氰配体电解液的软金电镀技术的发展。
