PDA@Ag纳米复合材料的制备及抑菌性能研究
2021-07-26解修超兰阿峰刘二奴郭少波邓百万
解修超,兰阿峰,刘二奴,郭少波,邓百万
(1. 陕西理工大学 生物科学与工程学院,陕西 汉中 723000;2. 陕西理工大学 化学与环境科学学院,陕西 汉中 723000)
抗生素作为重要的杀菌剂,具有杀菌性能高、靶向性能强、副作用小等优点被广泛应用在医药和临床领域[1]。抗生素的开发难度大、经济效益低、更新周期长,限制了抗生素的发展[1-3]。但环境的改变、抗生素的泛滥使用,会导致细菌的 DNA碱基排列发生改变。细菌通过调节自身多机制适应和产生特异蛋白,抵抗抗生素的靶向结合,或产生灭活酶直接破坏抗生素,从而产生大量的抗药菌甚至“超级耐药菌”[1-2],人类有可能陷入无药可用的时代。
无机金属抗菌剂如纳米金、银、钯、铂、汞等都具有一定的杀菌性[1-5],并对细菌造成不可修复的损伤,其中纳米银由于抑菌性能高,成本低廉、抑菌持久、对人体几乎无毒、广谱抑菌等优点成为理想的杀菌剂被广泛应用在医疗和医药行业[3,5]。大多数纳米银系抑菌剂抑菌机理为:纳米银释放出银离子(Ag+),Ag+和细菌细胞器中的蛋白质、核酸等结合使发生不可逆变性而使细菌死亡;或纳米银粒子进入细胞内,和细胞质作用生成活性氧簇(ROS),ROS极其不稳定[5],对大多数细菌的细胞器都具有很强的破坏性,对细菌造成不可修复的损伤。理论上说,纳米银粒子半径越小,抑菌性能越强。这是因为细菌细胞壁都具有网状结构的肽聚糖[6-9],银粒径越小,表面能越大,和细菌细胞壁接触面积越大,释放出来的 Ag+越能渗透细菌细胞壁致使细菌死亡[9]但银粒径越小越易团聚,又会降低银的抑菌性能。
一种有效的解决方法是将纳米银负载在比表面积较大的亚微球上来克服银团聚问题[1,10],用特异载体的还原性合成银系核壳型复合材料。Abadikhah等[11]将纳米银负载在氧化石墨烯@二氧化钛表面,合成 GO@TiO2@Ag,研究其对革兰氏阴性菌大肠杆菌(E. coli)的抑菌活性,结果表明该材料相比单质银抑菌率可提高至 90%以上;Kooti等[12]合成了CoFe2O4@SiO2@Ag复合材料,在对E. coli和革兰氏阳性菌金黄色葡萄球菌(S. aureus)的抑菌活性中,明显提高了银的抑菌性能。这说明将银负载在有机/无机亚微球上能提高银的抑菌效率,但在制备过程中需用还原剂把纳米银负载在亚微球表面,纳米银容易脱落,且多数还原剂有一定毒性。
多巴胺(DPA)具有良好的生物相容性,对人体无毒,自身多羟基具有一定的还原性,可以将Ag+还原成Ag0制备PDA@Ag复合材料[13-14]。本文以多巴胺为原料,通过自聚合制备聚多巴胺亚微球,以原位还原的方式在其表面负载纳米银,并与化学方法制备的纳米银作对比,采用多种手段对产物进行表征,研究其对S. aureus和E. coli的抑菌性能,探讨其抑菌机制。
1 实验部分
1.1 试剂和设备
1) 试剂。三羟甲基氨基甲烷,分析纯,天津市大茂化学试剂厂;异丙醇,分析纯,天津市致远化学试剂有限公司;多巴胺,试剂纯,抗坏血酸,分析纯,均为上海凛恩科技发展有限公司;硝酸银与氯化钠,分析纯,广州市鑫铂化工有限公司;氨水(25%),分析纯,天津市致远化学试剂有限公司;酵母浸粉、胰蛋白胨和琼脂,分析纯,上海展云化工有限公司;大肠杆菌和金黄色葡萄球菌均由陕西省食用菌研究所提供。
2) 主要设备。X射线衍射仪(XRD,德国Bruker公司 D8 Advance);透射电子显微镜(TEM,日本JEOL公司JEM 2010F);双光束紫外可见分光光度计(UV-Vis,岛津公司UV-1900i);X射线光电子能谱仪(XPS,日本Ulvac-Phi公司PHI Quantera II);热失重仪(TGA,北京恒久科技有限公司TGA-2)。
1.2 材料制备
1) 原位还原法制备 PDA@Ag纳米复合材料。取122 mg三羟甲基氨基甲烷分散在100 mL异丙醇中,超声分散均匀,加入250 mL的超纯水搅拌10 min;加入375 mg多巴胺,搅拌36 h后得到PDA亚微球。用去离子水5000 r/min离心洗涤3次,60℃烘干备用。取0.425 g硝酸银均匀分散在50 mL超纯水中,滴加氨水配成银氨溶液,均匀分散在上述制备的100 mg PDA干燥的固体亚微球中搅拌1.5 h得到PDA@Ag复合材料[13]。
2) 纳米银的制备[15]。称取85 mg PVP加入到20 mL蒸馏水中,超声分散均匀;加入85 mg AgNO3搅拌20 min,分散均匀后加入200 µL 5 mol/L NaCl溶液,在黑暗环境中搅拌20 min,合成AgCl胶体。取160 mL 0.05 mol/L抗坏血酸溶液加到250 mL锥形瓶中,逐滴加入22 mL 0.5 mol/L NaOH溶液,搅拌10 min;加入AgCl溶胶,黑暗环境中反应2 h,去离子水在高速离心机15000 r/min离心洗涤3次,把固体产物纳米银颗粒储存于真空干燥箱备用。
1.3 表征
将PDA-Ag样品直接压片,用XRD测试产物的XRD图谱,选用Cu靶的Ka射线,工作电压40 kV,工作电流 40 mA,扫描(2θ)角度 10°~90°,步长0.017°/s;用热失重仪测试样品的耐热性能,称量0.5 mg 左右样品,测试温度范围为30~700℃,升温速率为10℃/min;用TEM观察样品的形貌,样品在乙醇溶液中均匀分散,在铜网上滴入两滴悬浮溶液进行干燥处理,加速电压为200 kV,最大放大倍数为1500 k。
LB固体培养基的制备:胰蛋白胨10 g,酵母浸粉5 g,氯化钠10 g,琼脂18 g(液体培养基不需要琼脂)分散在1000 mL水中,在高温灭菌锅中121℃灭菌20 min,在超净工作台中倒平板备用。
细菌活化:在-80℃的冰箱中取出储存菌,消融后在固体培养基中划线,在生化培养箱中37℃培养12 h,挑出单菌落在超净工作台中放置于液体LB培养基中,摇床中37℃培养12 h。
1.4 抑菌实验
1) 菌悬液制备。选用S. aureus和E. coli为模式菌,使用前隔夜活化。将稀释在灭菌的蒸馏水中配成不同浓度,用无菌的生理盐水把活化好的菌悬液稀释到5×105CFU/mL。
2) 滤纸片扩散法(平行 3组)。在无菌环境下,首先取50 µL菌悬液均匀涂布在灭过菌的LB固体培养基上,其次用沾有 3 µL (含有不同浓度的PDA@Ag纳米复合材料或纳米银材料)样品的无菌滤纸片(直径7 mm),放置在LB培养基上,37℃培养12 h观察结果[16]。
3) 最小抑菌浓度法(MIC,平行3组)。在无菌环境下,把灭过菌的液体培养基、50 µL菌悬液和不同梯度浓度的 PDA@Ag纳米复合材料或纳米银材料分散在3 mL试管中,放置于灭过菌的试管中,37℃培养12 h[17],观察结果。
2 结果和讨论
2.1 材料的表征
2.1.1 TEM形貌观察
制备得到的几种材料的TEM图像如图1(a)~1(e)所示。从图1(a)可知PDA为球形,表面光滑,粒径930±10 nm。从图1(b~c)可见,采用原位还原法制备的PDA@Ag为核壳型结构,直径为980±10 nm,负载厚度约25 nm;负载的银为颗粒状结构,且均匀地负载在PDA表面,银的粒径为25±5 nm,未发生明显团聚。从图1(d~e)可见,用化学方法制备的单质银粒径为20±5 nm,此方法可通过改变NaOH的量而改变银粒径大小[15];银粒径越小表面能越大,越易团聚,由图可见银明显发生了团聚。通过对比可以确认,把纳米银负载在比表面积较大的PDA亚微球表面形成了核壳结构的PDA@Ag,既可以防止纳米银的团聚,且在使用后容易分离和再生利用。

图1 PDA (a)、PDA@Ag (b~c)和纳米银(d~e)样品的透射电镜图像Fig.1 TEM images of PDA (a), PDA@Ag (b~c) and nano-Ag (d~e) samples
2.1.2 XRD结构表征
图 2 为 PDA(a)、Ag(b)和 PDA@Ag(c)的 XRD图谱。图2中PDA在2θ= 21°有明显的衍射宽峰,对应非晶 PDA[18]。纳米银的 37.9°、44.1°、64.3°和77.2°处的衍射峰分别对应面心立方结构银(JCPDS4-0783)的(111)、(200)、(220)和(311)衍射晶面[15],证明化学方法合成的银为单质银。PDA@Ag的图谱中同时含有 PDA和单质银的衍射峰,且和非晶的PDA单质银的衍射峰重合;结合TEM图像(图1),证明PDA@Ag核壳结构是单质银负载在非晶PDA表面。

图2 PDA、Ag和PDA@Ag的XRD图谱Fig.2 XRD patterns of PDA, Ag and PDA@Ag samples
2.1.3 X射线光电子能谱(XPS)分析
图3为PDA@Ag的银元素的高分辨XPS。图3中368.27和374.22 eV出现的谱峰分别对应金属银的Ag3d5/2和Ag3d3/2的结合能,且两峰之间差6 eV[19],说明银以单质的形式存在于复合材料PDA@Ag中。在制备过程中,多巴胺首先自聚合成球状 PDA;PDA表面暴露出的大量酚羟基和氨基通过吸附配位作用将Ag+聚集在PDA表面[20];官能团多酚羟基在溶液介质中具有一定的还原性,可把Ag+还原成Ag0形成O-Ag键而稳定的存在PDA表面。方法将纳米粒子银负载在PDA表面,比还原剂负载法合成的复合材料结合更牢靠,也无需引入额外的还原剂,操作简单,绿色环保。
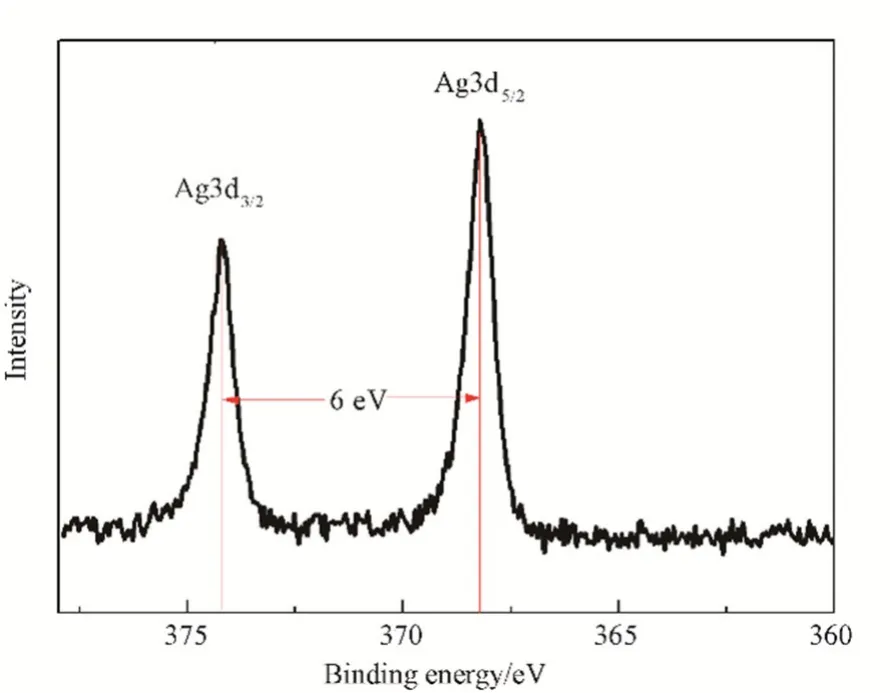
图3 PDA@Ag中Ag3d的XPS图谱Fig.3 XPS spectrum of Ag3d of PDA@Ag samples
2.1.4 紫外-可见漫散射(UV-Vis DRS)光谱分析
图4为烘干后固体样品的UV-Vis漫散射光谱。由图4可见,PDA没有特征吸峰;纳米银在400~420 nm有强烈的吸收峰,410 nm处的特征吸收峰与文献[15]报道一致,证明化学方法合成的银为单质;PDA@Ag在420 nm处具有强的吸收峰,和单质银相比峰位置发生偏移。这是因为银负载在有机体(PDA)表面,发生等离子共振而引起红移[21],通过此紫外漫反射光谱也可以证明单质银负载在 PDA表面。

图4 PDA@Ag中Ag3d的UV-Vis吸收光谱Fig.4 UV-Vis patterns of PDA, Ag and PDA@Ag samples
2.1.5 热重(TGA)分析
图5为PDA和PDA@Ag在氧气气氛中的TGA曲线。从图5可以看出,PDA有机亚微球从100℃开始缓慢分解,在 300℃速率加快,表明 PDA在300℃分解加快,677℃之后保持稳定,最终失重率为95%。PDA@Ag同样在300℃分解速率加快,但到450℃之后就保持稳定,失重率为 35%。2种材料的稳定性不一致,其可能的原因为,银通过原位还原法负载在PDA表面,部分银可与酚羟基中的O形成Ag-O键而增加了材料稳定性,具体机理有待进一步研究。
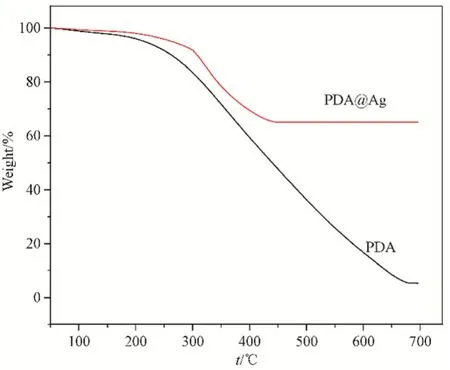
图5 PDA和PDA@Ag的TGA曲线Fig.5 TGA curve of PDA and PDA@Ag samples
结合本节TEM、XRD、XPS和UV-Vis等表征结果,表明银单质负载在 PDA表面,负载率(mAg/mPDA)为60%。
2.2 抑菌性能对比
分别以S. aureus和E. coli为模式菌,用滤纸片扩散法和MIC法进行抑菌活性对比实验。经37℃培养 12 h,对比研究不同浓度的 PDA、纳米银和PDA@Ag的抑菌性能。图6为滤纸片扩散法所得图片,图7为MIC法所得图片。

图6 不同介质材料对S. aureus (a)和E. coli (b)抑菌实验(37℃,12 h)滤纸片扩散照片Fig.6 Inhibition zones of the different dielectric materials against S. aureus (a) and E. coli (b) (37℃, 12 h) in bacteriostatic experiment

图7 PDA@Ag对S. aureus (a)和E. coli (b)的MIC照片Fig.7 MIC picture of the as-synthesized PDA@Ag composites against S. aureus (a) and E. coli (b)
由图6可知,PDA周围没有透明的抑菌圈,说明没有抑菌性,在最低浓度20 mg/mL时,单质银和PDA@Ag对S. aureus和E. coli周围都有透明的抑菌圈,证明单质银和PDA@Ag都具有抑菌活性,当增加材料浓度时,抑菌圈直径逐渐增大,可知单质银和 PDA@Ag的抑菌活性随材料浓度增大而增强。同浓度下比较材料对S. aureus和E. coli抑菌活性,银和PDA@Ag对E. coli的抑菌圈比S. aureus的更大,说明银和PDA@Ag对E. coli的抑菌活性更强,在相同浓度和菌种下,PDA@Ag的抑菌圈比银更大,证明 PDA@Ag的抑菌性能比银更强;这是由于单质银纳米粒子在介质中易发生团聚导致活性表面积减小,降低了单质银的抑菌性能。
从图7可以看出,在PDA@Ag的浓度分别为2和1 µg/mL时,装有S. aureus和E. coli的溶液微澄清。说明PDA@Ag对S. aureus和E. coli的最小抑菌浓度(MIC)分别约为 2和 1 µg/mL,E. coli对PDA@Ag更为敏感。这主要是因为E. coli和S.aureus的细胞壁不同,S. aureus细胞壁中含有大量的磷脂双分子层和少量的蛋白质,而E. coli含有少量的磷脂双分子和大量的蛋白质。
PDA@Ag的抑菌机理如图 8示意。PDA@Ag在介质中释放出Ag+,Ag+被细菌吸附在细胞壁的表面(S. aureus和E. coli的细胞壁上的磷壁酸和脂多糖都带负电荷)[22]。部分Ag+通过自由扩散渗透细胞壁中的磷脂双分子层进入细菌内部,或结合转运蛋白和离子通道蛋白使之变性,从而让细菌失去主动运输营养或离子选择的功能,蛋白失活而使Ag和Ag+进入细菌内部。在渗透和结合蛋白质过程中,Ag+很难渗透含有大量磷脂双分子层的S. aureus,但更容易和E. coli细胞壁中大量蛋白质中含巯基(-SH)的蛋白质结合而使细菌细胞壁受损[23]。因此,Ag+更容易进入E. coli细菌内部,所以对E. coli更为敏感。

图8 PDA@Ag对金黄色葡萄球菌和大肠杆菌的抑菌机理Fig. 8 Antibacterial mechanism of the PDA@Ag to S. aureus and E. coli bacteria
此外,大量的Ag和Ag+进入细胞后,与细胞质反应生成活性氧簇(ROS),生成的ROS极其不稳定,且具有强氧化性,可以破坏细菌合成细胞壁和细胞膜所需的蛋白质、活性酶和呼吸链等,使细菌无法进行正常的新陈代谢(需氧细菌内一般含有超氧化物歧化酶(SOD)可以清除微量自由基,但SOD中含有的半胱氨酸和Ag+发生不可逆结合使SOD失活)。当 Ag和 Ag+大量进入细菌内部,和细菌细胞质结合导致细菌内外渗透压改变,且Ag+和核酸DNA中含-SH的氨基酸反应,使细菌DNA一级结构发生改变而使细菌 DNA发生不可逆变性,影响细菌正常的转录和翻译,从根本上致使细菌死亡[24]。因此纳米银对大多数细菌、真菌、放线菌和病毒都具有强的杀菌性且不会产生抗药性。
3 结论
1) 制备实验表明:以多巴胺(DPA)为原料合成聚多巴胺微球,利用其氨基和羟基将 Ag+吸附在亚微球表面,通过羟基把 Ag+还原成单质银原位负载在微球表面制备PDA@Ag,无需额外的还原性,绿色环保。
2) 表征结果显示:制备的PDA@Ag为球型核壳结构,具有良好的单分散性,粒径约为980±10 nm,厚度约为25 nm,且负载的纳米银为单质,负载率约为60%。
3) 抑菌活性实验结果表明:在抑菌活性实验中可知,银和PDA@Ag对S. aureus和E. coli都具有抑菌性,同浓度下,银和PDA@Ag对E. coli的抑菌性更强,同菌同浓度下,PDA@Ag的抑菌性能明显要比单质银的性能强。通过MIC法,进一步证明PDA@Ag对革兰氏阴性菌E. coli更为敏感。因此,PDA@Ag具有良好的抑菌性能可应用于污水处理和医疗器械等领域。
4) 机理探讨认为:PDA@Ag在溶液中会释放Ag+,细菌细胞壁表面的负电荷可吸附Ag+,Ag+通过细胞壁进入细菌内部破坏离子通道蛋白,与细菌细胞器中的含-SH的氨基酸结合改变蛋白质二级结构致使其死亡,或微量的纳米Ag进入细菌内部和细胞质作用生成活性氧簇ROS,ROS可对细菌细胞器造成根本性破坏其结果诱使细菌死亡,而PDA@Ag对E. coli抑菌性更强的原因是纳米银很难穿透含有大量磷脂双分子层的S. aureus,但更易和含有大量蛋白质的E. coli作用,因此其对E. coli更为敏感。
