乳腺癌超声特征与免疫组化指标的相关性
2021-07-21曹玉文张海俊李巧莉石丽楠张晓梅石河子大学医学院第一附属医院超声科新疆石河子8008国家卫健委中亚高发病防治重点实验室新线石河子8008石河子大学医学院病理教研室新疆石河子8008
桑 田,刘 文,黄 磊,曹玉文,张海俊,李巧莉,石丽楠,张晓梅,李 军,石河子大学医学院第一附属医院超声科,新疆 石河子 8008;国家卫健委中亚高发病防治重点实验室,新线 石河子 8008;石河子大学医学院病理教研室,新疆 石河子8008
乳腺癌的发病率及病死率持续上升,严重威胁女性的身心健康[1]。超声检查是早期诊断乳腺癌的重要方法。近年来,超声医学进入了分子影像学的新时代[2],乳腺癌肿块的预后与其生物学指标之间的关系受到了越来越多学者的重视[3-5]。其中,免疫组化指标如雌激素受体(ER)、孕激素受体(PR)、增殖细胞核抗原(Ki-67)、人表皮生长因子受体(HER-2)是乳腺癌研究中较为重要的病理学指标[6]。既往研究多只选择了某单一类型乳腺癌的部分超声特征及个别病理指标进行分析,且样本量较小,因此结论具有局限性[7-9]。本研究通过分析我院7年710例乳腺癌患者的超声特征及免疫组化指标,拟以无创超声检查直接或间接反映乳腺癌肿块的组织病理学改变,探讨超声特征与免疫组化的相关性,以期为术前评估肿块性质及临床治疗提供有力的参考信息。
1 资料与方法
1.1 一般资料
回顾性收集2014年1月~2020年5月于我院行手术切除并经病理证实的710例女性乳腺癌肿块,术前均行常规超声检查,术后均行免疫组化指标(ER、PR、HER-2、Ki-67)检测。纳入标准:18~80岁女性乳腺癌患者;患者本人同意加入本次研究;所有患者均可在工作站获得乳腺肿块超声图像资料;所有患者均行乳腺肿块切除术,对结节明确病理诊断并获得免疫组化指标表达情况。排除标准:不愿意参加该课题实施的乳腺癌患者;患者临床资料不全,缺乏必要的超声检查资料;患者未获取明确病理学诊断结果;患者既往有乳腺肿块切除史或乳腺癌化疗史;严重脏器功能障碍、合并其他肿瘤或乳腺癌复发的患者。710 例患者年龄26~77(53.3±10.4)岁,肿块最大径范围0.4~13.5(2.2±1.1)cm。
1.2 仪器和方法
采用LOGIQ 9型超声诊断仪(GE)(高频线阵探头7~10 MHz)及S3000超声诊断仪(西门子)(高频线阵探头9 MHz)。检查时患者取仰卧位及半侧卧位,依次对双侧乳腺及腋窝区域进行扫查,发现肿块时记录肿块直径(≤2 cm、>2 cm)、位置(内上、内下、外上、外下、乳晕区)、纵横比(>1、≤1)、内部回声(均匀、不均匀)、后方回声(衰减或消失、未衰减)、边界(清晰、不清晰)、边缘(光整、不光整)、形状(规则,不规则)、钙化(有、无),Alder血流分级(0~l级、2~3级)及有无腋窝淋巴结转移。
1.3 免疫组化检测
肿块标本检测采用罗氏全自动免疫组化仪,ER、PR的判断以细胞核出现棕黄色颗粒的着色细胞数≥1%为阳性[10],HER-2的表达以肿瘤细胞膜中出现棕色颗粒作为阳性细胞,分成4 个等级:0、+、++、+++,0 和+为阴性,+++为阳性,++者需进一步结合FISH技术双探针检测,存在HER-2基因扩增者为阳性,无扩增者为阴性[11]。Ki-67结果的判读以细胞核出现棕黄色颗粒的着色细胞数≥14%为高表达,<14%为低表达[12]。
1.4 统计学分析
采用SPSS22.0软件进行统计分析,计数资料以n(%)表示,组间比较采用χ2检验,应用Spearman轶相关检验进行相关分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 乳腺癌病理类型分布及超声特征表现
本研究710例乳腺癌肿块中,占比最高的为浸润性导管癌(n=565,75.6%),其次为导管原位癌(n=74,10.4%,表1)。肿块最大径>2 cm者314例,最常见发病位置为外上象限(n=346),内部回声不均匀650例,后方回声衰减或消失485例,边界不清晰527例,边缘不光整686例,形状不规则674例,有钙化305例,Alder血流分级2~3级324例,腋窝淋巴结发生转移256例(图1~2)。
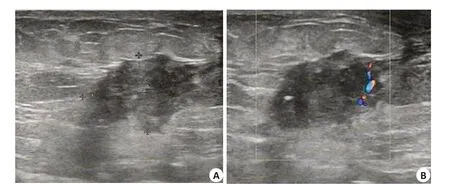
图1 患者女,58岁,浸润性导管癌Fig.1 A 58-year-old woman with invasive ductal carcinoma
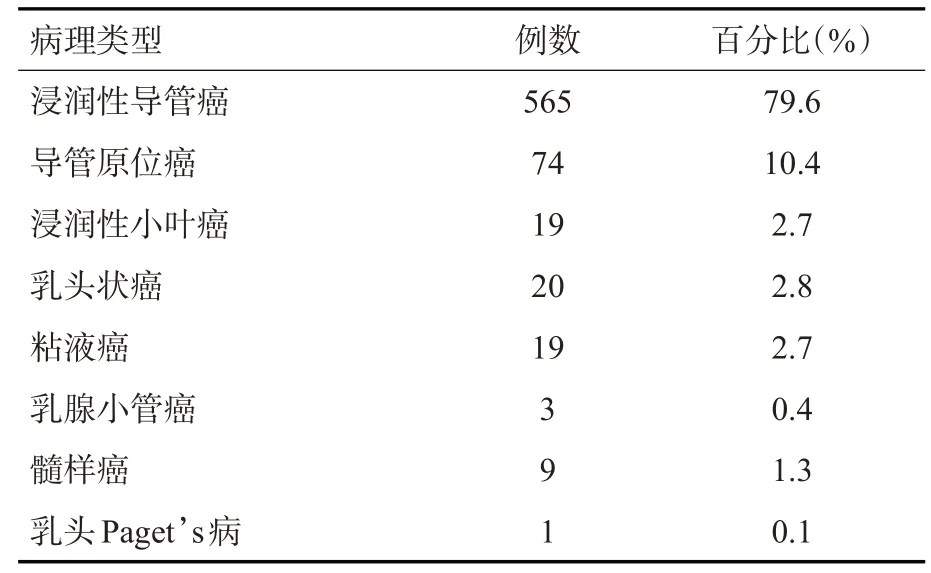
表1 乳腺癌的病理类型分布情况Tab.1 The distribution of pathological types of breast cancer
2.2 乳腺癌免疫组化指标表达及相关性
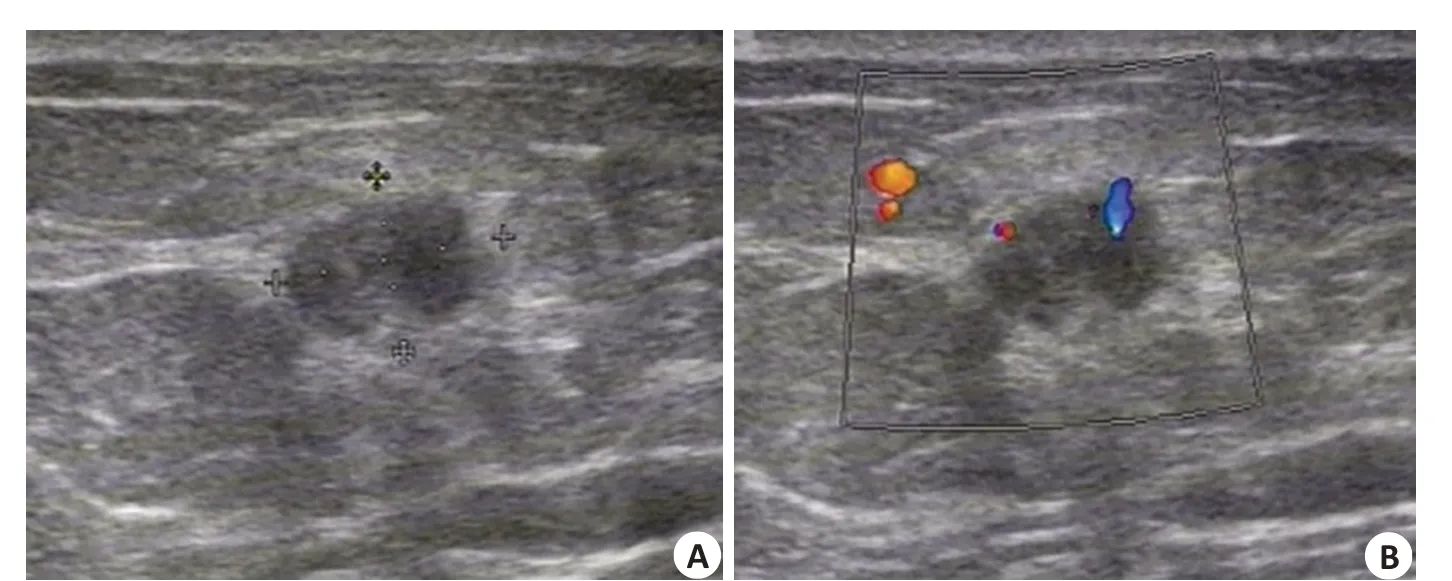
图2 患者女,71岁,浸润性导管癌Fig.2 A 71-year-old woman with invasive ductal carcinoma
本研究710例乳腺癌肿块中,癌细胞ER阳性表达515例(72.5%),PR阳性表达455例(64.1%),HER-2阳性表达433例(61.0%),Ki-67阳性表达570例(80.3%)。经Spearman相关分析发现,ER与PR的表达程度呈正相关(r=0.697,P<0.001),而ER、PR与Ki-67的表达程度均呈负相关(r=-0.218,P<0.001;r=-0.216,P<0.001,表2~4)。
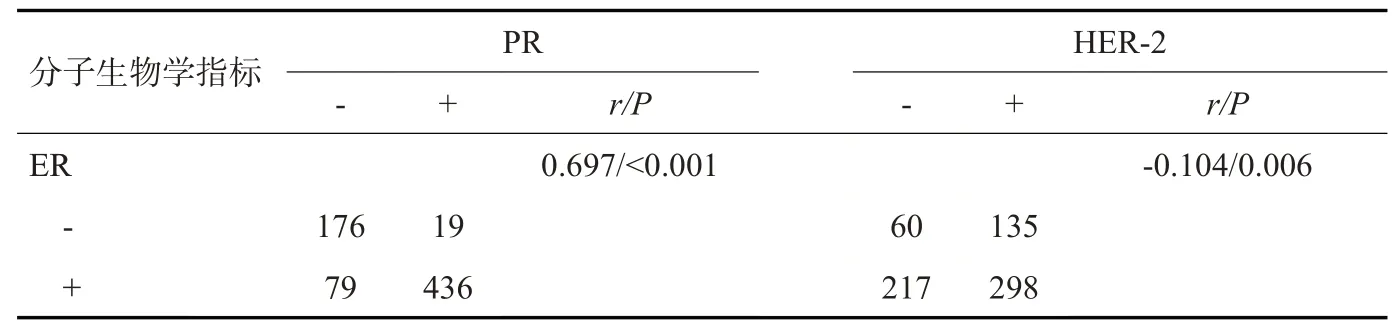
表2 乳腺癌免疫组化指标表达及相关性Tab.2 Expression and correlation of breast cancer immunohistochemical indicators
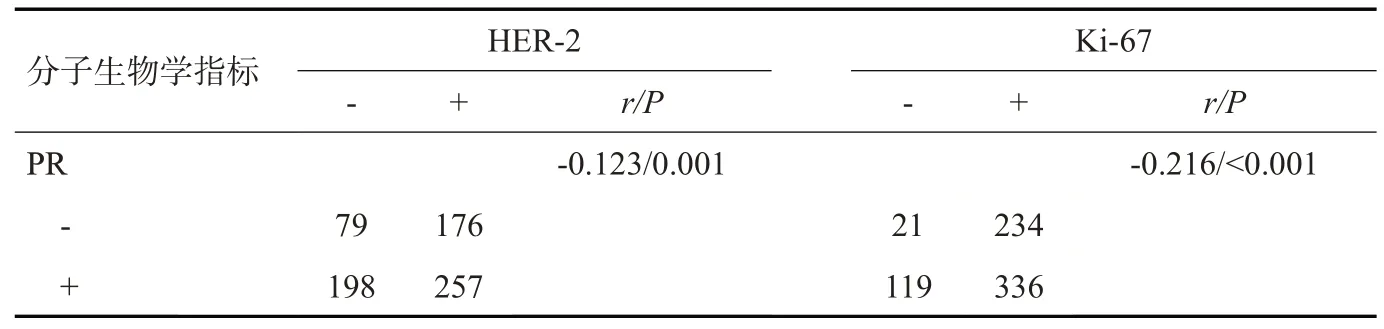
表3 乳腺癌免疫组化指标表达及相关性Tab.3 Expression and correlation of breast cancer immunohistochemical indexes
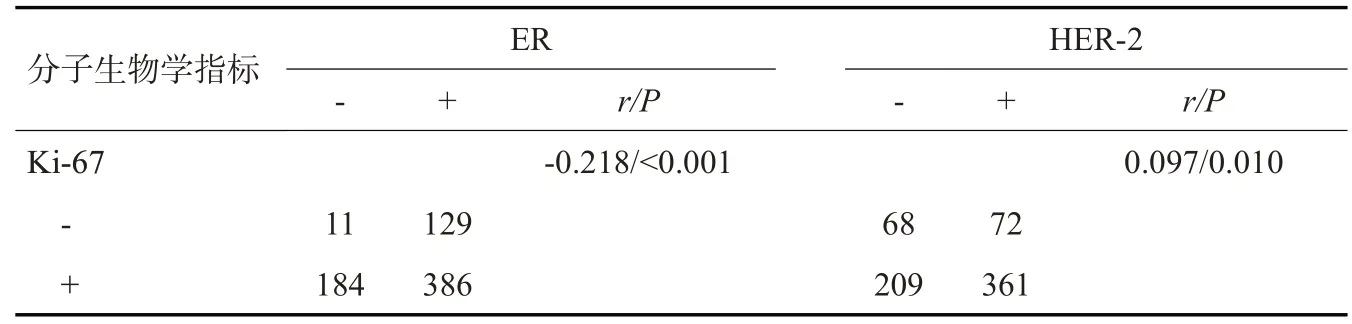
表4 乳腺癌免疫组化指标表达及相关性Tab.4 Expression and correlation of breast cancer immunohistochemical indexes
2.3 乳腺癌超声特征与免疫组化指标的关系
ER、PR在乳腺癌肿块最大径≤2 cm组中的阳性率均高于>2 cm组(χ2=6.245、7.361,P<0.05);而Ki-67在乳腺癌肿块最大径>2 cm组中的阳性率较高(χ2=4.298,P<0.05);肿块形状不规则、边界不清晰、后方回声衰减或消失均与PR 的阳性率较高有关(χ2=8.280、5.636、8353,P<0.05);纵横比>1的肿块ER多表达为阳性(χ2=5.916,P<0.05);纵横比≤1及发生腋窝淋巴结转移的乳腺癌肿块中,HER-2、Ki67阳性率均高于未发生转移的肿块(χ2=11.980、4.732、71.784、4.237,P<0.05)。
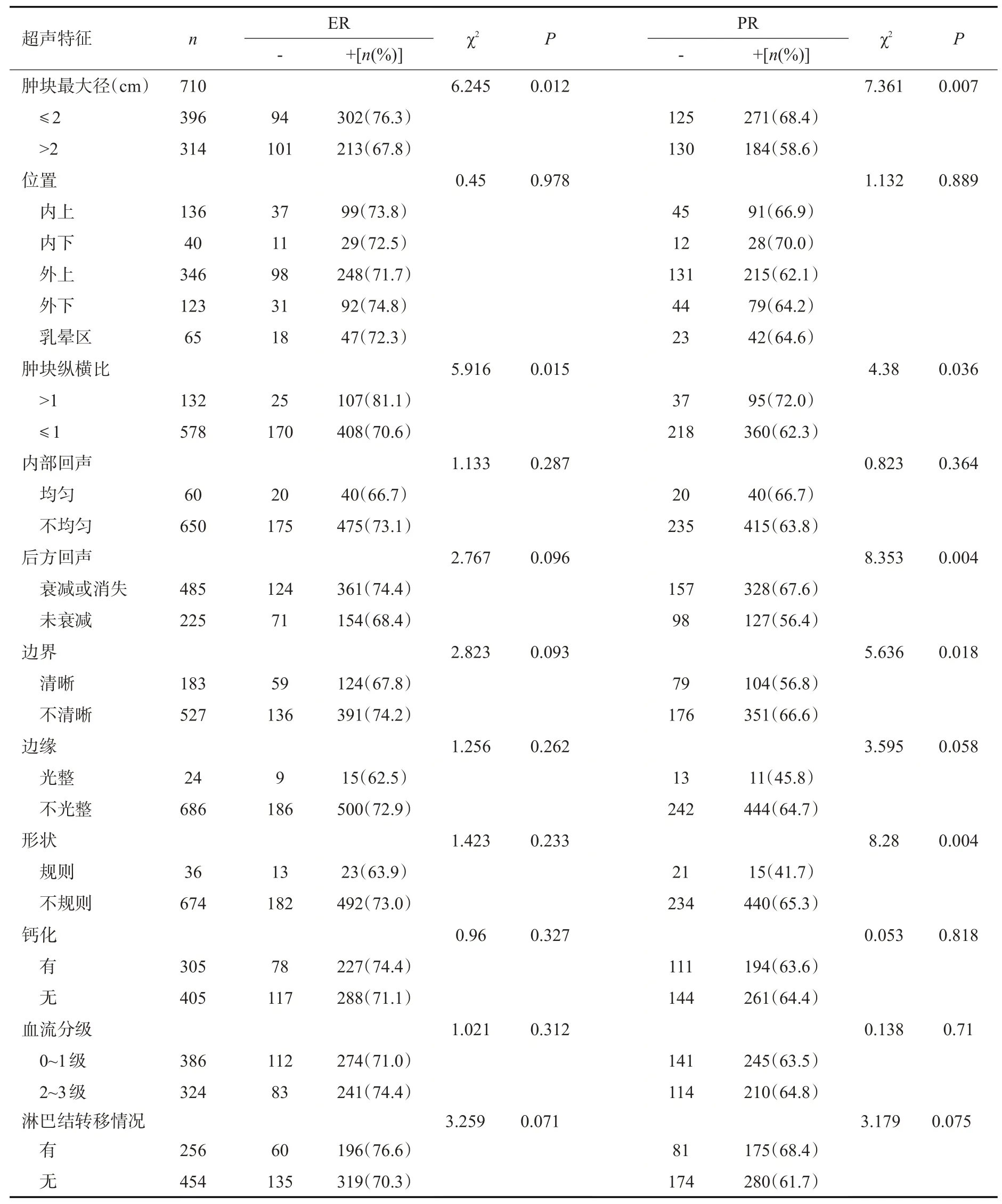
表5 乳腺癌超声特征与ER、PR表达的关系Tab.5 Relationship between the ultrasonographic features of breast cancer and the expression of ER and PR
3 讨论
分子生物学研究发现,某些免疫组化指标与乳腺肿块的形态变化有关联,进一步猜测分子特征与超声图像表现或许存在一定的关系[13]。ER、PR是具有特定功能的甾体类激素受体,其表达阳性提示肿块分化较好、较少发生转移,可以进行内分泌治疗,预后较好[14]。HER-2是调控癌细胞生长及代谢的基因,控制肿块新生血管上皮的生长、繁殖及分裂,其高表达会增加肿瘤的恶性程度,提示预后较差[5]。Ki-67对评价肿瘤细胞增殖状态、研究肿瘤生物学行为具有重要意义,是检测癌细胞增殖活性的敏感性指标[4]。本研究拟探讨乳腺癌超声特征与ER、PR、HER-2、Ki-67表达的相关性,以期术前通过超声征象预测免疫组化表达情况,为进一步临床治疗提供参考依据。
通过分析超声特征及免疫组化指标发现,本研究710例乳腺癌肿块中,ER、PR在肿块最大径≤2 cm组中的阳性率高于最大径>2 cm组,而Ki-67在肿块最大径>2 cm组的阳性率高于≤2 cm组,以上差异均具有统计学意义(P<0.05)。ER或PR表达阳性的患者,通常癌细胞分化较好、增殖率低,病情变化缓慢,对内分泌激素治疗较阴性表达者有更好的临床效果。有研究显示,ER、PR阳性表达者病灶超声表现多为肿块体积小[7],本研究也证实了这一结论,即ER、PR是乳腺癌发生发展的保护因素,可以从分子层面阻止肿瘤的生长。研究表明,Ki-67与乳腺癌细胞增殖活跃程度、肿瘤分化高低、发生浸润转移及预后相关,表达阳性的肿瘤生长迅速,具有较强的侵袭力[15],而本研究也发现,肿块最大径>2 cm时Ki-67阳性表达率较高,提示预后较差。
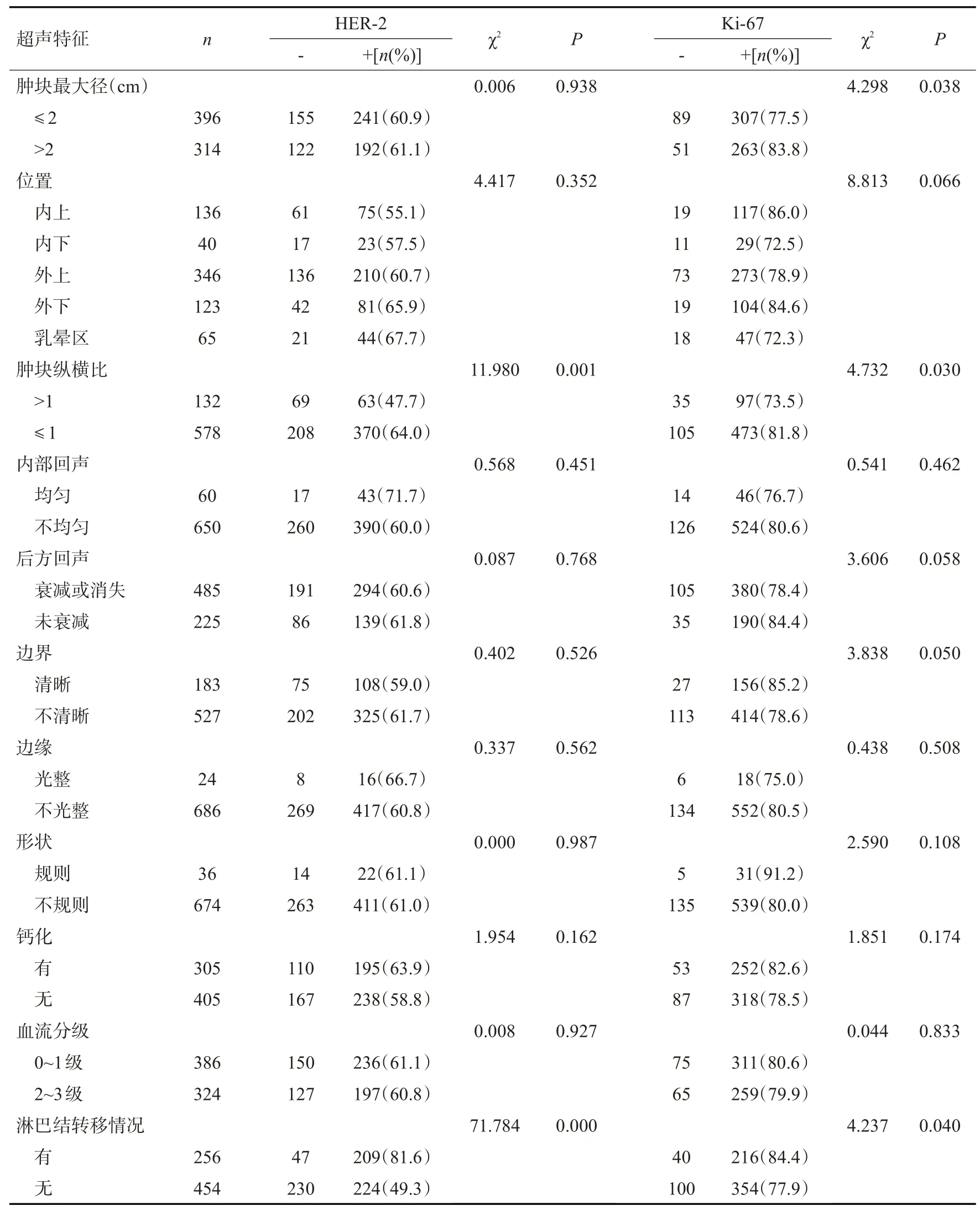
表6 乳腺癌超声特征与HER-2、Ki-67表达的关系Tab.6 Relationship between ultrasonographic features of breast cancer and the expression of HER-2 and Ki-67
有文献通过研究乳腺癌肿块的形态及纵横比发现[8],肿瘤向周围组织浸润性生长的程度及速度不一致,导致肿瘤脱离正常组织范围生长,呈现出的超声特征为形态不规则及纵横比>1,但ER、PR的阳性表达情况没有显著差异(P>0.05)。本研究分析结果与上述有差异,即ER、PR阳性表达组中,乳腺癌肿块多表现为边界不清晰,边缘不光整及形状不规则,且PR在形态规则与不规则分组中的阳性表达情况具有统计学意义(χ2=8.280,P=0.004),ER阳性表达组多表现为肿块纵横比>1(χ2=5.916,P=0.015)。边缘不规整(毛刺征、蟹足样改变)及高回声晕与周边结缔组织反应性增生有关,提示与ER、PR阳性表达呈正相关,即肿瘤恶性程度较低,预后较好[16]。相关性分析结果显示,ER与PR具有正相关(r=0.697,P<0.001),有研究得到了相同的结果[9]。
有研究认为,乳腺癌癌灶快速生长导致局部细胞缺血坏死,从而产生营养不良性钙化,近年来发现部分癌细胞通过特定程序发生间质样变,获得成骨功能后主动分泌成骨相关蛋白,最终形成微钙化[17]。有研究认为HER-2阳性表达与乳腺癌肿块钙化的形成具有显著相关性[7,18-19],本研究HER-2阳性表达率在有无钙化组中的差异没有统计学意义(P>0.05),然而有钙化组的阳性率高于无钙化组(63.9%vs58.8%),也提示有无钙化与HER-2表达情况存在一定的相关性,无统计学意义的结果误差可能是由于地域差异或样本选择偏倚所致,后续可依据纳入排除标准进行更大样本量的调查研究。
HER-2在乳腺癌肿块中的高表达可明显增强癌细胞发生腋窝淋巴结转移及侵袭其他组织的能力,Ki-67表达阳性的乳腺癌癌细胞增殖活跃,侵袭性大,转移率高,预后差[5-6]。在本研究中,HER-2、Ki-67表达阳性的肿块多表现为纵横比≤1(χ2=11.980、4.732,P<0.05),且发生腋窝淋巴结转移的肿块其阳性率均高于未转移的肿块,差异均具有统计学意义(χ2=71.784、4.237,P<0.05),提示HER-2及Ki-67阳性的乳腺癌恶性程度高,具有高转移潜能并预后不良,与之前的研究一致[20-21]。血流情况也是判断乳腺癌肿块性质的一个重要因素,本研究未发现免疫组化指标与血流分级具有明显的相关性,然而既往研究表明HER-2及Ki-67阳性与丰富的血流形成具有重要的联系[7,18],结果差异可能是由于操作医师观察血流信号的主观差异及不同机型多普勒增益调节差异所致,后续会继续扩大样本量进行进一步的统计分析。
综上所述,免疫组化指标是影响乳腺癌发生形态学改变的重要因素,超声特征可以在一定程度上反映免疫组化指标的表达情况。通过分析声像图特征来预测免疫组化指标的表达,是从形态转向功能、从宏观研究转向微观研究,可以间接反映乳腺癌肿块的生物学行为,从而实现在术前为患者制定合理的治疗方案,提高患者生存率。
