SIRT1对氧化应激下人小梁网细胞功能的影响
2021-07-18郭俊宏申晓丽洪向前马大卉谢洪彬杨明民汪建涛
郭俊宏,申晓丽,洪向前,马大卉,谢洪彬,杨明民,汪建涛
(深圳市眼科医院青光眼科,暨南大学附属深圳眼科医院,深圳眼科学重点实验室,广东 深圳 518040)
青光眼是世界上第2位致盲性眼病。研究[1]表明:在2040年全球青光眼患者将达到1.118亿人。开角型青光眼(open angle glaucoma,OAG)作为一种主要的青光眼类型,有部分学者[2]认为其主要发病机制是:小梁网细胞(trabecular meshwork cell,TMC)的细胞外基质(extracellular matrix,ECM)异常沉积,使得房水流出阻力增加,最终引起眼压升高。而TMC在氧化应激的作用下会发生ECM的异常沉积[3]。沉默信息调节因子2相关酶1(silent information regulator 1,SIRT1)是一种可以使组蛋白中赖氨酸残基去乙酰化的去乙酰化酶,其广泛参与氧化应激耐受、胰岛素分泌和葡萄糖合成等生理活动。此外,SIRT1还能通过抑制ECM的异常沉积影响纤维化进程,在心肌纤维化[4]、肝纤维化[5]等疾病中起到非常重要的作用。笔者前期研究发现,H2O2处理HTMC后,SIRT1的RNA及蛋白表达水平会显著下降。本研究通过在人小梁网细胞(human trabecular meshwork cell line,HTMC)中过表达SIRT1,探讨SIRT1对氧化应激下HTMC功能的影响,为SIRT1用于青光眼的治疗提供理论基础。
1 材料与方法
1.1 材料
人原代小梁网细胞系购自美国Sc ienCel l公司;细胞培养基购自美国GIBCO公司;SIRT1过表达慢病毒购自上海吉凯基因化学技术有限公司;TRIzol RNA提取剂购自美国Invitrogen公司;第一链cDNA合成试剂盒购自瑞士Roche公司;FastStart Universal SYBR Green Master(ROX)购自美国Thermo公司;30%过氧化氢购自天津市风船化学试剂科技有限公司;Cell Counting Kit-8试剂盒购自日本同仁化工;Transwell细胞侵袭迁移培养皿购自美国Corning公司;ROS活性氧检测试剂盒(DCFHDA法)购自上海贝博生物公司;常温超速离心机购自德国Eppendorf公司;CO2培养箱为瑞士HEAL FORCE公司HF 160W型;移液枪、PCR扩增仪购自德国Eppendorf公司;生物安全柜购自北京HDL公司;纯水制备仪购自法国Millipore公司;7500 Fast real-time PCR仪购自美国Applied Biosystems公司。
1.2 方法
1.2.1 HTMC培养
HTMC在含有10%胎牛血清、丙酮酸钠(终浓度为1 mmol/L)、L-谷氨酰胺(终浓度为20 mmol/L)、非必需氨基酸(终浓度为100 μmol/L)、青霉素(终浓度为100 units/mL)及链霉素溶液(终浓度为100 μg/mL)的DMEM培养基中培养。HTMC在恒温37 ℃的5%CO2培养箱中常规培养,当细胞汇合度达70%~80%时进行传代。
1.2.2 SIRT1过表达慢病毒转染HTMC模型的构建
细胞按照5×104/孔种于6孔板中,24 h后弃去培养基;每孔对应取一个新的1.5 mL EP管,往里加入完全培养基1 mL以及适量的polybrene(使polybrene的终浓度为5 μg/mL),再分别加入2 μL、20 μL、200 μL的1×108TU/mL的SIRT1过表达慢病毒,吹打混匀后将混合液加入到每孔中;12 h后弃去培养基,加入新的完全培养基2 mL,以供后续实验使用。
1.2.3 细胞迁移实验
HTMC以1×105/孔预种于6孔板,24 h后做相应处理;而后用杜尔贝科磷酸盐缓冲液润洗细胞2遍,弃液,0.25%胰蛋白酶消化,离心,弃上清并用1 mL完全培养基重悬细胞,吸50 μL悬液加10%台盼蓝染色计数;提前将Transwell小室置于24孔板内,往上室加入100 μL细胞培养基,37 ℃、5%CO2孵箱孵育1 h;吸除小室中的培养基,在下室中加入600 μL完全培养基(血清:DMEM=1:1),用含有0.2%小牛血清的细胞培养基以5×104/mL HTMC种于上室中,上样200 μL,37 ℃、5% CO2孵箱继续培养10~12 h;吸出小室和24孔板内液体,用棉签将小室上表面的细胞轻轻擦掉;配置结晶紫工作液(0.03 g结晶紫粉剂加到6 mL无水乙醇中,再用24 mL生理盐水稀释,全程避光),往小室和24孔板内加入800 μL结晶紫工作液,避光室温孵育20 min;用磷酸盐缓冲液洗3遍,每遍10 min;吸除磷酸盐缓冲液,再将小室倒置晾干,用无菌尖刀片将小室膜切下(注意正反面不要弄错),并置于载玻片上;使用中性树胶封片,滴1滴树胶于小室表面,再盖上盖玻片,注意避免气泡产生;用倒置显微镜观察,按照象限随机选择6~8个视野,并拍照计数。
1.2.4 CCK8细胞活性检测
将HTMC悬液按照3×104/mL种于96孔板中,每孔上样100 μL,37 ℃、5% CO2孵箱预培养;24 h后根据实验需要处理HTMC;刺激结束后将培养液吸除,并用PBS洗2遍,吸除;按照细胞培养基:CCK8溶液=9:1向每孔加入混合液100 μL(注意避免产生气泡),孵箱继续孵育1~2 h;最后用酶标仪450 nm测定吸光度(OD值)。细胞活力(%)=[OD(被处理过的细胞)-OD(仅有培养基)]/[OD(仅有细胞和培养基)-OD(仅有培养基)]×100。
1.2.5 实时定量PCR法检测基因的表达水平
根据TRIzol试剂的说明书提取HTMC 的总RNA,根据第一链cDNA 合成试剂盒将其逆转录成cDNA,利用随机引物进行扩增。再根据FastStart Universal SYBR Green Master试剂盒说明书加样以及目的基因的相应引物(表1),扩增条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火并延伸60 s,共40个循环。其中β-actin作为内参基因,利用2-ΔΔCt法计算各组细胞中相关RNA的相对表达量。其中ΔΔCt=(目的基因CT值-内参基因C值)实验组-(目的基因CT值-内参基因CT值)对照组。

表1 相关基因的引物序列Table 1 Primer sequences of related genes
1.2.6 ROS测定
按照1:1000用无血清培养基稀释DCFHDA,将各组处理好的细胞收集后重悬于稀释好的DCFH-DA中,37 ℃细胞培养箱内孵育20 min(避光),每隔4 min颠倒混匀一下。随后用无血清细胞培养基洗涤细胞3次。用96孔板检测,每组样品添加4份,使用多功能酶标仪检测,激发波长488 nm,发射波长525 nm,读取A值,然后以空白对照组为100%,其他各组与之对比,得出的结果为检测值。
1.3 统计学处理
结果均由至少3次的独立实验统计而得。采用SPSS 20.0统计学软件进行数据处理。本研究中各检测指标的计量资料经Kolmogorov-Smimov检验证实呈正态分布,以均数±标准差()表示。采用完全随机分组单因素干预多水平实验设计,SIRT1过表达组和GFP病毒空载体组组间RNA相对表达量的总体差异比较均采用独立样本t检验分析,多样本组间两两比较先进行方差齐性检验,方差齐采用LSD-t法,方差不齐采用Dunnett T3法。P<0.05为差异有统计学意义。
2 结果
2.1 成功建立SIRT1过表达慢病毒感染HTMC模型
笔者将SIRT1过表达慢病毒和GFP阴性对照慢病毒按照感染复数(multiplicity of infection,MOI)为10转染入HTMC,转染48 h后,荧光显微镜下可观察到HTMC内有明显的报告基因GFP表达,表明SIRT1过表达慢病毒成功转染至HTMC中(图1)。
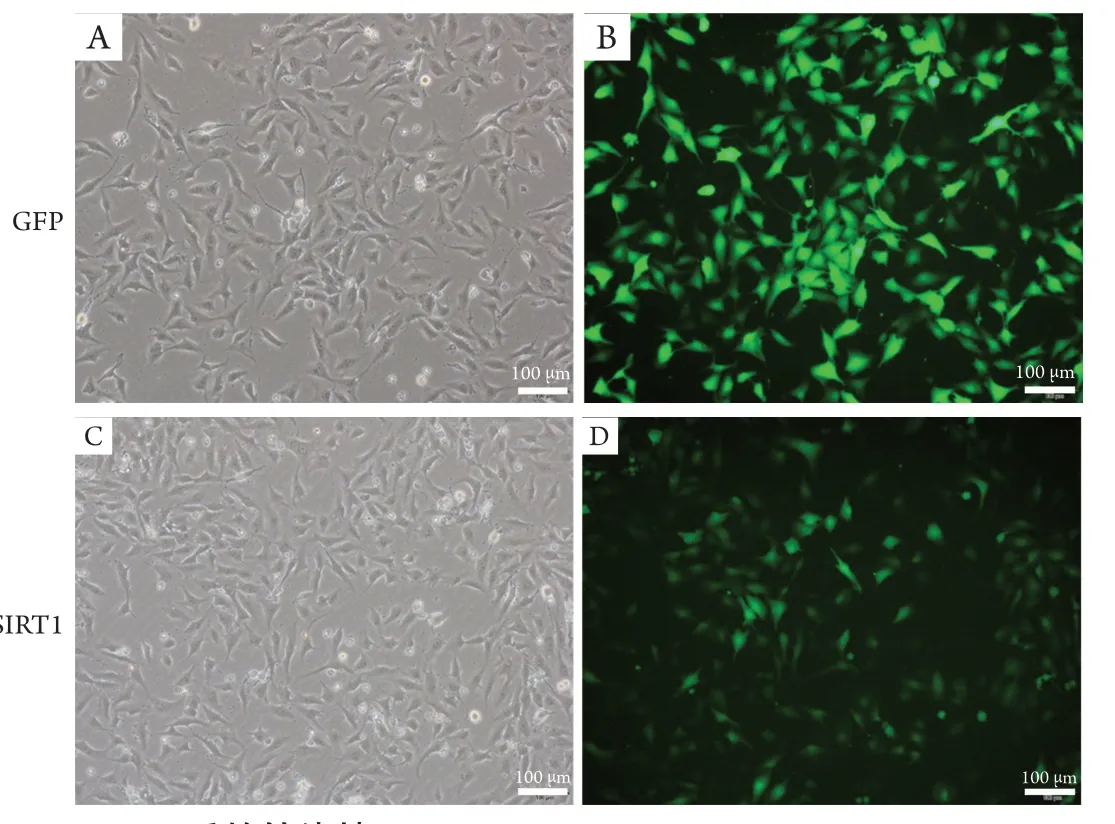
图1 显微镜下观察慢病毒转染HTMC 48 h后的转染情况(×100)Figure 1 HTMC was observed under the microscope after lentivirus transfection for 48 hours (×100)
2.2 SIRT1 在转染后HTMC 的表达水平明显提高
分别提取感染了SIRT1过表达慢病毒或GFP阴性对照慢病毒的HTMC的总RNA,反转录后进行Real-time PCR实验,检测两组中SIRT1的表达水平差异,使用2-ΔΔCt法计算基因的相对表达倍数变化,结果显示:与GFP阴性对照组相比,SIRT1过表达组中SIRT1的表达水平明显高于对照组(1.000±0.056 vs 0.095±0.005,P<0.0001);同样地,SIRT1过表达组中SIRT1的蛋白表达水平也明显高于对照组(图2)。
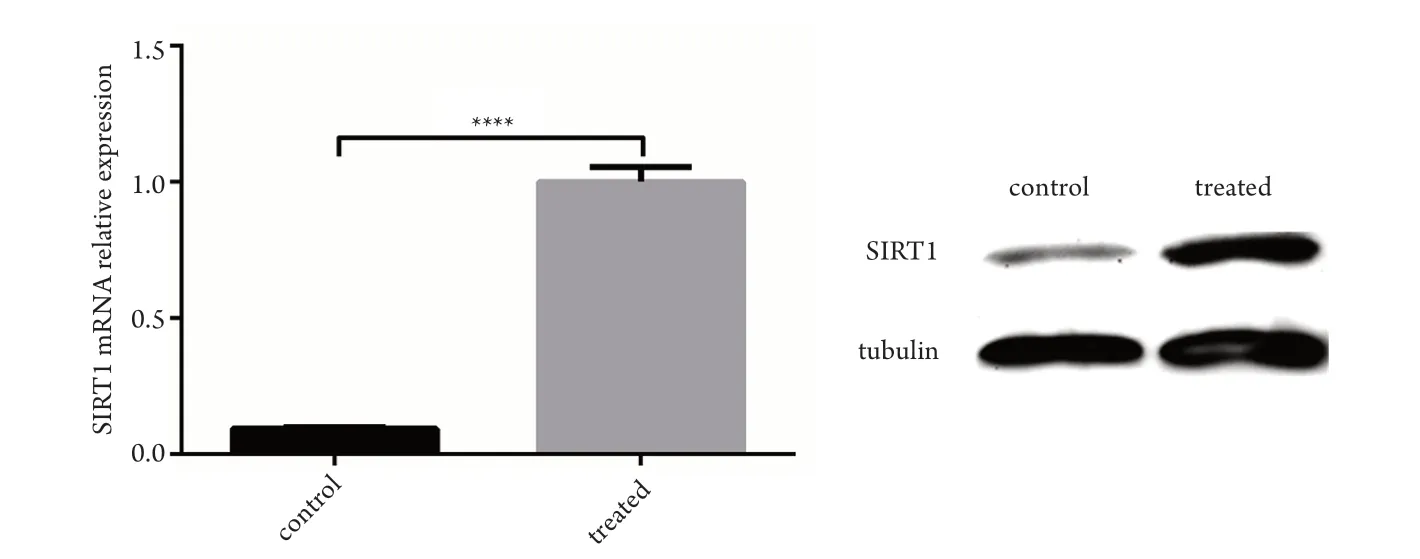
图2 SIRT1过表达组与GFP阴性对照组中SIRT1在mRNA水平和蛋白水平的比较Figure 2 Comparison of SIRT1 mRNA and protein levels between SIRT1 overexpression group and GFP negative control group
2.3 SIRT1 过表达能有效降低氧化应激对HTMC迁移能力的影响
Transwell迁移实验结果显示:H2O2刺激组每孔细胞迁移数量为254±25,正常对照组为436±73,两者在细胞迁移能力上,差异有统计学意义(P<0.001)。另外,H2O2+Lv-SIRT1-OE组每孔细胞迁移数量为510±51,阴性对照组(H2O2+Lv-GFP)为327±46,H2O2+Lv-SIRT1-OE组分别与H2O2组和阴性对照组差异均有统计学意义(P<0.01),说明SIRT1过表达能有效降低氧化应激对HTMC迁移能力的影响(图3)。
2.4 SIRT1 过表达能有效降低氧化应激对HTMC细胞活性的影响
CCK8增殖实验结果显示:H2O2刺激组与正常对照组在细胞活性上,差异有统计学意义(P <0.01)。同时,H2O2+Lv-SIRT1-OE组分别与H2O2组和阴性对照组(H2O2+Lv-GFP)相比差异均有统计学意义(P<0.01),且与正常组的差异没有统计学意义(P>0.05),表明SIRT1过表达能有效降低氧化应激对HTMC细胞活性的影响(图4)。同时检测凋亡标志蛋白Bax和Bcl-2,H2O2+Lv-SIRT1-OE组分别与H2O2组和阴性对照组(H2O2+Lv-GFP)相比,Bax表达水平明显下降,Bcl-2表达水平明显提高,差异均有统计学意义(P<0.01,图5)。此外,通过ROS活性氧测定,笔者发现H2O2+Lv-SIRT1-OE组比H2O2组的细胞活性氧水平显著地降低(P<0.05),表明SIRT1过表达能有效降低氧化应激状态下HTMC的活性氧水平(表2)。
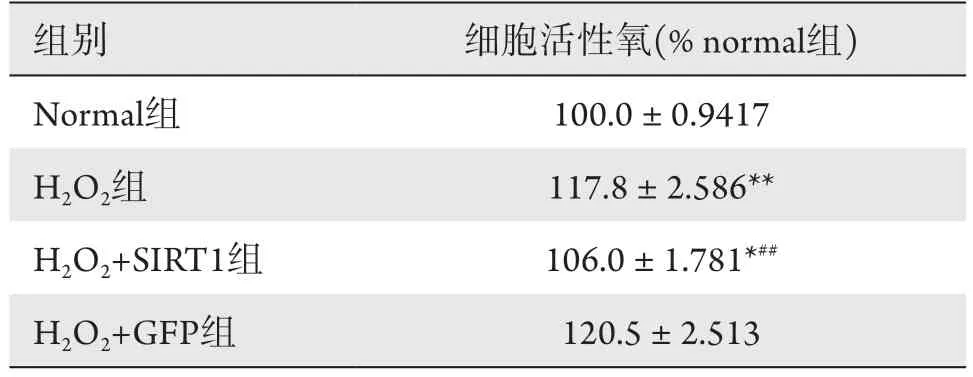
表2 SIRT1过表达对氧化应激下HTMC活性氧水平的影响Table 2 Effects of SIRT1 overexpression on reactive oxygen species of HTMC under oxidative stress
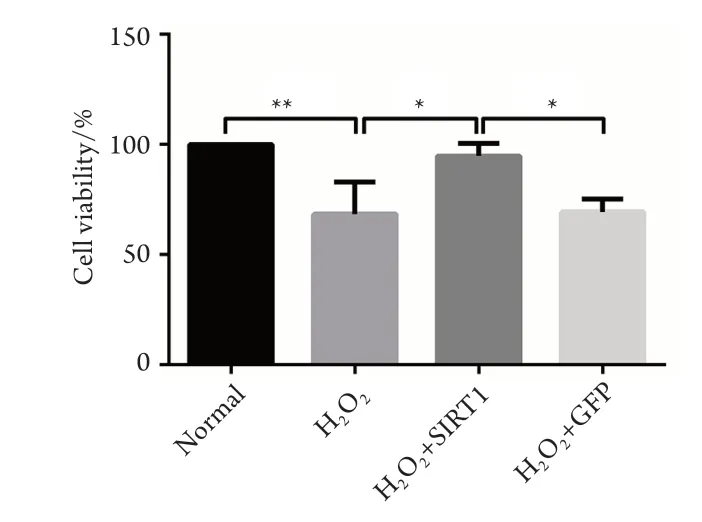
图4 SIRT1过表达对氧化应激下HTMC细胞活性的影响Figure 4 Effect of SIRT1 overexpression on cell viability of HTMC under oxidative stress

图5 SIRT1过表达对凋亡标志蛋白表达的影响Figure 5 Effect of SIRT1 overexpression on expression of apoptotic marker proteins
3 讨论
SIRT1存在于眼部近乎所有组织中,如角膜、睫状体、葡萄膜、晶状体、视网膜等[6]。在青光中,HTMC对氧化应激的反应在房水流出通路的生理过程中起重要作用[7-8]。研究[9]显示:与正常HTMC相比,SIRT1在青光眼HTMC中的表达量显著较低,且SIRT1可以使HTMC免受氧化应激所致的细胞凋亡和DNA双链损伤。表明SIRT1在一定程度上参与到青光眼的发病机制当中,并发挥重要作用。
白藜芦醇(resveratrol,RSV)作为SIRT1的激动剂,可通过激活SIRT1来保护细胞免受外界刺激的损伤,提高其抗氧化能力[10]。在青光眼方面,RSV可抑制小梁网细胞中活性氧的产生[11]及多种炎症因子的表达[12]。多数学者[2-3]认为:ECM的异常积聚是开角型青光眼的主要发病机制之一[2],而氧化应激是导致ECM异常沉积的重要机制之一[3]。笔者前期研究发现:在300 μmol/L H2O2刺激2 h下,经过RSV处理的HTMC,其ECM的转录水平和翻译水平都比只用H2O2处理的HTMC要低[13];同样,在300 μmol/L H2O2刺激2 h下,在HTMC中过表达SIRT1,其ECM的转录水平和翻译水平都比只用H2O2处理的HTMC要低,证明SIRT1也参与到了调控人小梁网细胞ECM生成的过程中。为探究氧化应激对HTMC细胞功能的影响,本研究应用了CCK-8及Transwell实验进行评估,结果显示:氧化应激会使得HTMC活性降低,同时也会对细胞迁移有抑制作用。而在HTMC中,过表达SIRT1能有效降低氧化应激对HTMC活性以及迁移能力的影响。同时,过表达SIRT1能显著减少细胞内Bax表达水平,减少ROS的产生。因此,笔者认为激动氧化应激下HTMC中的SIRT1将极有可能会对HTMC产生保护作用。
SIRT1抵抗氧化应激可能存在多种调控机制。氧化应激状态下,SIRT1可调控多种靶蛋白,例如FOXO、p53等。研究[14]表明:高糖诱导人晶状体上皮细胞处于氧化应激状态下,FOXO3是应激反应早期敏感的指标,氧化应激状态下,SIRT1与FOXO3在细胞中形成复合物,并去除FOXO3的乙酰化水平,从而保护细胞避免凋亡,提高对氧化应激的抵抗力。另一项研究[15]显示:p53蛋白稳定性增加或者被激活都能诱导细胞凋亡的发生,SIRT1能够降低p53乙酰化水平,从而阻止氧化应激与DNA损伤诱导的凋亡。此外,SIRT1能够调高抗氧化酶MnSOD的活性,提高H9C2心肌细胞中氧化物的清除率从而实现抗氧化应激的作用[16]。
青光眼滤过手术(glaucoma filtration surgery,GFS)是一种针对降眼压药物和激光治疗不理想时的主要手术方式,而GFS的失败主要是由于瘢痕形成、ECM增生及纤维化,最终导致滤过泡功能减退[17]。因此,通过激动SIRT1,比如使用SIRT1的激动剂——RSV,这将有可能应用于GFS术后,减少术后ECM沉积及瘢痕化,从而更好地维持滤过泡的形成。
笔者前期曾采用Agilent长链非编码RNA芯片对分别转染了SIRT1过表达慢病毒和GFP阴性对照慢病毒的HTMC样本进行长链非编码RNA表达谱分析。结果发现,Notch信号通路[18-19]、FoxO信号通路[20-21]、MAPK信号通路[22]、mTOR信号通路[23]以及PI3K-Akt信号通路[24-25]均可能参与开角型青光眼的发病过程,而这些信号通路与细胞外基质的异常沉淀、氧化应激和细胞凋亡密切相关。笔者认为SIRT1将在其中扮演重要角色。但是本研究还有不足之处,本研究仅在体外完成,还需要更多的体内实验来验证结论的准确性。此外,本研究只进行了RNA分析,后续研究中还需要进行具体的蛋白表达分析。关于SIRT1过表达能够降低氧化应激对HTMC迁移能力的影响,笔者考虑是否可能是通过促进HTMC的上皮间质转化(epithelialmesenchymal transition,EMT)完成的,还需要补充EMT相关分子的表达水平变化。
综上,在HTMC中过表达SIRT1能有效降低氧化应激对HTMC活性以及迁移能力的影响,对病理状态下的HTMC起到保护作用。通过结合前期高通量基因芯片的结果,笔者将筛选出差异表达的长链非编码RNA,并结合上述所提及的通路,进一步探究SIRT1保护氧化应激状态下HTMC功能的具体调控机制,为青光眼临床治疗提供真实有效的科学依据。
