慢性阻塞性肺疾病大鼠血液、支气管灌洗液中水通道蛋白及p-c-Jun-N-末端激酶表达情况实验研究
2021-07-15张卓红赵拖利
张卓红,赵拖利
(1.西电集团医院呼吸与危重症医学科,陕西 西安 710077;2.榆林市中医医院药房,陕西 榆林 719000)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是以持续气流受限为特征的呼吸系统疾病,气流受限多呈进行性发展,主要累及气道、肺实质及肺血管系统[1]。随着老年人口的增加,有害气体排放的增加,COPD的患者逐年增加,在60岁以上人群的患病率接近10%,严重影响患者的劳动能力和生活质量[2-3]。该病的主要临床表现为咳嗽、咯痰、喘息、胸闷等,特别是COPD炎症过程中存在气道黏液高分泌,黏液中高黏蛋白含量显著增加,使得黏液中的水与黏蛋白比例失衡,导致痰液黏稠,以致患者成为易感者[4-5]。并且长期的慢性炎症可导致气道组织结构反复损伤及异常修复,引起肺泡上皮细胞功能障碍,造成气流受限,导致肺泡壁塌陷,诱发机体形成肺气肿[6-7]。不过当前COPD的发病机制还不明确,探究出一种参与COPD的发生机制对于改善患者预后具有重要价值。水通道蛋白-1(Aquaporin,AQP-1)与p-c-Jun-N-末端激酶(P-c-Jun-N-terminal kinase,p-JNK)蛋白与细胞凋亡存在相关性,可介导细胞膜到细胞核的信号转导,可被细胞应激、炎症、凋亡等多种因素激活[8-9]。本文具体探讨与分析了COPD大鼠血液、支气管灌洗液中AQP-1及p-JNK表达情况,探寻COPD的发生调节机制,为阻止或延缓COPD的病情发展提供参考,现总结报告如下。
1 材料与方法
1.1 研究材料 7~8周龄SPF级Wistar雄性大鼠(n=48)购自北京维通利华公司,合格证号SCXK388114,体重(250±20)g。大鼠分笼饲养,由专人管理,每笼5只。实验动物中心光照充足,普通专用饲料喂养,环境温度为18~25 ℃,通风和空调设备良好,相对湿度为50%~70%,实验室按常规定期消毒。所有大鼠于上述适应性饲养1周后用于实验,动物伦理委员批准了此次研究。 非束缚小动物肺功能测量仪购自美国BUXCOBUXCO公司,熏烟箱购自苏州市冯氏实验动物设备有限公司,酶联免疫检测试剂盒购自北京博奥森生物技术有限公司,过滤嘴香烟购自长沙卷烟厂。
1.2 动物分组与建模 将大鼠随机平分为对照组和模型组。模型组:在实验第1天和第14天,大鼠各经气管注射脂多糖,其余时间将大鼠置于半封闭的熏烟染毒箱内熏烟2次,每次8支长沙牌香烟(分为4次点燃,每次燃尽耗时8~10 min,保持烟雾浓度为5%左右,总共耗时为40 min),两次熏烟时间间隔10 h,熏烟完毕后进行正常清洁饲料饲养。对照组:在清洁环境下进行饲养。对照组、模型组分别为造模第4周、第8周、第12周分别处死8只大鼠进行后续实验。
1.3 观察指标 ①观察与记录所有大鼠的一般状态,包括行为、外观、进食进水、症状等。②在造模第4周、第8周、第12周穿刺大鼠的颈总动脉并固定,抽取0.2 ml动脉血,采用血气分析仪检测二氧化碳分压(PaCO2)和氧分压(PaO2)。③在上述时间点夹毕颈总动脉,建立气管通道,通过生物机能实验系统测定大鼠肺功能,测定与记录第0.3秒用力呼气容积(FEV0.3)、第0.3秒用力呼气容积占用力肺活量的比值(FEV0.3/FVC)等指标。④取大鼠的颈动脉血,尽量取尽大鼠血液,静置20 min后离心,分离血清,保存于-20 ℃冰箱。包括大鼠胸腔气管和肺门,结扎右主支气管,回收支气管肺泡灌洗液,过滤后取上清液保存于-20 ℃冰箱,然后采用酶联免疫检测血液、支气管灌洗液中AQP-1、p-JNK浓度。

2 结 果
2.1 两组一般情况比较 所有大鼠都无死亡情况发生。对照组大鼠神经状况良好,动作灵活,皮毛有光泽,进食、进水正常。模型组大鼠表现为不同程度的烦躁,出现明显的腹式呼吸,食欲及活动能力下降。
2.2 两组造模不同时间点血气指标比较 模型组造模第4周、第8周、第12周的PaCO2高于对照组,PaO2低于对照组,两组比较差异有统计学意义(均P<0.05),见表1。

表1 两组造模不同时间点血气指标比较(mmHg)
2.3 两组造模不同时间点肺功能比较 模型组造模第4周、第8周、第12周的FEV0.3、FEV0.3/FVC都低于对照组,两组比较差异有统计学意义(均P<0.05),见表2。
表2 两组造模不同时间点肺功能比较
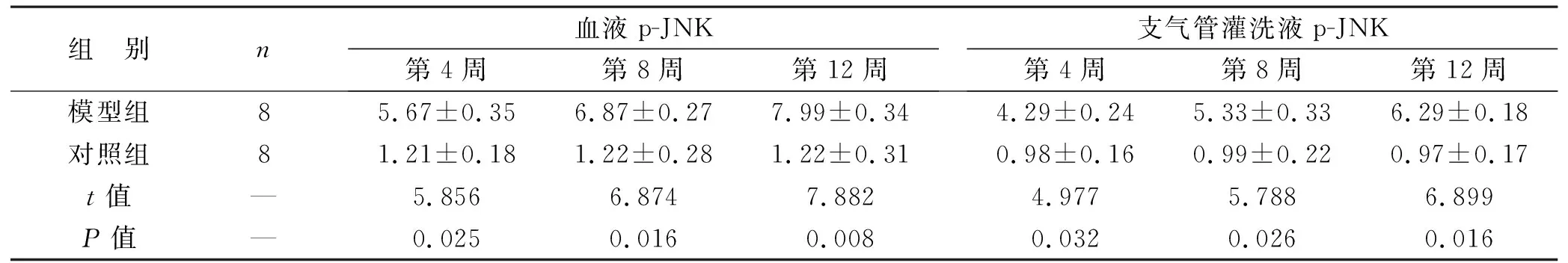
2.4 两组造模不同时间点血液、支气管灌洗液AQP-1、p-JNK表达水平比较 模型组造模第4周、第8周、第12周的血液、支气管灌洗液AQP-1、p-JNK表达水平都高于对照组,两组比较差异有统计学意义(均P<0.05),见表3。
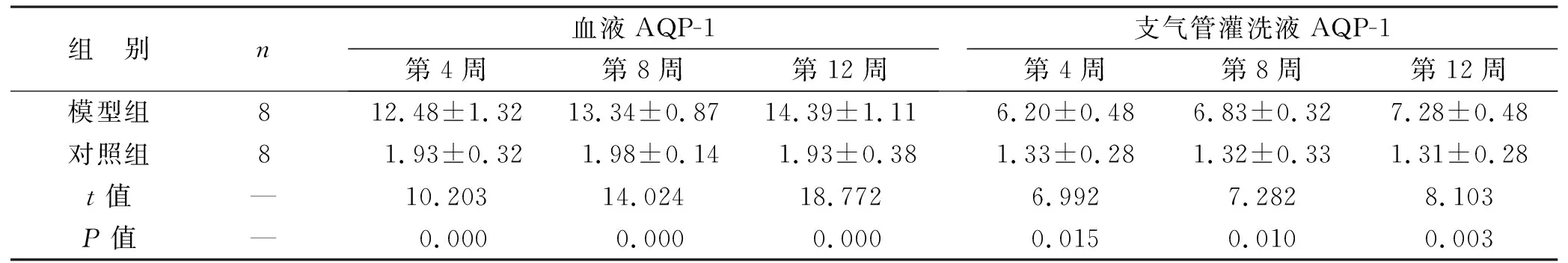
表3 两组造模不同时间点血液、支气管灌洗液AQP-1、p-JNK表达水平比较(pg/ml)
续 表
2.5 COPD大鼠血液、支气管灌洗液中AQP-1及p-JNK表达与血气指标、肺功能相关性分析 在模型组中,Pearson相关分析造模第12周的血液、支气管灌洗液AQP-1、p-JNK表达水平与PaCO2、PaO2、FEV0.3、FEV0.3/FVC存在相关性(均P<0.05),见表4。
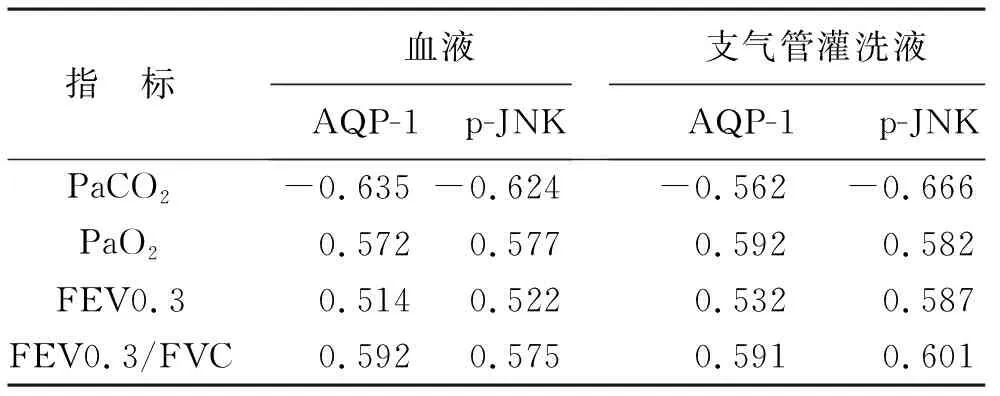
表4 COPD大鼠血液、支气管灌洗液中AQP-1及p-JNK表达与血气指标、肺功能相关性(n=8)
3 讨 论
COPD是一种高患病率、高病死率的公众健康疾病,其发病机制还不明确,不过涉及到蛋白酶-抗蛋白酶失衡、慢性炎症、氧化应激等多个过程,可导致肺实质破坏与慢性支气管炎形成,最终导致持续性气流受限[10-11]。随着医学技术的发展,COPD的临床治疗取得了长足的进步,但其病死率仍居高不下,为此继续加强发病机制研究具有重要价值[12]。本研究显示模型组造模第4周、第8周、第12周的PaCO2高于对照组(均P<0.05),PaO2低于对照组(均P<0.05);模型组造模第4周、第8周、第12周的FEV0.3、FEV0.3/FVC都低于对照组(均P<0.05),表明采用气管内注射脂多糖与被动吸烟法建立COPD大鼠模型具有很好的效果。从机制上分析,脂多糖引发类脂性肺炎,诱导炎症介质的释放及激活,可模拟细菌感染和炎症过程[13]。持续进行熏烟可导致大鼠小气道通气阻力升高与肺动态顺应性减少,使得大鼠存在慢性咳嗽咳痰、喘息、呼吸困难等症状[14]。
COPD是一种具有气流受到限制的常见病、多发病,病情重时不可逆,气流受限病情轻时可逆,可表现为气道重新塑造与气道高反应性[15]。COPD 动物模型的评价主要依靠病理学和肺功能观察,功能从病理生理角度阐释模型功能学改变,由于大鼠呼吸是被动的,为此在实际检测中多采用FEV0.3、FEV0.3/FVC等指标。本研究显示模型组造模第4周、第8周、第12周的FEV0.3、FEV0.3/FVC都低于对照组(均P<0.05)。表明COPD大鼠可出现肺功能下降,也认为本研究建立的COPD大鼠模型是成功的。
已有研究认为氧化应激是导致COPD发生的主要原因之一,氧化应激导致的内质网应激引发多种细胞的未折叠蛋白反应,造成抗氧化物质过度消耗,还能够通过多种途径激活线粒体凋亡通路等多种信号通路[16]。其中p-JNK可通过调节Bcl-2家族成员分子的活性等机制促使细胞凋亡,加速肺气肿的发生,进而参与COPD的发生与发展。AQP-1是肺组织中主要的水转运通道,AQP-1表达增加可导致黏蛋白浓度增加与气道水分泌减少[17]。本研究显示模型组造模第4周、第8周、第12周的血液、支气管灌洗液AQP-1、p-JNK表达水平都高于对照组(均P<0.05),表明COPD大鼠伴随有血液、支气管灌洗液的AQP-1、p-JNK高表达。当前也有研究表明AQP-1、p-JNK能够上调TNF-α水平,能增加过氧化物的产生,进一步激活巨噬细胞,刺激巨噬细胞脱颗粒,从而加重肺损伤。并且AQP-1、p-JNK被激活后会释放出蛋白酶、氧化代谢产物等损伤局部组织,使支气管和肺组织发生多种病理变化,导致COPD的病情恶化[18]。
本研究Pearson相关分析COPD大鼠造模第12周的血液、支气管灌洗液AQP-1、p-JNK表达水平与PaCO2、PaO2、FEV0.3、FEV0.3/FVC存在相关性(均P<0.05)。从机制上分析,AQP-1、p-JNK在血液与呼吸系统释放炎症介质,能导致气道炎症反应,从而破坏患者肺组织,降低了COPD机体的肺功能[19-20]。本研究也存在一定的不足,没有对大鼠的肺组织进行病理分析,也没有进行AQP-1、p-JNK蛋白表达的Western blot检测分析,将在后续研究中进行探讨。
综上所述,COPD大鼠伴随有血液、支气管灌洗液的AQP-1、p-JNK高表达,且与大鼠的血气指标与肺功能存在相关性,从而参与COPD的发生与发展。
