栽培墨兰根腐病病原鉴定与生防菌筛选
2021-07-09陈健鑫尼玛此姆魏玉倩韩雨庭吕则佳马焕成伍建榕
唐 婕,陈健鑫,尼玛此姆,魏玉倩,落 追,韩雨庭,吕则佳,马焕成,伍建榕,
(1西南林业大学/云南省高校森林灾害预警控制重点实验室,昆明 650224;2西南林业大学西南地区生物多样性保育国家林业局重点实验室,昆明 650224)
0 引言
墨兰(Cymbidium sinense)作为中国的名花之一,具有高贵的花形及适宜的花香,不仅观赏价值极佳,在药用价值、经济价值以及食用价值等方面也有很好的前景,商业价值广阔。然而,近年来,由于野生墨兰的过度采挖,加之生态环境的破坏,将野生墨兰推向了灭绝的边缘。随着兰花产业化的迅猛发展,国内外市场对兰花的需求逐步增加,而墨兰人工栽培苗木成活率较低,影响产业化生产,主要原因是根系没有完全菌根化,易受根腐病菌侵染。2018年云南墨江人工栽培基地墨兰普遍出现根腐现象,发病率达60%,大量植株部分枯死或整株枯死,为明确病因,2018年5月笔者进行了实地调查及发病植株样本采集,同时,采集原生地健壮的墨兰根部和根际土壤,带回实验室进行病原菌分离鉴定和致病性测定,对原生地采集野外生长健壮的墨兰根和土壤进行生防菌分离培养,以期为人工栽培墨兰根腐病的诊断鉴定及病害绿色防控提供理论依据。
1 材料与方法
1.1 样品采集
2018年5月于云南墨江龙潭乡、景星乡等3个栽培基地采集墨兰根腐病病根60株,尤以发病严重的为主,进行分离培养。
1.2 病原菌分离和培养
采用组织分离法分离病原真菌。选取发病典型的墨兰根腐病病根,清水洗净后,用灭菌的刀片切取病健交界处1.5 cm×1.5 cm大小的根部,将其放入75%的酒精浸泡10 s,0.1%升汞溶液浸泡1 min,再用无菌水漂洗5次,将多余水分用无菌滤纸片吸掉,在无菌培养皿中切出新面,横置于PDA平板上,25℃暗室中培养5天;当菌丝长出后,用无菌接种环转接至无菌PDA平板上纯化培养,纯菌株接种至试管斜面上,待菌落长出后置于4℃冰箱里保存备用[1-4]。
1.3 病原菌致病性测定
1.3.1 离体植物致病性验证方法 取健康墨兰植物上的根部,用清水洗净,75%酒精浸泡消毒10 s,蒸馏水中漂洗3次,用无菌挑针刺伤根部组织,接种病原菌菌饼(菌株25℃培养7天时取直径6 mm的菌饼)后固定好,同时也采取烫伤接菌饼(直径6 mm)方式,每种处理重复8次,以接种空白PDA菌饼处理为对照,置于25℃条件下保湿培养,每日记录发病状况。
1.3.2 整株植物致病性验证方法 取2年生盆栽健康墨兰幼苗,用针刺接种病原菌菌饼和喷洒病原菌悬浮液(孢子悬浮液浓度用血球计数板调节孢子液终浓度1×105个/mL)2种方法,将病原菌接种在墨兰幼苗的根茎部后套袋保湿24 h。同时观察记录接种菌株的发病情况,发现仅ML6-1菌株具较强的致病性,ML2-1菌株具较轻的致病性,其他菌株无明显致病性。
待健康墨兰发病后再次通过组织分离法重新分离获取病原菌,并与初始菌株进行比较[5]。
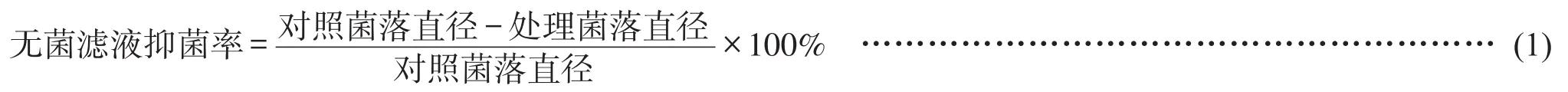
1.4 病原菌形态特征观察
采用玻片检视法观察病原菌形态结构。将无菌盖玻片斜插入培养基平板上,挑取纯化的菌株接种于PDA平板上,25℃下培养箱培养10天,待菌丝长出后,用显微镜观察玻片并拍照。将菌丝块置于无菌水中培养,每隔24 h换一次水,在7天时挑取菌丝丛,参考《真菌分类学》,用显微镜观察孢子和菌丝的形态特征,并初步鉴定其种类[6-7]。
1.5 病原菌的分子鉴定
以真菌基因组提取试剂盒(上海生工)提取上述分离的病原真菌基因组总DNA,以真菌18S rRNA基因通用引物(ITS1/ITS4)进行PCR扩增。PCR反应体系为50 μL,扩增反应条件为94℃ 5 min,94℃ 40 s→55℃40 s→72℃ 30 s,30 个循环,72℃ 10 min,4℃保存。PCR产物送至昆明擎科测序公司进行测序,得到序列在NCBI上进行Blast比对,选取部分同源性较高的序列构建系统发育树[8]。
1.6 拮抗菌的分离培养、筛选
采用稀释涂布法分离根际微生物。取健康墨兰根际土样10 g置于三角瓶内,加入90 mL的无菌水,置于28℃摇床中180 r/min振荡20 min。取1 mL土壤悬浮液放置试管中,加入9 mL无菌水,制成10-1g/mL菌悬液,按照此方法,获得10-2、10-3、10-4、10-5、10-6g/mL的菌悬液。取10-4、10-5、10-6g/mL的菌悬液涂布于分离培养基上,保持恒温28℃培养24 h,用三步划线法分离纯化,并统一编号登记。斜面保存后,放置4℃的环境中保藏[9]。
采用平板对峙法,初步筛选能抑制墨兰根腐病病原菌生长的拮抗细菌。取病原菌置于PDA平板中央,然后再取待测菌液接于距病原菌1.5 cm处,设不加待测菌液的PDA平板为对照组,每个处理重复3次,置于恒温28℃环境下培养。5天后观察是否出现抑菌带,记录抑菌带大于5 mm的菌株,分别为MJ1-1、MJ7-2、MJ5-1。
采用菌丝生长速率法复筛生防菌。将上述有拮抗效果的细菌接于LB液体培养基中,放入摇床中150r/min保持适温培养24 h,取发酵菌液8000 r/min离心10 min,用移液枪将上清液转至灭菌的EP管中(用0.22 μm的微孔滤膜过滤)。将初筛拮抗菌液与PDA培养基按体积1:19均匀混合倒入培养皿中至冷却。取病原菌置于上述PDA平板中央,设不加拮抗发酵液的PDA平板为对照组,每个处理重复3次,置于恒温28℃环境下培养,5天后记录病原菌菌落的直径[10-13]。
1.7 拮抗菌的鉴定
1.7.1 形态鉴定 取纯化后的菌株置于LB平板上,保持恒温30℃培养24 h,待长出纯菌落,根据菌落的形态、颜色、LB平板颜色等进行形态特征的鉴定。
1.7.2 基因组DNA鉴定 以细菌基因组DNA提取试剂盒(上海生工)提取拮抗菌DNA,放置-20℃保存。选取16SrRNA基因通用引物27F(AGAGTTTGATCCTGGCTCAG)和 1492R(TACGGCTACCTTGTTACGACTT)进行PCR扩增,PCR反应总体系为50 μL:引物27F和1492R各2 μL、10×buffer 5 μL、dNTP 2 μL、Taq酶 1 μL、MgCl25 μL、蒸馏水33 μL。PCR扩增条件:94℃ 5 min,94℃ 30 s→56℃ 30 s→72℃ 1 min,共设35个循环;72℃延伸10 min,4℃保存。扩增产物用1.0%的琼脂糖凝胶电泳,于计算机上观察其成像显示结果并记录[14]。PCR产物送至昆明擎科测序公司进行纯化和测序。
2 结果与分析
2.1 田间症状
受害墨兰根部从根基和茎基部开始发病,直至整个根部,导致根部皮层坏死,表皮与皮层分离,木质部微褐变,地上部分从苗心开始出现枯死症状(图1)。

图1 墨兰人工种植多年根腐病及地上部分枯萎症状
2.2 分离菌株的致病性
对发病墨兰上分离到的5株真菌进行致病性的测定,发现仅ML6-1菌株具致病性。以ML6-1菌株接种的离体墨兰根部均发病(图2)。盆栽2年生墨兰针刺和烫伤接种3天时根上有明显的变色病斑,初期呈暗褐色,扩大后根部略带凹陷,变成黄褐色;喷洒菌丝悬浮液接种5天时,根部发生变色,出现病斑;15天时地上部分植株出现枯萎现象;30天时整株幼苗枯死,根部皮层全部出现腐烂症状(图3)。取腐根处进行病原物的分离纯化,获得的菌株进行形态观察和分子生物学鉴定,发现与ML6-1菌株完全相同。
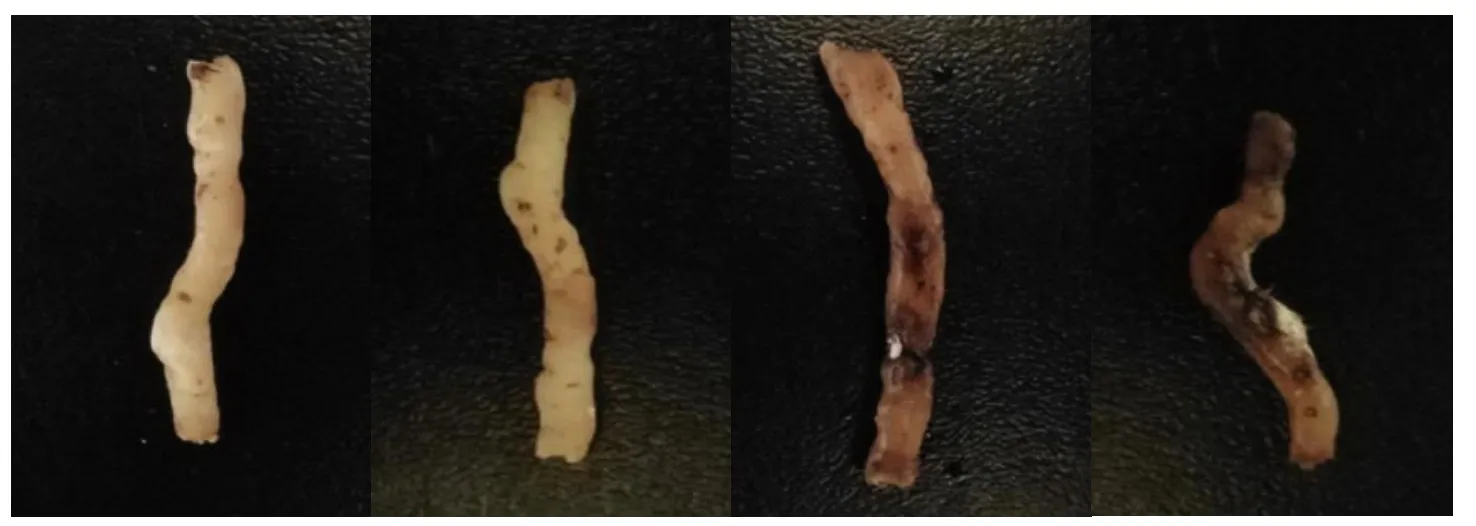
图2 回接病原腐皮镰刀菌(Fusarium solani)ML6-1的发病症状

图3 喷洒ML6-1菌丝悬浮液后的墨兰发病初期
2.3 分离菌株形态学鉴定
ML6-1菌株接种到PDA培养基上,25℃条件下培养5天时,菌落呈圆形,中间凸陷,气生菌丝白色,毛毡状。引起墨兰根腐病的病原为镰刀菌一种(Fusarium sp.),病菌的产孢组织多为分生孢子座,它的分生孢子有丝状和长椭圆形2种类型(图4)。当环境不利时,在腐烂的植物组织内会产生大量的厚垣孢子,细胞壁增厚在不良环境中生长[15-16]。
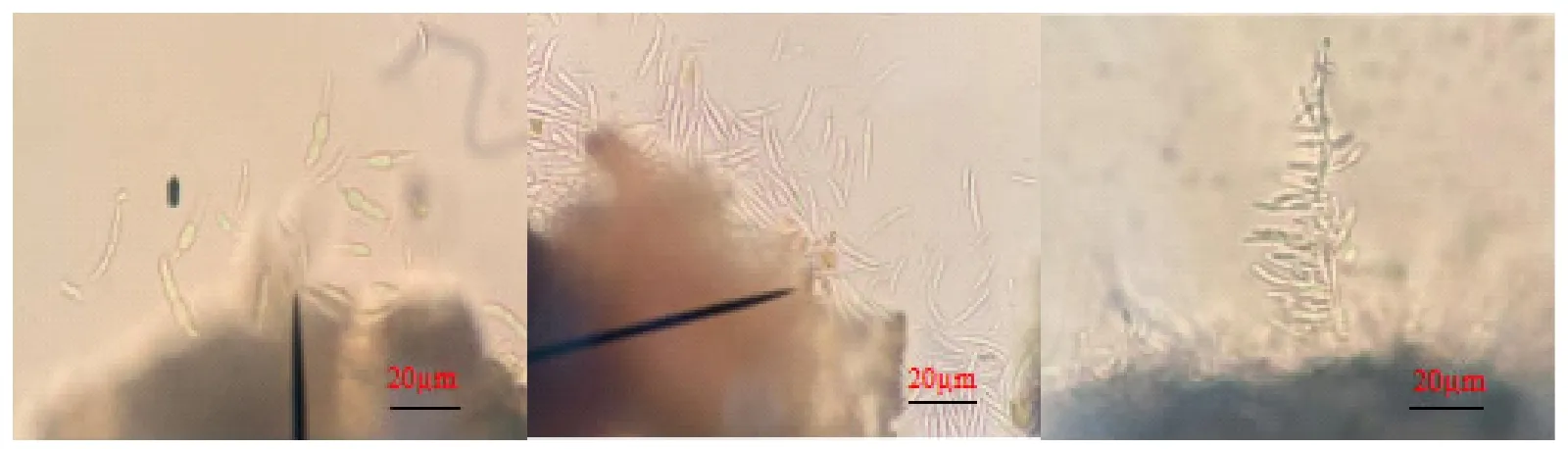
图4 墨兰典型根腐病症状分离菌株ML6-1的形态学特征
2.4 分离菌株分子鉴定
对ML6-1菌株基因组种扩增得到的产物进行测序,得到的序列在GenBank数据库中搜索比对,发现其ITS序列与GenBank中登录号为MT529222d腐皮镰刀菌(Fusarium solani)相应序列一致性达到99%(图5),覆盖度达98%。系统发育树结果显示,ML6-1与ML2-1与腐皮镰刀菌聚为一支,由此推测,造成墨江人工栽培基地墨兰根腐病的致病菌株ML6-1为腐皮镰刀菌(Fusarium solani)。
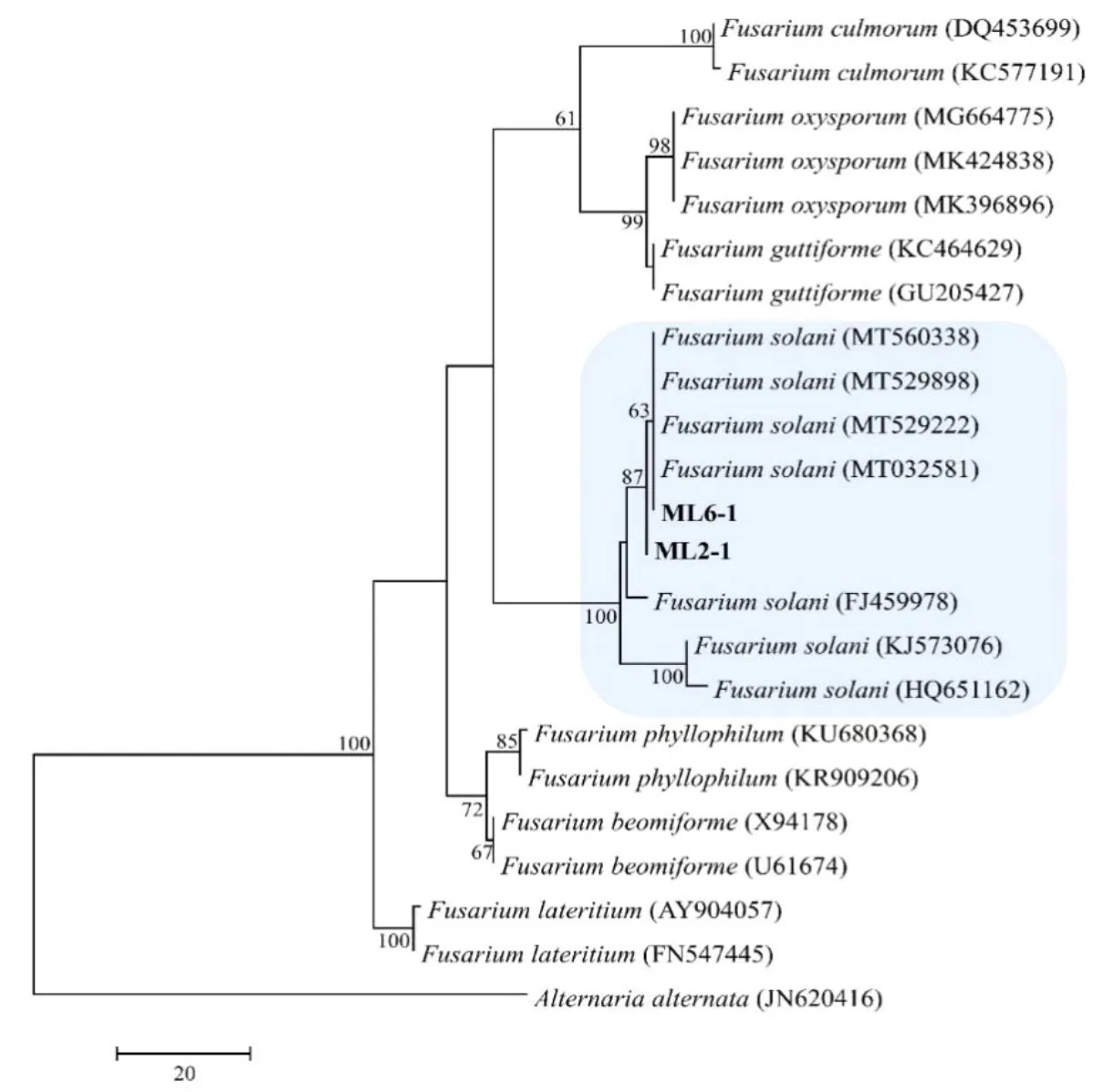
图5 采用PAUP*4.0b10MP法建立的墨兰根腐病病原菌ITS序列的分子系统进化树
2.5 拮抗菌的筛选和分离
以上述试验分离得到的墨兰根腐病原菌(Fusarium solani)为指示菌,以从野外墨兰根际土壤分离得到的细菌为待测菌,将分离纯化的待测菌按平板对峙法进行初筛,确定有拮抗效果的3株菌株分别为MJ1-1、MJ7-2、MJ5-1。之后将这3株菌株用发酵法进行复筛,结果显示MJ5-1菌株的拮抗效果最强。
2.6 拮抗菌株MJ5-1的分子鉴定及16S rRNA基因的PCR扩增结果
提取菌株MJ5-1的DNA进行分子鉴定,将测序得到的序列在GenBank数据库中比对。发现菌株MJ5-1与GenBank中登录号为MK521055.1短小芽孢杆菌(Bacillus pumilus)菌株的同源性达到99%。根据分类标准,可判断属于同一个种。结合形态可确定墨兰根腐病的拮抗菌MJ5-1为短小芽孢杆菌(Bacillus pumilus)。
试验以细菌基因组提取试剂盒提取目的菌株的DNA,用27F和1492R引物对其进行PCR扩增,得到稳定、清晰的条带,扩增出的片段大小为1500 bp(图6)。
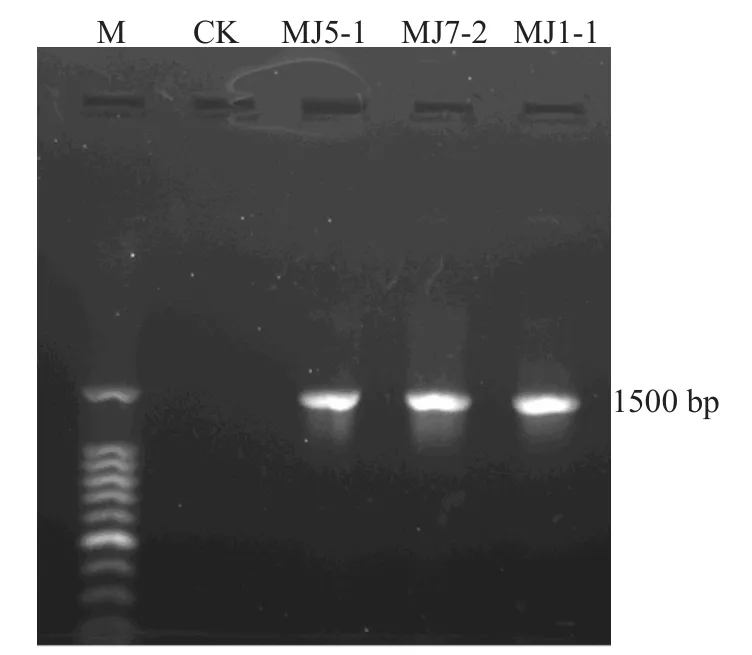
图6 菌株MJ1-1、MJ7-2、MJ5-1的16S rRNA电泳图谱
2.7 拮抗菌株MJ5-1的拮抗作用分析
采用平板对峙法,研究短小芽孢杆菌MJ5-1对墨兰根腐病原菌的拮抗作用。由表1可知,短小芽孢杆菌MJ5-1对墨兰根腐病致病菌有较好的拮抗作用,短小芽孢杆菌对墨兰根腐病致病菌的抑菌率均高于95%。表明短小芽孢杆菌MJ5-1是1株针对墨兰根腐病害的高效生防菌株。MJ1-1、MJ7-2、MJ5-1在对腐皮镰刀菌(Fusarium solani)的抑菌试验中出现抑菌圈,图7是MJ5-1对病原菌的抑菌效果图,比较抑菌圈直径,以上3株芽孢杆菌属菌株对腐皮镰刀菌(Fusarium solani)的抑菌效果均达到显著性差异,其中MJ5-1差异极显著(表1)。
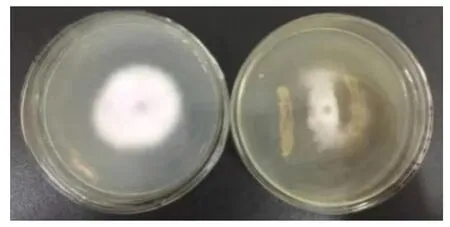
图7 拮抗菌短小芽孢杆菌MJ5-1与菌株ML6-1平板对峙结果
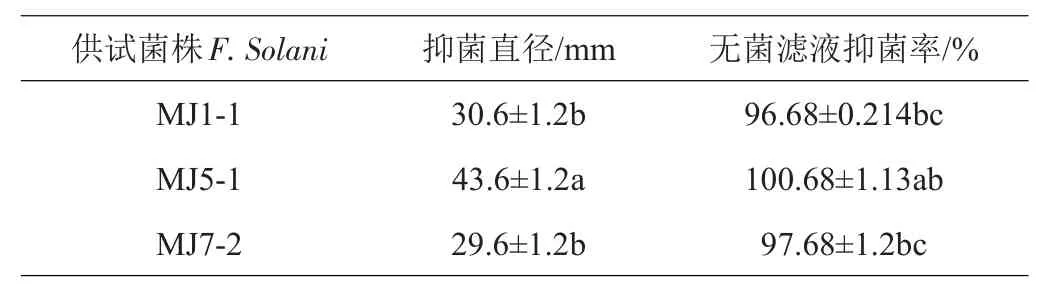
表1 短小芽孢杆菌对墨兰根腐病病原真菌的抑菌直径和抑菌率
3 讨论
墨兰根腐病是发生在云南墨江种植基地上的一种新病害,目前还未见相关报道。本研究通过对墨兰病原菌的分离培养、致病性测定以及形态学鉴定和分子鉴定,确定了墨江墨兰种植基地墨兰根腐病的致病菌为腐皮镰刀菌(Fusarium solani)。腐皮镰刀菌在真菌分类系统中属于瘤座孢科(Tuberculariaceae)镰刀菌属(Fusarium),有性阶段属于肉座菌科(Hypocreaceae)丛赤壳属(Nectria)[17-20]。镰刀菌属真菌的分布非常广泛,能侵染多种植物发生根腐病或茎腐病,严重影响植物的生长和产量[21-23]。比如尖孢镰刀菌引起北京地区草莓枯萎病的发生[24];能引起不同木薯品种不同程度的根腐病发生[25];赵彩呈等[26]报道了重楼和白芨的根腐病及李欣等[8]报道的三七根腐病等。以上研究着重于病害症状以及发生规律,对病原本身的特征无相关报道。本研究首次从大棚人工栽培的墨兰中分离致病菌,并对致病菌进行了形态学和分子学的鉴定,确定了引起墨江墨兰人工栽培根腐病大量流行的主要病原菌是镰刀菌属真菌,研究了该病的发生规律,为该病害防治提供了有效的理论依据。同时,本研究还筛选出1株能高效抑制墨兰根腐病病原菌的拮抗菌,为短小芽孢杆菌(Bacillus pumilus)MJ5-1。该菌株分离自自然状态的墨兰植株根际土壤,经过检测并无致病性,而且还具有较稳定有效的生防保护作用。由于芽孢杆菌属(Bacillus)对真菌的拮抗作用较好,常被作为生防菌研究报道。如周盈等[27]报道了1种枯草芽孢杆菌BSn5能产生抑菌蛋白APn5,并对胡萝卜软腐欧文氏菌具有较好的拮抗效果,但该菌生防作用较单一;而陈琼珍等[28]研究的枯草芽孢杆菌只对红镰刀菌有较好的生防作用。目前,关于芽孢杆菌的研究多见于抑制植物病害病原的生长[29],对墨兰根腐病病原抑菌效果鲜见报道。王英国等[30]分离到1株含抗菌多肽物质的芽孢杆菌,对尖孢镰刀菌、毛霉和黑曲霉等多种真菌有较强的拮抗性;勾长龙等[31]发现1株芽孢杆菌HB-3对人参根腐病病原菌产生较强的拮抗性。同时,还有关于芽孢杆菌对柑橘绿霉病的生防作用的相关研究等。而本研究筛选了墨兰根腐病的拮抗菌,发现短小芽孢杆菌(Bacillus pumilus)有较好的拮抗作用,是一类有效生防菌,这为墨兰根腐病的生防措施提供了理论基础。
本研究基于ITS序列对真菌进行分子鉴定,基于16S rRNA基因对细菌进行分子鉴定,由于物种的种属间具有较高的相似性,核糖体基因序列过于保守而无法区分亲缘关系较近的物种,要明确镰刀菌及芽孢杆菌准确分类地位,可基于多位点序列分析(multilocus sequence analysis,MLSA),如联合分析 TUB2、LSU 及EF1-α等基因对镰刀菌进行多序列分析,分析gyrB和rpoB对细菌做出准确的鉴定。
