家蚕鞣化激素基因对翅展及繁殖力的调控作用
2021-07-07杨佳鹏龙贵云金道超戴仁怀吴丽红杨熙彬
杨佳鹏, 龙贵云, 金道超, 戴仁怀, 吴丽红, 周 操, 杨熙彬
(贵州大学昆虫研究所, 贵州山地农业病虫害重点实验室, 农业农村部贵阳作物有害生物科学观测试验站, 贵阳 550025)
鞣化激素(Bursicon)是Fraenke和Hsiao(1962)在红头丽蝇Calliphoraerythrocephala上首次发现的由2个高度保守的α和β亚基组成的一类异源二聚体神经肽。近年的研究相继从直翅目、鞘翅目、鳞翅目、双翅目、半翅目以及膜翅目中鉴定出鞣化激素基因。鞣化激素基因的功能研究主要集中在昆虫表皮的发育及其黑化硬化、翅的成熟和延展、预防性免疫、肌肉收缩以及卵子边缘细胞的迁移等方面(朱斌等, 2014; 弓慧琼等, 2018)。例如,利用双杂交系统UAS-GAL4研究果蝇Drosophila鞣化激素基因的功能发现,鞣化激素基因突变后,果蝇的翅不能正常伸展(Luanetal., 2006; Anetal., 2008);利用RNAi技术,干扰家蚕Bombyxmori鞣化激素基因Burs-α和Burs-β后均出现了翅褶皱的表型(Huangetal., 2007; Kobayashietal., 2012)。在家蚕翅发育的研究中,从翅芽的产生到发育成熟延展期间,Hippo, Dpp和Wnt等信号通路各自起着不同的调控作用(Zeccaetal., 1995; Neto-Silvaetal., 2009; Panetal., 2018)。例如敲除Hippo信号通路中的Approximated基因后,家蚕出现翅展畸形的现象,且翅发育相关基因Four-jointed(Fj)和Wingless(Wg)的表达显著下调,表明了Hippo信号通路对家蚕的翅展不可或缺(Yuetal., 2018)。除此之外,在鞣化激素基因调控繁殖力的研究中,研究者通过注射鞣化激素基因重组蛋白,检测到了鞣化激素可刺激黑虎虾卵黄原蛋白(vitellogenin)基因Vg的表达(Sathapondechaetal., 2015),推测了鞣化激素在节肢动物繁殖中的功能。
然而,在家蚕中鞣化激素与翅发育相关基因的联系目前在现有的研究中未见报道,鞣化激素对其繁殖力是否有影响也未知。为明确鞣化激素与家蚕翅发育相关基因的关系以及在家蚕繁殖力中的作用,本研究以家蚕为对象,通过体外合成鞣化激素2个亚基基因的dsRNA(dsBmBurs-α和dsBmBurs-β),注射到家蚕蛹体内,干扰BmBurs-α和BmBurs-β的表达,探明鞣化激素调控家蚕翅展的信号通路及其对家蚕繁殖力的影响,为系统地研究鞣化激素功能提供参考。
1 材料与方法
1.1 供试昆虫
本研究所用的家蚕(两广2号)由江苏省常州市新北区魏村蚕农提供。将所得的白色家蚕卵块置于气候箱内一次性方形塑料盒(15 cm×8 cm×5.5 cm)内孵化,用新鲜桑叶饲养至结茧化蛹的蚕蛹。饲养条件:温度25℃±1℃,相对湿度70%±10%,光周期16L∶8D。
1.2 dsRNA的合成
从NCBI(www.ncbi.nlm.nih.gov)数据库中下载家蚕鞣化激素基因BmBurs-α(GenBank登录号: NM_001098375.1)和BmBurs-β(GenBank登录号: NM_001043824.1)序列,用Primer Premier 6.0软件设计引物(表1),并送上海生物工程有限公司合成。挑选家蚕幼虫,参照HP Total RNA Kit(Omega Bio-Tek, Norcross, GA, 美国)试剂盒说明书提取总RNA,并采用HiFiScript cDNA第1链合成试剂盒(CW Bio, 杭州)合成cDNA。以家蚕cDNA为模板,采用PCR体外扩增家蚕BmBurs-α和BmBurs-β,以GFP 质粒为模板,采用PCR体外扩增GFP。反应体系: 正反向引物(10 μmol/L)各1 μL, 模板1 μL, 2×San Taq PCR Mix(With Blue Dye)10 μL, DEPC处理水10 μL。PCR扩增程序: 95℃预变性3 min; 95℃变性30 s, 55℃或65℃退火1 min, 72℃延伸1 min, 35个循环; 72℃延伸5min。使用SanPrep柱式PCR产物纯化试剂盒(Sangon Biotech, 上海)对扩增产物进行纯化,用NanoDrop 2000(Themo Fisher Scientific Inc, 美国)测定纯化产物的浓度,参照试剂盒TranscriptAid T7 High Yield Transcription Kit(Themo Fisher Scientific Inc, 美国)合成dsRNA,检测其合成的浓度,并将其于-80℃冰箱冷冻,待用。
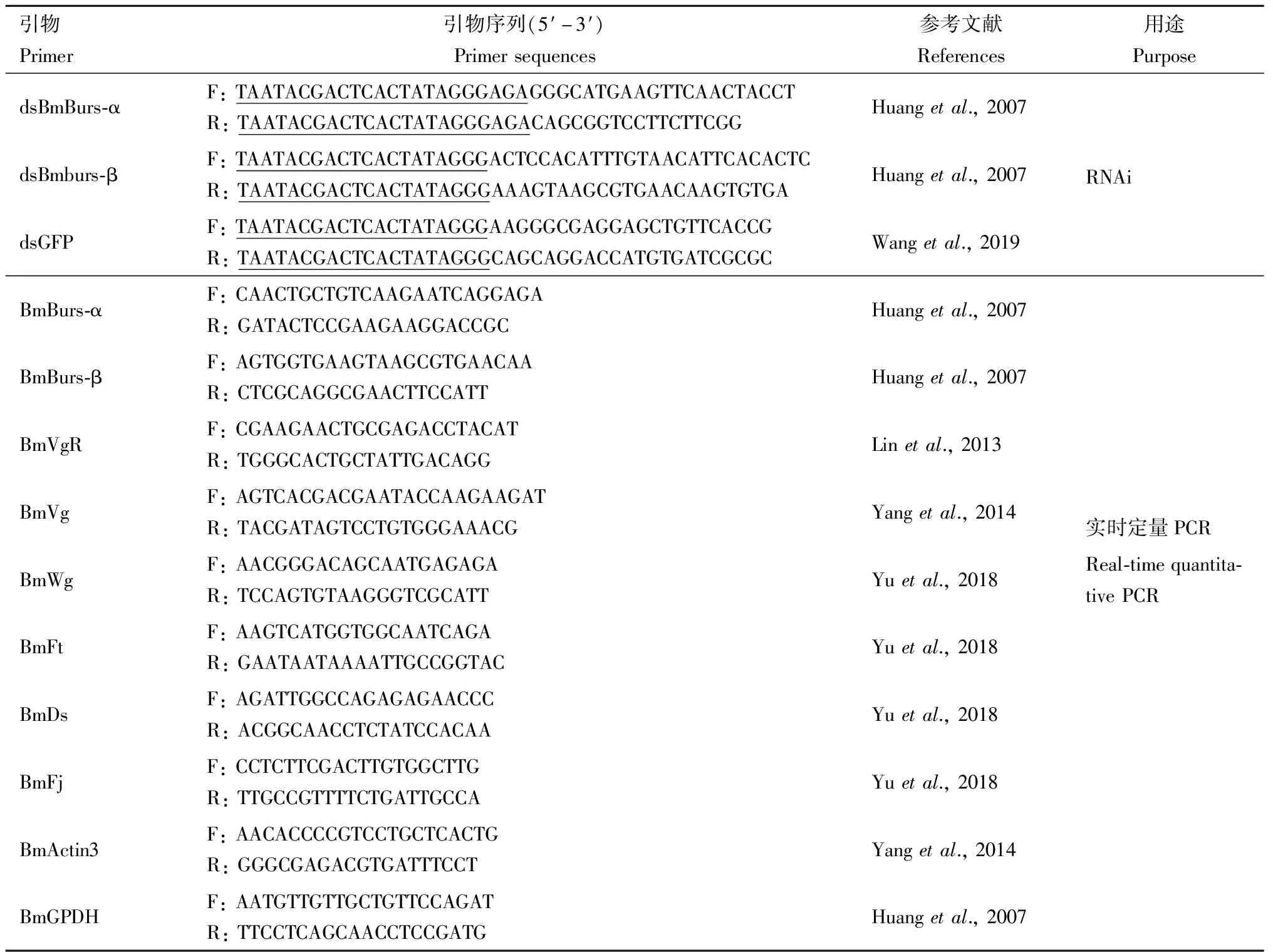
表1 本研究所用的引物
1.3 RNAi实验
选取家蚕1日龄蛹,在蛹的胸部和腹部分界处用微量注射器(Sangon Biotech, 上海)分别注射dsBmBurs-α, dsBmBurs-β和dsBmBurs-α+dsBmBurs-β,每头蛹注射10 μL(约20 ng)dsRNA;以注射等量的dsGFP作为对照(Wangetal., 2019)。每处理设3个生物学重复,每个生物学重复为15头蛹,其中10头用于1.4节表型观察及产卵量统计,5头用于1.5节实验的取样。注射完后置于气候箱内饲养,相对湿度为70%±10%,温度为25℃±1℃,光周期为16L∶8D。
1.4 表型观察及产卵量统计
对1.3节RNAi处理后羽化24 h的家蚕的表型进行观察,用佳能D500EOS 5D MACRO 100 mm镜头(Canon Inc., 日本)拍摄记录家蚕表型的变化。对各注射处理后羽化出的30头雌雄成虫在气候箱内进行交配后,雌蛾单头饲养,每隔24 h定时观察1次,对单头雌蛾的产卵量进行统计,直到雌成虫死亡。每3头雌蛾的产卵量为一个重复,每处理3个重复。
1.5 实时荧光定量PCR检测家蚕基因表达
分别对1.3节RNAi注射处理后48, 72和96 h的单粒家蚕蛹以及每个处理组羽化后24 h雌雄成虫各1头进行液氮速冻取样,参照HP Total RNA Kit(Omega Bio-Tek, Norcross, GA, 美国)提取总RNA。以提取的家蚕总RNA为模板,采用HiFiScript cDNA第1链合成试剂盒(CW Bio, 杭州)按照说明书操作步骤合成cDNA,于-20℃冰箱中保存备用。
根据研究报道,检索家蚕翅发育相关基因BmFt,BmDs,BmWg和BmFj以及产卵相关基因卵黄原蛋白基因BmVg和卵黄原蛋白受体(vitellogenin receptor)基因BmVgR(Linetal., 2013; Yuetal., 2018),根据序列合成相应的实时荧光定量PCR引物(表1)。以cDNA为模板,以家蚕BmActin3和BmGPDH为内参基因(Huangetal., 2007; Yangetal., 2014),参照Fast Start Essential DNA Green Maste(Roche, 瑞士)试剂盒进行,PCR反应体系: FastStart Essential DNA Green Master 5 μL,正反向引物(10 μmol/L)各1 μL, cDNA 1 μL, 加RNase-free Water 2 μL。震荡混匀,短暂离心,放入实时荧光定量PCR仪中进行qPCR。PCR反应程序: 95℃预变性10 min; 95℃变性30 s, 55℃退火并延伸30 s, 共40个循环。熔解曲线在65-95℃进行。分别检测RNAi处理48, 72和96 h后家蚕BmBurs-α,BmBurs-β,BmVg和BmVgR的表达动态以及羽化24 h家蚕翅发育相关基因BmFt,BmDs,BmWg和BmFj的相对表达量。每处理和对照均测定3个样品,每样品进行3次技术重复。
1.6 数据分析
以测得的Cq值采用2-ΔΔCt法(Livak and Schmittgen, 2001)检测各基因的相对表达量,计算公式(Heetal., 2018)为:2-[(Cq 干扰组基因-Cq内参基因)-(Cq对照组基因-Cq内参基因)],其中Cq内参基因为每个样品中2个内参基因Cq值的平均值。采用SPSS 20.0进行统计分析,选用Duncan氏法做显著性检验,设置显著水平为α=0.05,最后用Microsoft Excel 2010软件作图。
2 结果
2.1 干扰鞣化激素基因对家蚕表型和产卵量的影响
与对照组相比,注射dsBmBurs-α, dsBmBurs-β和dsBmBurs-α+dsBmBurs-β后羽化24 h的家蚕的翅均呈现出卷曲、褶皱的畸形,不能正常伸展,翅畸形率分别为93.33%, 96.67%和96.43%(图1)。

图1 Bursicon 基因RNAi后家蚕羽化24 h成虫的表型
如图2所示,注射dsBmBurs-α, dsBmBurs-β以及dsBmBurs-α+dsBmBurs-β后,家蚕的平均单雌产卵量分别为312.67, 332.00和284.00粒,显著低于对照组的406.00粒(P<0.05)。且当dsBmBurs-α+dsBmBurs-β组合干扰时对家蚕的单雌产卵量的影响显著高于单独干扰其中任何一个基因。但注射dsBmBurs-α和注射dsBmBurs-β两处理之间的单雌产卵量无显著差异(P>0.05)。说明干扰Bursicon对家蚕的繁殖力有显著的抑制作用,且组合干扰的效果优于单个基因的干扰效果。

图2 Bursicon基因RNAi后对家蚕成虫单雌产卵量的影响
2.2 干扰鞣化激素基因后家蚕相关基因的表达
与对照相比,干扰Bursicon 基因48, 72和96 h后,BmBurs-α(图3: A)和BmBurs-β(图3: B)的表达量均显著下调(P<0.05),干扰效率均在55.67%以上,最高达96.67%。RNAi处理后羽化24 h的家蚕翅发育相关基因BmWg,BmFt,BmFj和BmDs在3个不同干扰组的表达均显著低于对照组(P<0.05)(图4)。BmFj,BmWg和BmDs的表达量在鞣化激素基因干扰后下调90%以上;注射dsBmBurs-α, dsBmBurs-β和dsBmBurs-α+dsBmBurs-β后BmFt的相对表达量分别下调34.33%, 94.67%和98.67%,可看出注射dsBmBurs-β和dsBmBurs-α+dsBmBurs-β对BmFt表达的影响显著高于单独注射dsBmBurs-α(P<0.05)。为探索Bursicon在繁殖上的功能,我们还检测了在干扰Bursicon后BmVg和BmVgR的转录水平,结果显示,BmVg和BmVgR的相对表达量均显著低于对照组(P<0.05),且对BmVg的抑制效果达90%以上(图5: A);dsBmBurs-α和dsBmBurs-α+dsBmBurs-β处理48 hBmVgR的相对表达显著高于注射dsBmBurs-β的处理组(P<0.05),dsBmBurs-α+dsBmBurs-β处理72 hBmVgR的相对表达量显著高于dsBmBurs-α和dsBmBurs-β处理组(P<0.05),dsBmBurs-α和dsBmBurs-β处理间无显著差异(P>0.05)(图5: B)。

图3 家蚕Bursicon基因的RNAi干扰效率

图4 Bursicon基因RNAi后对家蚕羽化24 h成虫翅发育相关基因表达的影响

图5 Bursicon基因RNAi后对家蚕蛹卵黄原蛋白基因(BmVg)(A)和卵黄原蛋白受体基因(BmVgR)(B)表达的影响
3 讨论
Bursicon是一种异源二聚体神经肽,在昆虫表皮鞣化、翅展和免疫方面均承担着重要的作用。本研究采用注射法,将体外合成的家蚕Bursicon基因的dsRNA(dsBmBurs-α, dsBmBurs-β和dsBmBurs-α+dsBmBurs-β)分别注射到家蚕1日龄蛹体内以干扰Bursicon基因的表达。结果发现,无论是单独处理注射dsBmBurs-α或dsBmBurs-β,还是dsBmBurs-α+dsBmBurs-β组合干扰,家蚕体内Bursicon-α和Bursicon-β的转录水平均显著下调(图3),且在干扰Bursicon基因后,羽化的家蚕翅出现卷曲、褶皱的畸形,翅面不能进行正常展平(图1),发育受到抑制,说明了,Bursicon对家蚕翅展具有不可或缺的作用。
在昆虫翅的形成和发育的过程中,主要由Dpp信号通路、Hippo信号通路以及Wnt等信号通路通过共同作用、互相协调来决定昆虫翅的最终发育形态(Irvine and Rauskolb, 2001; Wangetal., 2016)。尤其是Hippo信号通路在动物的组织发育过程中起着重要的作用(Zhangetal., 2009)。Zecca和Struhl(2010)的研究表明,在果蝇中Hippo通路上的形成素Wingless通过激发fat-dachsous信号和Yorkie的活性进而促使翅的发育。在翅发育受到抑制时,这些基因的表达出现了不同程度的下调。在本研究中,干扰Bursicon基因表达后,家蚕翅面不能进行正常展平,发育受到抑制,BmWg,BmFt,BmFj和BmDs的相对表达量显著降低(图4)。与此相似,在Yu等(2018)通过CRISPR/Cas9技术对Bmapp基因进行特异性的基因敲除,使家蚕翅发育畸形后,检测到了Hippo信号通路上BmWg和BmFj的表达受到显著的抑制;在此之后,Yin等(2020)也证实在敲除BmSd家蚕翅变小后,BmWg的表达也显著下调。因此,我们推测,Bursicon能够调控Hippo信号通路上某些基因的表达,进而影响家蚕翅的伸展及发育,但这一过程是如何进行的仍需进一步的研究。
在昆虫繁殖过程中,卵黄原蛋白及其受体在昆虫卵母细胞成熟和繁殖过程中起主导作用(Goldsteinetal., 1979; Sappingtonetal., 1995)。如,在沉默烟粉虱Bemisiatabaci的卵黄原蛋白受体基因后,其雌蛾繁殖力显著降低(Upadhyayetal., 2016);同样在干扰褐飞虱NilaparvatalugensVgR的表达后导致其卵巢停止了发育(Luetal., 2015)。Bursicon不仅能调控昆虫翅发育,而且在繁殖方面可能也起着重要作用。例如,在果蝇中发现,Bursicon受体介导的信号传导能影响果蝇卵子边界细胞的分离和迁移,进而能影响卵孔的产生(Anllo and Schüpbach, 2016);同时,Tsutsui等(2020)等通过转录组分析发现Bursicon基因在日本对虾Marsupenaeusjaponicus卵巢中高表达,更加印证了Bursicon在繁殖功能方面的潜力。在本研究中,干扰Bursicon基因可显著抑制家蚕卵黄原蛋白及其受体基因(BmVg和BmVgR)的表达,相比对照组,干扰Bursicon基因后家蚕的产卵量(未包含产卵管中的残留卵粒)显著降低(图2),这可能是由于Vg和VgR的表达受限,卵母细胞的发育受阻,从而导致其产卵量减少。Sathapondecha等(2015)利用体外合成黑虎虾Bursicon蛋白注入黑虎虾内,发现Bursicon重组蛋白能促使黑虎虾卵黄原蛋白基因Vg高表达,刺激卵巢的发育。因此推测,家蚕Bursicon可能通过直接或者间接调节卵黄原蛋白及其受体基因的表达,进而影响家蚕卵巢发育,来参与调控家蚕的繁殖。
猜你喜欢
杂志排行
昆虫学报的其它文章
- 利用CRISPR/Cas9系统检测果蝇细胞中组蛋白甲基化修饰对20E信号传导的调控
- 孤雌产雌生殖品系松毛虫赤眼蜂产卵强度对Wolbachia诱导的其生殖表型的影响
- 基于F3Net显著性目标检测的蝴蝶图像前背景自动分割
- Biology and management of the litchi stink bug, Tessaratoma papillosa(Hemiptera: Tessaratomidae):Progress and prospects
- 朱砂叶螨硒代谢通路基因筛选及硒磷酸合成酶TcSPS1的原核表达和特性分析
- 球囊菌侵染对意大利蜜蜂幼虫肠道免疫与解毒相关基因表达及蛋白质、脂质和糖类含量的影响
