红壤性水稻土-上覆水系统毒死蜱消解的室内模拟实验
2021-07-03姚莹雷唐翔宇耿春女关卓任美
姚莹雷,唐翔宇,耿春女,关卓,任美
(1.上海应用技术大学生态工程与技术学院,上海201418;2.中国科学院水利部成都山地灾害与环境研究所,成都610041)
毒死蜱(Chlorpyrifos)化学名称为O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯,又名氯吡硫磷,也称乐斯本、蚁定清等,属于非内吸性广谱有机磷杀螨、杀虫剂,具有高效、广谱、中等毒性的特点[1]。其在农田土壤中的降解受到温度、微生物、光照等因子的影响,在土壤中的半衰期为6.3 h~100 d[2-3]。3,5,6-三氯-2-吡啶醇(3,5,6-trichloro-2-pyridinol,TCP)是母体毒死蜱在环境中的主要降解产物,水溶性强,同母体化合物相比,其迁移性更强,毒性更高[4-5],残留期更久[6]。
作为稻田害虫防治的主要农药品种之一,毒死蜱的施用时间大多在每年的春夏[7],可通过地表径流或田面主动排水进入河流湖泊,从而造成水体污染[8]。毒死蜱对水生生物的危害较大,对两栖类动物[9]、大型植物[10]和节肢动物[11]等的毒性已有较多研究。有研究报道,太湖流域水体毒死蜱的浓度区间为nd(未检出)~13.6μg·L-1,平均值达4.8μg·L-1[12]。农药在田间施用后约10%作用于作物,80%~90%将最终进入土壤[13-14]。稻田中施用毒死蜱后,其在田面水中的浓度随时间迅速下降,至第3 d可降低90%以上[15]。毒死蜱在农田中的消解过程受多重因素的影响,除了被土壤吸附[16-18]以外,主要是被微生物降解[4,19-20]。前人对受纳水体中毒死蜱污染进行了研究,但其未能充分关注到农药的输出峰值特征[21-24]。目前,对于稻田环境中毒死蜱的迁移转化动态规律、归趋特征及其影响因子尚缺乏系统性认识。
本文以南方丘陵区分布广泛的红壤性水稻土为供试土壤,通过室内模拟培养实验,分析毒死蜱在水稻土-上覆水系统中的消解与转化动态,以期阐明稻田中毒死蜱的归趋特征以及温度、微生物对其影响规律,为毒死蜱的安全使用及污染防控提供科学依据。
1 材料和方法
1.1 供试材料
1.1.1 药品与试剂
毒死蜱(99.99%)和3,5,6-TCP(99.99%)的结构式见图1,标准品购自美国Sigma-Aldrich公司;毒死蜱乳油(有效含量40%)购自天津市华宇农药有限公司;甲醇(分析纯)和乙酸乙酯(色谱纯)购自赛默飞世尔科技(中国)有限公司;石油醚(分析纯)购自成都市科隆化学品有限公司。
1.1.2 实验仪器
气相色谱仪配火焰光度检测器(7890A,美国Agilent公司);高效液相色谱配紫外检测器(1260,美国Agilent公司);生化培养箱(SHP,北京中兴伟业仪器有限公司);水浴氮吹仪器(WD-12,杭州奥盛仪器有限公司);旋转蒸发仪(R-3HB,瑞士BUCHI公司);pH计(Senslon+MM150,美国Hach公司);冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司);超声波清洗器(KQ-500DE,昆山市超声仪器有限公司)。
1.2 土壤样品采集及处理
在中国科学院鹰潭红壤生态实验站附近(江西省余江县刘家站鲁王村,116°55′42″E,28°12′21″N)选取一块红壤发育的长期稻田,取耕作层(0~20 cm)土壤,运回实验室后,置于阴凉处自然风干后磨碎,过2 mm筛待用。取一半过筛土壤在121℃、0.115 MPa条件下高压蒸汽灭菌1 h。以灭菌土壤和未灭菌土壤作为本实验的供试土壤,土壤pH值5.20,有机质含量2.13%,阳离子交换量9.46 cmol·kg-1。
1.3 模拟培养实验
设3个不同培养温度:15、25、40℃。将供试土壤(灭菌和未灭菌)分别加入玻璃培养管中,土厚10 cm,上覆超纯水厚度5 cm。此外,灭菌土壤处理的上覆水中加入浓度为0.1 g·L-1NaN3(抑菌剂),管口覆盖锡箔纸(避免水分过快蒸发)。实验开始前将培养管置于生化培养箱中预培养1个月,以尽可能达到并模拟淹水期稻田的平衡条件。
完成预培养后,添加毒死蜱至培养管中,使其上覆水初始浓度为285.22μmol·L-1左右(模拟农药超量施用的情况,为推荐施用量的4倍),于加药后0.5、2、12 h,1、4、8、16、24、48 d和60 d采集上覆水和土壤样品(分0~3、3~6、6~9 cm 3个深度),重复2次。
1.4 样品处理
上覆水:取2 mL水样,加入4 mL石油醚,300 W超声处理20 min,吸取上清液,重复提取3次,将3次上清液混合,用旋转蒸发仪将上清液浓缩至近干;对于分析毒死蜱的样品,用色谱纯乙酸乙酯定容至1 mL,用0.22μm聚四氟乙烯滤膜过滤于进样瓶中,保存于4℃冰箱中待测;对于分析TCP的样品,取1 mL水样用聚四氟乙烯滤膜过滤后,保存于4℃冰箱中待测。
水中毒死蜱的加标回收率为53%~71%,其校准曲线的线性范围为0.05~25μg·L-1(相关系数为0.997),检出限为0.04μg·L-1。TCP的加标回收率为90%~114%,其校准曲线的线性范围为0.125~25μg·L-1(相关系数为0.998,检出限为0.12μg·L-1,定量限为0.40μg·L-1)。
土壤:将土壤样品冷冻干燥后研磨混匀,称取2 g,加入20 mL乙酸乙酯后涡旋10 s混匀,300 W超声处理20 min后,4 000 r·min-1离心5 min,吸取上清液,再次添加10 mL乙酸乙酯进行提取,而后将两次上清液混合,旋蒸浓缩至近干,用乙酸乙酯定容至1 mL,用0.22μm聚四氟乙烯滤膜过滤于进样瓶中待测。该方法的加标回收率为91%~105%,线性范围:0.005~2.5 mg·kg-1(相关系数为1.000),检出限:0.002 5 mg·kg-1,定量限为0.008 3 mg·kg-1。
1.5 样品分析
采用气相色谱仪分析上覆水和土壤中毒死蜱含量,色谱条件:HP-5柱(30μm×0.32μm×0.25μm);载气(高纯N2)流量:1 mL·min-1,H2流量:75 mL·min-1,高纯空气流量:100 mL·min-1;尾吹气流量:60 mL·min-1;升温条件:50℃(1 min)→30℃(1 min)→180℃(1 min)→10℃(1 min)→250℃(15 min);进样口:250℃,检测器:250℃;不分流,自动进样,进样量:1 μL,出峰时间:8.4 min左右。标准曲线线性范围:1~10 mg·L-1(R2≥0.999)。
采用高效液相色谱仪分析TCP含量,色谱条件:Eclipse C18柱,4.6 mm×150 mm(5μm);流动相:甲醇-水(体积比80∶20),水相加入体积比为0.015%的冰乙酸;等度洗脱,流量:1.0 mL·min-1;进样量:10 μL;柱温:30℃;紫外检测波长:293 nm,出峰时间:3.4 min左右。标准曲线线性范围:1~10 mg·L-1(R2≥0.999)。
1.6 数据分析
采用SPSS17.0对毒死蜱和TCP浓度的时间变化曲线进行拟合。
2 结果与分析
2.1 上覆水中毒死蜱的消解动力学
上覆水中毒死蜱的消解变化见图2。所有处理中,毒死蜱均在前期快速消解,随着加药后时间的延长,消解的速率逐渐变慢。其主要原因可能是毒死蜱在水中溶解度低(25℃时溶解度为2.0 mg·L-1),Kow(7 350.671)和Kd(156.569 L·kg-1)[25]比较大,实验初期由上覆水迁移至土壤表面,被其强烈吸附,浓度迅速下降,随后毒死蜱在上覆水中的消解速率减缓。
毒死蜱在上覆水中的消解符合一级动力学方程,计算公式如下:
式中:Ct为时间t(d)时上覆水中毒死蜱的浓度,μmol·L-1;C0为上覆水中毒死蜱的初始浓度,μmol·L-1;k为消解速率常数,d-1。
毒死蜱的半衰期DT50(d)计算公式为:
上覆水中毒死蜱的消解速率与半衰期的计算结果如表1所示。加药后,毒死蜱在不同处理中的消解速率常数为0.688 8~0.985 2 d-1,半衰期DT50为0.70~1.01 d。由消解速率常数k值可见,毒死蜱的消解速率与温度呈正相关,温度越高,k值越大,毒死蜱消解越快。如在未灭菌处理土壤中,从15℃增加到25℃,k值从0.820 1 d-1增加到0.923 3 d-1,增加了12.6%;温度继续增加至40℃,k值为0.985 2 d-1,分别比15℃和25℃增加了20.1%和6.7%。从半衰期看,温度越高毒死蜱半衰期越短,40℃时毒死蜱的DT50是15℃时的0.75~0.82倍,是25℃时的0.93~0.96倍。
2.2 上覆水中TCP的动态变化特征
毒死蜱分子中的磷氧键断裂后,生成TCP和O,O-二乙基硫代磷酸酯[26]。作为毒死蜱的主要降解产物TCP,与母体分子毒死蜱相比,其水溶性更大,更难降解,更易迁移(25℃时,毒死蜱和TCP的Kow分别为7 350.671和291.859;Kd分别为156.569 L·kg-1和6.217 L·kg-1[25]),故有必要对上覆水中TCP的动态变化进行分析。上覆水中TCP的动态变化如图3所示。15℃时,上覆水中TCP浓度均很低,随着时间基本没有变化,60 d时灭菌和未灭菌处理的TCP的浓度分别为(1.35±0.26)μmol·L-1和(2.06±0.39)μmol·L-1,约为初始投加的毒死蜱的0.47%和0.72%。25℃时,上覆水中TCP浓度随着时间略有增加,60 d时灭菌和未灭菌处理的浓度分别为(6.45±0.36)μmol·L-1和(13.27±0.05)μmol·L-1,为母体农药毒死蜱初始浓度(投加时)的2.26%和4.65%。然而,40℃时,上覆水中TCP浓度随着时间变化显著;在0~8 d时增长缓慢,8 d后TCP的浓度快速增加,其中未灭菌处理在8 d到48 d时呈线性增加,速率为1.433 1μmol·L-1·d-1,灭菌处理在8 d到60 d时呈线性增加,速率为0.789 2μmol·L-1·d-1;60 d时,上覆水中未灭菌和灭菌处理的TCP分别为(72.82±2.05)μmol·L-1和(49.44±0.23)μmol·L-1,达到毒死蜱初始摩尔浓度的25.5%和17.3%。

表1水稻土上覆水中毒死蜱的消解速率常数与半衰期Table 1 Dissipation rate constant and half-life of chlorpyrifos in overlying water of the paddy soil
2.3 土壤中毒死蜱的归趋特征
不同处理下,在土壤表层(0~3 cm)毒死蜱含量的动态变化见图4。表层土壤中的毒死蜱来自上覆水,主要的机理是吸附。因此,表层土壤中的毒死蜱浓度在初期快速增加。在大部分处理中,0~4 d毒死蜱浓度均呈线性快速增加。此后,表层土壤中的毒死蜱一部分会被降解,一部分会继续向深层土壤进行迁移,因此不同处理中毒死蜱的浓度变化规律不同。15℃时,从4 d到24 d,未灭菌处理的毒死蜱的浓度逐步积累,此后再降低;25℃时,从4 d开始,未灭菌处理的毒死蜱的浓度逐步降低;40℃时,从4 d开始,未灭菌处理的毒死蜱的浓度先增加,而后降低。不同温度处理下毒死蜱在表层土壤中的残留在实验后期表现明显,温度越高,表层土壤中的残留越低。
实验结束时,未灭菌处理中,15、25℃和40℃的处理下,表层土壤中的毒死蜱含量分别为163.66、80.29μmol·kg-1和34.95μmol·kg-1,相当于毒死蜱初始投加量的57.38%、28.15%和12.25%。灭菌处理中,15、25℃和40℃的处理下,表层土壤中的毒死蜱含量分别为193.18、94.81μmol·kg-1和72.02μmol·kg-1,相当于其初始投加量的63.73%、33.24%和25.25%。土壤中TCP的残留量低于检测限。
2.4 土壤-上覆水系统中毒死蜱的残留分布特征
60 d时,毒死蜱在土壤-上覆水系统中的残留分布特征如表2所示。温度越高,毒死蜱的总残留率越低。如在未灭菌处理下,15℃时,毒死蜱的总残留率为46.95%;25℃时,总残留率为25.95%,比15℃减少了21个百分点;温度为40℃时,总残留率为10.57%,比15℃和25℃分别减少了36.38个和15.38个百分点。微生物的存在促进了毒死蜱的消解,降低了毒死蜱在系统中的残留,15、25℃和40℃的未灭菌处理,分别比灭菌处理低12.02、9.83个和13.04个百分点。
投加到上覆水中的毒死蜱,在土壤-上覆水系统中逐步从上覆水迁移到土壤中。60 d时,不同处理下土壤中的残留率为初始投加量的10.18%~58.32%,而在上覆水中的残留率为初始投加量的0.39%~2.24%。由此可见,毒死蜱在土壤中的分布要远高于上覆水中的分布,不同处理土壤中毒死蜱的残留量占其在系统中总残留量的93.56%~98.90%,而上覆水中仅占总残留量的1.12%~6.44%。
投加到上覆水中的毒死蜱,在土壤-上覆水系统中除了被土壤吸附向土相迁移外,还可以在上覆水中进行转化。毒死蜱的主要降解产物为TCP,不同处理下上覆水中TCP的总量相当于毒死蜱初始投加量的0.47%~25.53%,这说明有相当一部分的毒死蜱在水相中进行转化。由2.2上覆水中TCP的动态变化特征可知,毒死蜱转化成TCP,受温度和微生物的影响。
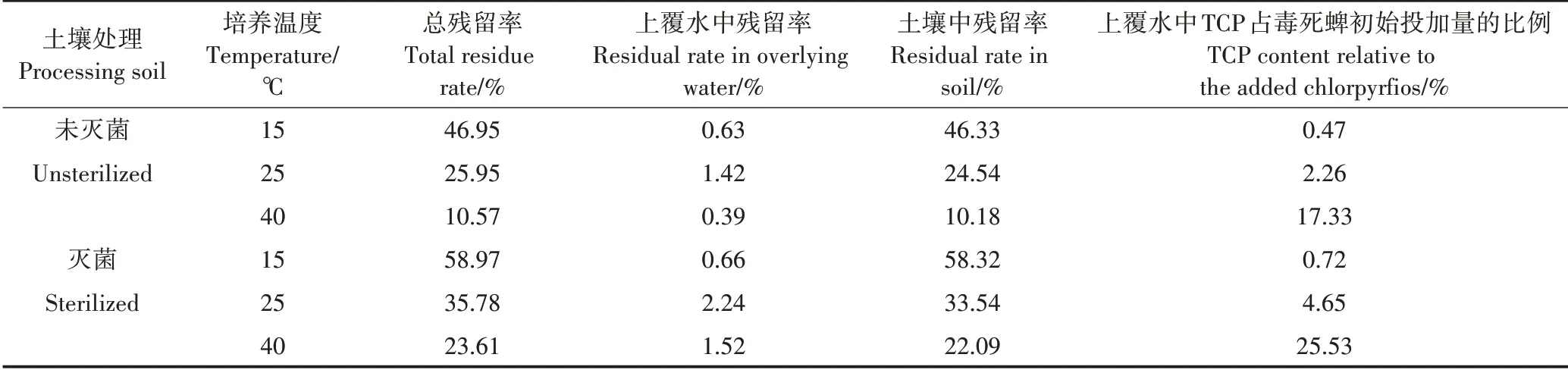
表2土壤-上覆水系统中毒死蜱的残留特征(加药后的第60 d)Table 2 Residual characteristics of chlorpyrifos in soil-overlying water system(on the 60th day after insecticide addition)
3 讨论
3.1 上覆水中毒死蜱的消解和TCP的动态变化规律
毒死蜱在上覆水中的消解动态特征主要受到温度、微生物等因子的影响,上覆水中毒死蜱的消解速率k值与温度呈正相关关系,温度越高,k值越大,毒死蜱消解越快。这与田芹等[27]报道的毒死蜱在水中的消解速率随着温度的上升而增大的结论相一致。上覆水中毒死蜱的浓度在前期快速消解,后期缓慢消解,这可能主要与毒死蜱在水中溶解度较低,且易被表层土壤吸附[28]相关,投加到上覆水中的毒死蜱,可由上覆水迁移至土壤,初期为表层土壤快速吸附,使其在上覆水中的浓度迅速下降,而后消解速率减缓。虽然水中微生物、光照对水体中毒死蜱的消解起重要作用[27],但是自然环境条件下水体中毒死蜱消解动态变化的主要驱动因子是温度。就毒死蜱的水解作用而言,其速率与温度呈显著的正相关关系[29]。作为毒死蜱的主要降解产物,TCP在上覆水中的浓度动态变化与毒死蜱的消解紧密相关。加药后第60 d,40℃时,17.3%~25.5%的毒死蜱转化为TCP,存留于上覆水中。TCP在水体中的溶解度较大,在土壤中与有机质等结合能力较弱,不易被土壤吸附,易迁移[25]。对比图2和图3中40℃条件下第16 d以后毒死蜱和TCP浓度随时间的变化量,可以推断,上覆水中的TCP除了小部分可能来自水中毒死蜱的降解以外,主要是表层土壤颗粒表面所吸附的毒死蜱的降解(水解、微生物降解)及所生成的TCP向上覆水扩散释放的结果。对比图3和图4可见,毒死蜱降解生成的TCP在培养后期(24 d开始)进一步发生降解,温度越高趋势越明显,25℃和40℃条件下微生物促进TCP降解的作用较大。对于稻田施药后TCP的潜在危害应给予高度关注,尤其是田面排水可能带来的受纳沟渠水体的TCP污染。
3.2 温度和微生物对毒死蜱在土壤-上覆水系统中迁移与残留特征的影响
毒死蜱进入土壤后,其降解途径包括水解、光解、微生物降解等[30],也受诸多环境因子(气候、地形、土壤等)、种植制度以及水肥管理措施等的综合影响[2]。已有田间实验研究表明[15,25],稻田田面水和土壤中的毒死蜱的消解涉及优先流迁移和土壤吸附等过程,受气象条件、土壤基本性质与结构特征、水分状况等多因素的共同影响。TCP作为毒死蜱的主要降解产物,比母体的迁移性更强[25],更易随水渗漏至深层土壤,甚至可能到达浅层地下水。
温度的变化可能同时影响毒死蜱的生物与非生物降解,温度与微生物对于毒死蜱的降解具有协同作用[18,20,31-33]。高温促进毒死蜱的微生物降解,从而影响毒死蜱的迁移和残留。培养温度对于土壤中残留毒死蜱的消解在实验后期表现明显,温度越高,土壤中的毒死蜱残留越低。在土壤-上覆水系统中,60 d时,温度越高毒死蜱的总残留率越低,未灭菌处理下毒死蜱的总残留率(10.57%~46.95%)低于灭菌处理下的毒死蜱总残留率(23.61%~58.97%)。相对于初始投加量,毒死蜱在上覆水中的残留率极低,一小部分转化成TCP,主要迁移到表土层,为之所吸附,经降解后仍有较高比例的残留。红壤性水稻土中毒死蜱的残留量远高于石灰性紫色土发育稻田的试验结果[15],究其原因,一方面,可能与本研究中采用的红壤性水稻土偏酸性(pH值为5.50)有关。毒死蜱通常在酸性条件下较为稳定,而在碱性条件下易发生降解[34-35]。另一方面,红壤的黏粒含量高[36],故而吸附能力较强[25],可能起到较强的“保护”作用,使其不易被降解。总体而言,毒死蜱在红壤性稻田土壤-上覆水系统中的消解途径主要包括吸附、水解、微生物降解等。
4 结论
(1)土壤-上覆水系统中,投加到上覆水中的毒死蜱,60 d时,仅0.39%~2.24%滞留在上覆水中,10.18%~58.32%迁移到土壤中,上覆水中的TCP浓度相当于毒死蜱初始投加量的0.47%~25.53%。
(2)加药后,15、25℃和40℃下上覆水中毒死蜱均在前期快速消解,后期消解速率逐渐减缓,毒死蜱在上覆水中的消解符合一级动力学方程。3种温度处理下上覆水中毒死蜱的半衰期DT50(0.70~1.01 d)和消解速率常数(0.688 8~0.985 2 d-1)的差异较小。
(3)毒死蜱易转化成3,5,6-三氯-2-吡啶醇(TCP),且受温度影响显著,经过60 d的培养,40℃时17.3%~25.5%的毒死蜱转化为TCP。
(4)毒死蜱主要为表层(0~3 cm)土壤所吸附,受温度影响较大,在15、25℃和40℃下,未灭菌处理表层土壤中毒死蜱的残留量分别为163.66、80.29μmol·kg-1和34.95μmol·kg-1,约为毒死蜱初始投加量的57.38%、28.15%和12.25%。
