伴生菌诱导的云南松挥发性化合物对云南切梢小蠹嗅觉行为影响研究*
2021-06-25冯丹王艺璇管国伟袁瑞玲陈鹏
冯丹,王艺璇,管国伟,袁瑞玲,陈鹏
(1.云南省林业和草原科学院,云南 昆明 650201;2.西南林业大学,云南 昆明 650224)
小蠹虫(Tomicus)危害是小蠹的蛀害及其伴生菌的协同侵染,共同打破寄主树木对病虫害抗御的结果[1]。小蠹虫伴生菌(Fungi associated with bark beetle),也叫蓝污真菌(Blue stain fungi)是小蠹虫在蛀干过程中携带的病原微生物。云南松(Pinusyunnanensis)受到这些病原微生物侵染后木质部会留下蓝变菌斑、失水斑和松脂斑[2];韧皮部会形成一个长椭圆形的、棕褐色、湿润的坏死斑块,能够帮助小蠹虫成功蛀害[3]。
植物受到昆虫或病原微生物的危害后,自身会产生一些次生代谢产物以抵抗外界为害[4-5]。植物挥发性化合物是其中一类重要的次生代谢产物,其对昆虫正常的生长发育、内分泌、神经和消化等系统有影响[6]。目前国内外普遍认为小蠹虫的寄主选择行为与森林生态系统中植物挥发性化合物的种类、浓度和组分等存在密切的关系[7-9]。近几年来,研究人员主要关注伴生菌与寄主植物的相互关系,一些研究也初步证明了小蠹虫伴生菌能改变寄主的挥发性化合物的种类和含量。潘悦等[10]接种一种小蠹虫伴生菌(Ophiostomacanum)后分3个采样时间观察云南松萜烯类化合物的变化情况,结果表明接种30 d后云南松韧皮部中α-蒎烯、莰烯和β-月桂烯的绝对含量显著高于对照,然而,接种时间的长短对云南松单萜化合物的影响不明显。Pan Yue等[11]接种3种小蠹虫伴生菌(Leptographiumwushanense,L.sinense和Ophiostomacanum)发现,伴生菌均能诱导寄主的6种单萜类化合物浓度增加,但只有接种L.wushanense10 d和20 d后能显著提高云南松中α-蒎烯、莰烯、β-月桂烯、β-水芹烯和α-松油烯的浓度。
多臂嗅觉仪是一个8通道的实验装置(图1),本项目组改进了以往“Y”形嗅觉仪一次只能提供两种气味源供昆虫选择的缺陷,可以一次研究多种气味源对小蠹虫的影响,不仅排出野外其他人为干扰因素的同时还可以在室内模拟野外复杂气味环境进行昆虫寄主选择试验。为了明确伴生菌诱导云南松挥发性成分种类或组分的改变对小蠹虫寄主选择是否有影响,本研究运用多臂嗅觉仪提供多种伴生菌诱导云南松改变的气味源对云南松小蠹嗅觉行为进行研究。在过去总是聚焦伴生菌与寄主植物相互关系的基础上引入小蠹虫。小蠹虫既是携带和传播伴生菌的宿主,也是造成云南松死亡的主要害虫之一,是研究云南松与伴生菌相互关系中的另一个重要环节。因此,本研究从伴生菌-云南松-小蠹虫入手,全面研究5种伴生菌对云南松挥发性化合物的影响,以及伴生菌诱导的云南松挥发性化合物对云南松小蠹嗅觉行为的影响,分析云南松、伴生菌、小蠹虫三者间的相互关系,探索云南切梢小蠹(T.yunnanensis)的化学生态学防治方法。
1 材料与方法
1.1 实验材料
1.1.1 供试菌株
5个供试菌株YSL40317(O.canum)、SNE40724(O.ips)、YML50409(O.abietinum)、HLH40315(L.conjunctum)、HPA40513(L.yunnanensis)由云南省林业和草原科学院森林保护研究所提供。
1.1.2 供试成虫
本试验供试昆虫采自云南省陆良县云南松纯林,野外采集的云南松木段通过室内饲养后获得供试成虫。嗅觉试验完成后,回收所有供试成虫在体视镜下鉴定,结果均为云南切梢小蠹。
1.1.3 供试植物
试验林分设在云南省林业和草原科学院的昆明树木园内(102.74°E、25.15°N,海拔1 955.80 m)。选择一块坡度20°,坡向西南向,郁闭度80%的云南松林样地,在该样地中选择胸径18~20 cm,树龄20 a的健康的云南松18株。
1.2 仪器设备
Carboxen-PDMS萃取头(黑色,Supelco,美国);7890A/5975气质联用仪(Agilent,美国);多臂嗅觉仪(实用新型专利)。
1.3 挥发性成分测定
采用HS-SPME-GC-MS联用仪(AGILENT,美国)测定小蠹虫伴生菌诱导的云南松挥发性成分。样品制备:取接种了伴生菌的云南松韧皮部组织(CK为未接种伴生菌的云南松韧皮部组织)1.0 g于20 mL顶空瓶中。将顶空瓶放置于80 ℃水浴中,用固相微萃取头置于顶空瓶中进行萃取,萃取时间为30 min。之后将固相微萃取头插入气相色谱进样口进样,时间为2 min,经气相色谱分离后用质谱鉴定。
色谱条件 HP-5MS弹性石英毛细管柱(30 m×0.25 mm×0.25 um),载气为氦气(纯度为99.999%),流速为1.0 mL/min,分流比为20︰1。升温程序为初始温度50 ℃,保持2 min;以5 ℃/min的速率升温至140 ℃;保持1 min。进样口温度为280 ℃,进样量为2.0 μL,溶剂延迟1 min。
质谱条件 电轰击电离(EI)源,电离能量70 eV,传输线温度280 ℃;扫描范围为29~350 amu,质谱检索图库为Nist 11标准谱库。
1.4 选择行为测定
选择行为测试装置为自制的实用新型专利多臂嗅觉仪(ZL201721699322.5),多臂嗅觉仪采用无色透明的玻璃制作,内径为2 cm,各气味源通道和接虫通道长20 cm,气味源通道以20°的夹角等角分布。气泵通过空气过滤装置(活性炭和蒸馏水)后连接多臂嗅觉仪,各装置间用医用硅胶管连接(图1)。将不同的化合物用无水乙醇稀释成浓度1 mg/mL备用,分别在2 cm×4 cm的灭菌滤纸上加入200 uL化合物,对照为等计量的无水乙醇,然后将滤纸放到多臂嗅觉仪的各个气味瓶中,进气流量控制在250 mL/min,室内温度控制在25 ℃左右,测试期间用黑布遮光。采集饥饿成虫300头备用。每次将30头成虫放入多臂嗅觉仪的接虫室后计时,10 min后记录各气味瓶中小蠹虫的数量。重复10次,每次测试后顺时针更换各气味瓶的位置,并更换滤纸。试验结束后用95%乙醇冲洗整个装置待用。
图1 昆虫嗅觉行为选择的装置示意Fig.1 olfactory behavior installation


1.5 云南切梢小蠹对气味组合的行为反应
运用对云南切梢小蠹有较强引诱力的4种化合物(α-蒎烯、金合欢烯、4-烯丙基苯甲醚和长叶烯),设置3种浓度梯度(0.5、1.0、2 mg/mL)进行不同气味组合对云南切梢小蠹引诱力的测定。
1.6 数据分析
数据采用SPSS软件处理。云南切梢小蠹对挥发物的嗅觉选择采用Dunnett-t法进行显著性检验。气味源组合的正交表由SPSS软件生成,云南切梢小蠹对气味源组合的选择的数据用Dunnett T3法进行多重比较。
2 结果与分析
2.1 伴生菌诱导的云南松挥发性成分
云南松接种小蠹虫伴生菌后改变了云南松韧皮部中挥发性成分的相对含量和组成(表1)。与对照相比,接种5种不同的小蠹虫伴生菌后,云南松韧皮部中α-蒎烯、β-蒎烯、4烯丙基苯甲醚、金合欢烯和β-月桂烯的相对含量发生了改变,其中α-蒎烯和β-月桂烯的相对含量增高,β-蒎烯、4烯丙基苯甲醚、金合欢烯的相对含量减少。云南松接种O.canum后韧皮部能产生3-蒈稀(40.03%±0.69%)和β-石竹稀(2.92%±0.05%)。L.conjunctum、O.ips和O.abietinum能诱导云南松韧皮部产生莰烯分别为(1.36%±0.19%、1.62%±0.11%、1.47%±0.05%)。除接种L.conjunctum以外,其他4种小蠹虫伴生菌均诱导云南松不产生长叶烯。
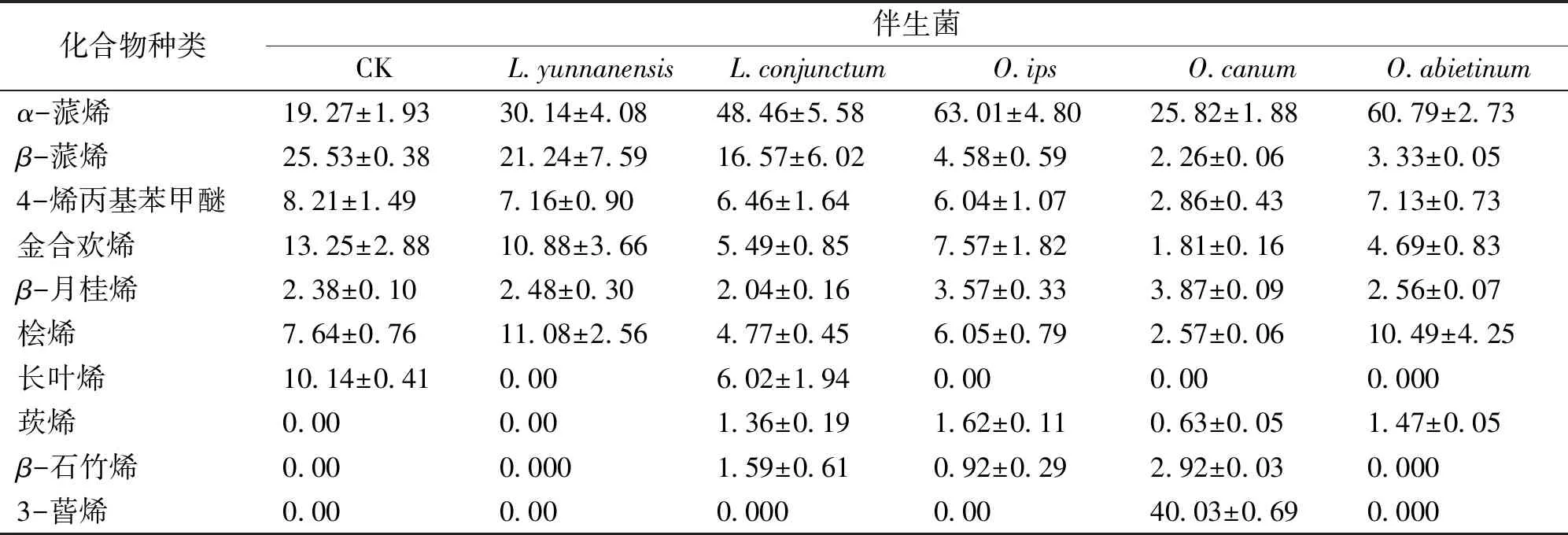
表1 5种伴生菌诱导云南松韧皮部产生的挥发性物质成分及其含量Tab.1 Effects of 5 blue stain fungi on Pinus yunnanensis %
2.2 云南切梢小蠹对挥发物的嗅觉选择
云南切梢小蠹对挥发物的嗅觉选择结果见图2。8种化合物与对照相比,4-烯丙基苯甲醚、金合欢烯、α-蒎烯和长叶烯对云南切梢小蠹的引诱力最强(P<0.01),云南切梢小蠹的选择率分别是19.5%、19%、17%和17%。3-蒈烯、莰烯和β-月桂烯对云南切梢小蠹的引诱能力与对照相比没有显著差异。云南切梢小蠹对β-蒎烯的没有选择性(0%)。
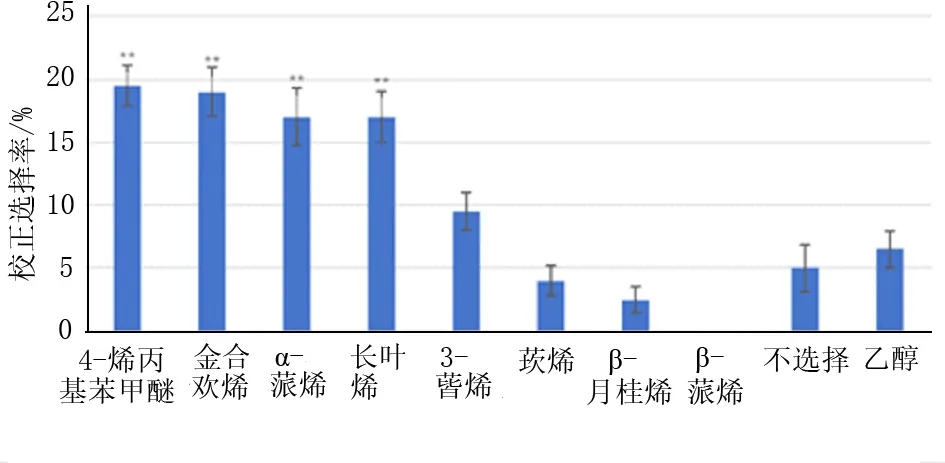
图2 云南松次生代谢对小蠹虫行为的影响注:选择率为平均选择率±标准误(mean±SE); *表示P<0.05;**表示P<0.01。Fig.2 Effects of metabolism of P.yunnanensison bark beetles
2.3 云南切梢小蠹对气味源组合的选择
试验结果见图3,与其他气味源组合相比较,气味源组合2123和3132对云南切梢小蠹的引诱能力最强(P<0.01),分别为23.67%和24%;其次是气味源组合3213(P<0.01),云南切梢小蠹的选择率为13.67%;气味源组合1222、1333和2312对云南切梢小蠹有一定的引诱能力,云南切梢小蠹选择气味源组合1222的比率为10%,选择气源味组合1333的比率为10.67%,选择气味源组合2312的比率为8.33%,均高于不做选择的小蠹虫的比率2%。
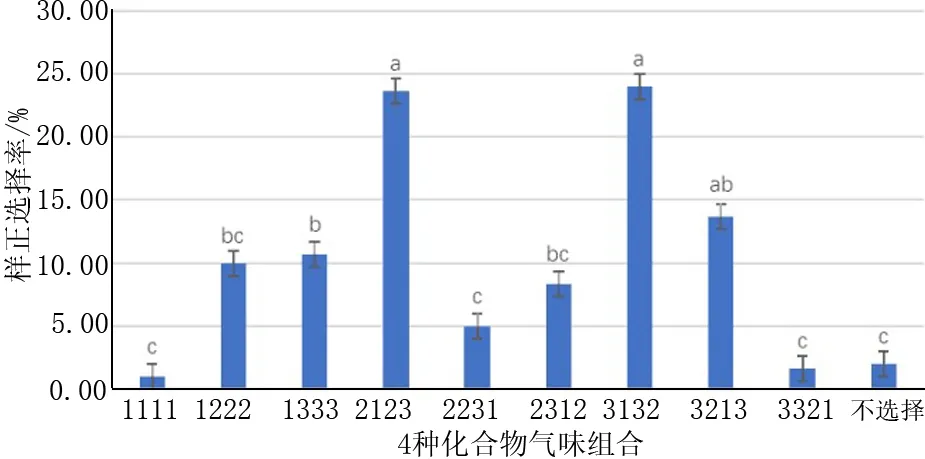
图3 4种化合物气味源组合对小蠹虫的影响Fig.3 Effects of 4 odor combinations on bark beetles
3 讨论与结论
切梢小蠹伴生菌侵染致病机理是一个较为复杂的过程,本研究运用固相微萃取和GC-MS联用技术测定小蠹虫伴生菌对云南松韧皮部挥发性次生代谢产物的影响。结果表明,不同的小蠹虫伴生菌均能诱导云南松韧皮部的α-蒎烯和β-月桂烯的相对含量增高,β-蒎烯、4烯丙基苯甲醚、金合欢烯的相对含量减少,此外,不同的小蠹虫伴生菌还能诱导云南松韧皮部的挥发性成分产生特殊的改变,如O.canum能诱导云南松产生3-蒈烯、β-石竹烯和莰烯等。本研究运用上述试验结果的物质作为气味源,研究云南切梢小蠹对这些气味源的嗅觉行为反应。云南切梢小蠹对8种化合物有不同程度的响应,4-烯丙基苯甲醚、金合欢烯、α-蒎烯和长叶烯对云南切梢小蠹具有较强的引诱能力,3-蒈烯、莰烯和β-月桂烯对云南切梢小蠹的引诱能力较弱,云南切梢小蠹对β-蒎烯的选择率为0%。以不同浓度的4-烯丙基苯甲醚、金合欢烯、α-蒎烯和长叶烯作为气味源组合,设计正交试验检测云南切梢小蠹对以上4种化合物组合的嗅觉选择,结果显示:α-蒎烯2 mg/mL、金合欢烯1 mg/mL、4-烯丙基苯甲醚0.5 mg/mL和长叶烯2 mg/mL对云南切梢小蠹有较好的引诱作用。
小蠹-真菌共生关系的经典理论认为小蠹虫伴生菌是导致寄主树木死亡的关键[12]。一些研究认为昆虫寻找适宜的栖息地的信息信号来源于微生物,O.novoulmi释放的挥发物对榆树小蠹(Hyrurgopinusrufipes)有吸引力[13];Xyleborusglabratus能被其共生菌的挥发性成分吸引[14];ZhaoTao[15]发现小蠹虫伴生菌通过自身合成双环缩酮类(bicyclic ketals)信息素帮助云杉小蠹(Ipstypographus)成功地在健康寄主上定植,证实了小蠹-真菌趋同进化的复合系统。本研究从小蠹、真菌、寄主三者相互关系的角度出发,通过接种小蠹虫伴生菌后检测寄主的挥发性成分,发现5种伴生菌均能改变寄主的挥发性成分,这些挥发性物质可能影响云南切梢小蠹对寄主选择。
云南切梢小蠹对寄主云南松的侵害分为两个阶段,在蛀梢期攻击云南松的枝梢进行补充营养,待性成熟后进入交尾产卵期则攻击云南松的树干[16]。已有研究表明:在蛀梢期,云南切梢小蠹对云南松枝梢挥发物表现出较强的趋向反应,而对云南松树干的挥发物则表现出一定的驱避反应,说明蛀梢期切梢小蠹属昆虫不仅对不同松属树种具有不同的选择性,不同性成熟程度的切梢小蠹也对同一寄主不同部位的挥发物组合具有不同的嗅觉和行为反应[17-19]。本试验在2020年6月开展,属于云南切梢小蠹的新成虫的蛀梢期,研究结果提示:α-蒎烯、4-烯丙基苯甲醚、金合欢烯和长叶烯对蛀梢期的云南切梢小蠹有较强的引诱力, 3-蒈烯、β-月桂烯的引诱力不强,β-蒎烯甚至对这个时期的云南切梢小蠹有一定的驱避作用。
不同的小蠹虫携带伴生菌的方式和比率不同,有的小蠹虫有专门的贮菌器可以携带真菌的孢子和菌丝,有的小蠹虫则通过小蠹虫体表携带伴生菌[20-22];有的小蠹携带一种真菌;有的小蠹携带几种真菌。而不同的伴生菌诱导寄主挥发性化合物组成和含量产生差异,从而影响小蠹虫的嗅觉和行为选择。本研究利用多臂嗅觉仪初步证实了一定比例的寄主挥发性气味组成对云南切梢小蠹有较好的引诱力。但是,云南切梢小蠹带菌比率与蠹害程度间存在一定的随机性[23],因此诱导云南松挥发性化合物的变化也是相对较复杂和随机的。
综上所述,伴生菌依靠小蠹虫传播,而小蠹虫则通过伴生菌提高攻击寄主的效果,并受到环境的影响,小蠹-真菌-寄主可能经过长时间的进化形成一个动态的可变的结构关系,今后研究伴生菌-云南松的关系对小蠹虫行为的影响,可以为小蠹虫防治开发系列引诱剂提供科学依据。
