通过网络药理学研究白术治疗前列腺癌的作用机制
2021-06-25谭武宾李铁求李嘉辉
谭武宾, 李铁求, 李嘉辉, 周 松, 毛 正, 杨 科
前列腺癌是男性第二大常见癌症,估计约占男性全部癌症诊断的10%[1]。在我国,由于前列腺癌的发病率、病死率近几年升高明显,前列腺癌现已成为危害男性健康的泌尿系肿瘤之一[2-3]。目前,中药作为一种重要的癌症辅助和替代治疗方式,为癌症患者提供了有益的治疗效果[4-5]。网络药理学是从蛋白质分子和基因水平研究生物系统、药物和疾病之间的作用关系,在中药的活性成分研究、药物靶标预测、药物作用机制挖掘等方面发挥出巨大的潜力[6]。研究表明,从白术的多种活性成分可以发挥抗肿瘤、抗炎等药理作用[7-9]。本研究通过网络药理学方法探索白术活性成分抗前列腺癌作用的分子机制,并通过分子对接技术验证研究结果,为白术治疗前列腺癌的药理作用研究与临床实践应用提供参考价值。
1 材料与方法
1.1 中药活性成分筛选、预测靶点以及疾病靶点的收集 通过 TCMSP 数据库检索白术的主要活性成份, 利用TCMSP数据库根据吸收、分布、代谢和排泄(ADME)标准选择所有化合物(选择口服生物利用度(OB)≥30%,类药性(DL)≥0.15%),建立药物-化学成分数据集。进一步在TCMSP 数据库中检索各成分的相关潜在靶点,通过uniprot数据库以及Genecard数据库中进行校正后获得预测靶点及对应的标准基因名。在OMIM数据库、CTD数据库、Genecard数据库以及DigSee数据库中检索前列腺癌相关靶点(截止时间为2020.10.02),取Genecard的中位数以上靶点与其他数据库中靶点去重并取交集获得较为全面的前列腺癌治疗靶点。
1.2 药物-疾病靶点网络构建及可视化 借助Draw wenn diagram将白术潜在的作用靶点映射到前列腺癌相关靶点,制作韦恩图,获取白术-前列腺癌共同靶点基因。运用 Cytoscape 3.7.2软件构建活性成份-疾病-靶点相互作用的网络图,并进行拓扑学分析。
1.3 关键靶点蛋白相互作用网络图(PPI)构建将白术-前列腺癌共同靶点导入String数据库平台,将物种在下拉列表中选择为“Homo sapiens”,最低相互作用阈值为0.400,其余参数保持默认设置不变,结果保存为 TSV 文本输出,并将其导入Cytoscape3.7.2 软件进行网络拓扑学分析,获取潜在作用靶标之间的连接度(Degree 值),并根据Degree 值绘制潜在作用靶标相互作用网络图,进一步预测白术治疗前列腺癌的关键靶蛋白。
1.4 GO功能富集和KEGG通路富集分析 将关键靶点基因输入到DAVID数据库6.8中,分析包括生物学功能(MF)、生物学过程(BP)、细胞学组分(CC)、KEGG pathway信号通路富集分析。设置P≤0.05,得到白术可能治疗的相关疾病以及在发挥抗前列腺癌中的主要的生物过程和药物作用机制中有显著性差异的通路。
1.5 成分-靶蛋白分子对接通过Autodock软件进行对接,分析白术活性成分与前列腺癌靶蛋白之间的结合活性,进一步验证白术治疗前列腺癌的分子机制。在PDB数据库和ZINC数据库中下载相应的蛋白的PDB文件和化合物成分的mol2 格式文件,运用AutoDock软件进行分子对接,对接使用Lamarckian genetic algorithm (LGA)算法。计算结合能(binding energy,BE)(kJ·mol-1)来评估成分小分子与蛋白之间的结合活性,最后运用PyMOL软件进行可视化。
2 结果
2.1 白术活性成分和潜在有效靶点 在OB≥30%,DL≥0.15%限定条件下,获得白术共计10种活性成分和28个潜在作用靶点。生物利用度最高:白术内酯III,类药性 最 高:(3S,8S,9S,10R,13R,14S,17R)-10,13-dimethyl-17-[(2R,5S)-5- propan-2-yloctan-2-yl]-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-ol。
2.2 药物-疾病靶点网络构建及可视化
2.2.1 药物-疾病靶点获取 取Genecard的中位数以上靶点与OMIM数据库、CTD数据库和DigSee数据库中的前列腺癌的相关靶点,去重并取交集获得较为全面的前列腺癌治疗靶点,共获取7054个前列腺癌相关性较高的疾病基因。通过韦恩图制作将白术潜在作用靶点映射到获得的疾病相关靶点中,共获得22个相交靶点(图1)。

图1 筛选白术成分以及前列腺癌疾病靶点
2.2.2 靶点网络的构建及可视化与分析 运用Cytoscape 3.7.2构建“白术成分-前列腺癌疾病靶点”网络图并进行分析,将获取的与前列腺癌相关的个有效成分和22个潜在靶点构建相互作用网络图(图2)。该网络图中包含共 37个节点(Nodes)和98条作用线(Edges)。节点连线的多少代表节点度值的高低,介值中心度大小代表节点在网络图中的核心度,两者是描述节点的重要指标。由图可知活性成分度值最高的是(MOL000049,3β-acetoxyatractylone),网络分析详细信息见表1。

表1 白术成分-前列腺癌靶点网络参数分析

图2 靶点蛋白 PPI 相互作用关系图
2.3 PPI图构建以及网络拓扑学分析 将在STRING中生成的PPI数据导入Cytoscape(3.7.2)进行网络重构,如图3所示,圆圈的不同颜色和大小都表示度数。该PPI网络中包括21个节点和60条边,average node degree为,network diameter为4, average number of neighbors为 5.714,Shortest paths 为150(35%)。运用“cytoNCA”计算该网络的度值,度值最大的是IL-6(Degree=12),其次为 VEGFA、ACHE(Degree=9),NOS3、IL1B、PTGS2、F2(Degree=8),这些节点可能是白术治疗前列腺癌的关键作用靶点。
2.4 GO和KEGG富集分析
2.4.1 GO功能富集分析 为进一步探讨白术治疗前列腺癌的分子机制,通过DAVID数据库对药物-疾病靶点进行GO功能富集分析,设置P≤0.05,共富集分析48条,其中BP67条,CC15条,MF18条。BP主要涉及细胞增殖、血管生成、突出传递、NO生物合成、G蛋白偶联的乙酰胆碱受体信号通路、对缺氧的反应的调控等方面;CC主要涉及突触、突触后膜、质膜、细胞连接核染色质等部位;MF主要包括G蛋白偶联乙酰胆碱受体活性、乙酰胆碱结合、生长因子活性、酶结合、血管内皮生长因子受体结合等方面。图3列举了GO功能富集排名前15的条目。

图3 GO富集分析气泡图
2.4.2 KEGG通路富集分析 继续运用DAVID数据库对药物-疾病靶点进行KEGG分析,设置P≤0.05,共富集分析12条,涉及神经活性配体-受体相互作用、钙信号通路、胆碱能突触、PI3KAkt信号通路、癌症的途径、VEGF信号通路等通路(图4)。结果表明,PI3K-AKT信号通路在通路中有较多的计数,我们推测PI3K-AKT信号通路可能是白术治疗前列腺癌的关键通路。将通路-靶点基因-白术成分制作成网络文件导入Cytoscape(3.7.2)中构建网络图(图5),该网络图可呈现白术活性成分与治疗前列腺癌的相关通路之间的网络关系。

图4 KEGG通路富集
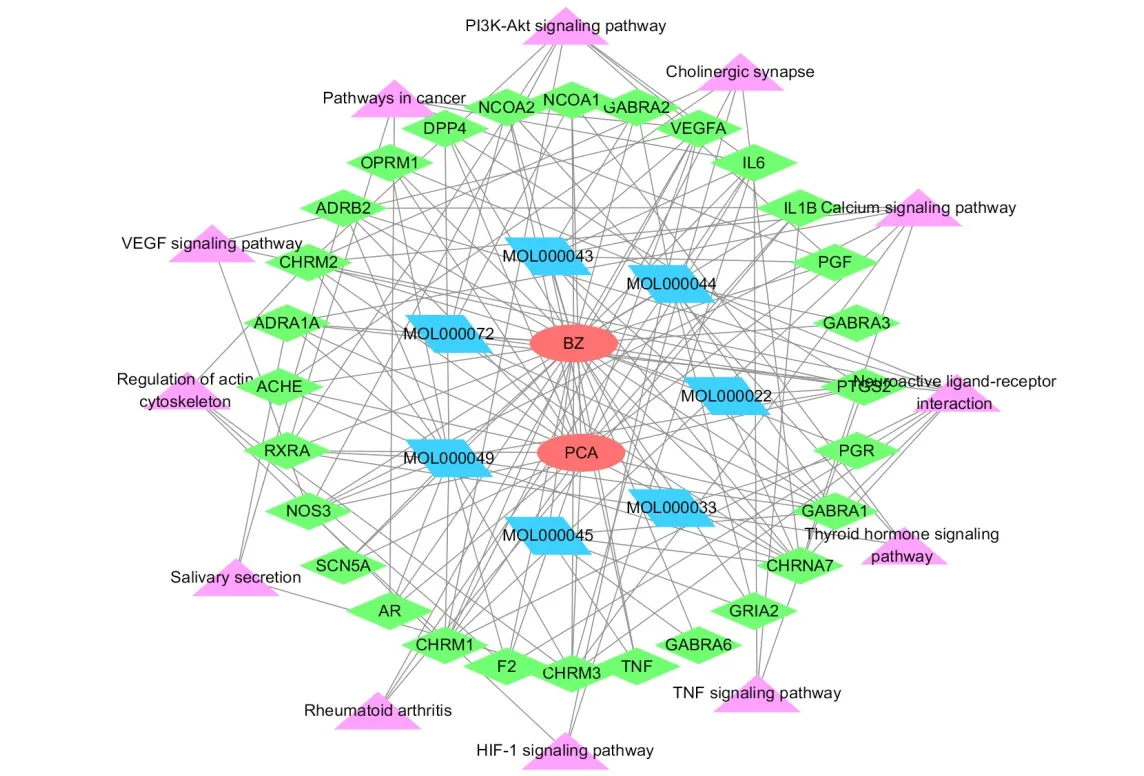
图5 成分-靶点-通路网络图
2.5 活性成分与靶点蛋白分子对接 选择白术发挥抗前列腺癌活性的7种有效活性成分与前列腺癌疾病靶点Degree值较高的7个靶点蛋白(Degree≥8),采用柔性配体和刚性受体半柔性对接方法,通过调整格点数目和中心位置寻找活性口袋(配体分子与受体结合位点),借助AutoDock软件共进行49次对接。在分子对接过程中,一般小于-5.0 kal/mol的对接结合能被认为在化合物与其靶之间具有良好的结合相互作用。分子对接结合自由能大部分小于-6 kcal/mol,分子对接的结果与预测的目标和成分之间的关系基本相符。选取排名较前的6对对接结果在Pymol软件中进行可视化,见图6。由图可知,白术内酯I与靶点IL1B的 MET-20和 ACHE的 GLY-88、GLN-87、HIS-86残基的相互作用,白术内酯II与IL1B的VAL-41残基有相互作用,白术内酯III与VEGFA的PHE-295残基有氢键链接。所有化合物都与其靶的残基均有氢键接触,这有助于降低结合自由能。这些活性成分的高结合亲和力进一步表明,白术发挥的治疗作用可能是通过调节这些相关的靶点来实现。

图6 一些重要活性成分和核心靶点蛋白的分子构象
3 讨论
如今,中药在现代医学的治疗中发挥着越来越重要的作用,由于缺乏明确的分子机制一直是中药发展与应用的困扰,大数据时代的到来给传统中药的发展带来新的机遇。网络药理学强调生物信息学、系统生物学和药理学的结合,不仅在系统层面上解释了中药与疾病之间复杂的相互作用,而且符合中医理论的系统性和整体观,成为了中药走向现代化新的研究方法和技术手段[10-11]。本文通过网络药理学方法,构建“成分-靶点-疾病”网络,PPI网络分析、GO和KEGG富集分析,预测了白术治疗前列腺癌的有效活性成分及潜在作用机制。近年来,白术抗肿瘤的药理价值逐渐被人们研究发现,使用中医传承辅助系统收集近10年治疗前列腺癌的用药规律发现“白术-茯苓”的使用频次最高[12]。Wang等通过体外细胞实验发现,ATRⅡ通过诱导前列腺癌细胞G2/M期阻滞,促进DU145和LNCaP细胞凋亡,其机制可能与ATRⅡ抑制活化的STAT-1蛋白抑制剂(PIAS1)和抑制Janus激酶(JAK2)信号通路有关[7],孙伟桂等人研究发现白术挥发油可诱导前列腺癌细胞系LNCaP和 DU145细胞凋亡和坏死[13]。Yu等研究发现白术内酯I可以通过上调p21,下调cyclin B1、CDK1和Cdc25c,抑制膀胱癌细胞增殖,使肿瘤细胞的生长周期阻滞在G2/M期,发挥抗肿瘤作用还依赖于抑制PI3K/Akt/mTOR信号通路[8]。在大肠癌细胞的发生发展过程中,白术内酯I通过AKT/mTOR信号通路的介导,改变细胞凋亡、糖代谢和干细胞样行为来抑制大肠癌细胞的增殖[14]。此外,白术在胃癌[15]、肺癌[16]、卵巢癌[17]中均有研究发现白术的活性成分有抗肿瘤作用。
根据PPI靶点蛋白相互作用网络分析,我们推测白术内酯的活性成分主要作用于IL-6、VEGFA、ACHE、NOS3、IL1B、PTGS2等靶点来实现治疗前列腺癌效果。许多研究表明炎症过程在前列腺癌发病机制中起着重要作用,而白细胞介素(IL-6)是被公认为前列腺癌进展的主要调节因子[18],IL6可能通过PI3-K/Akt途径及其下游靶细胞周期蛋白A1对LNCaP的存活产生影响[19]。血管内皮生长因子-A(VEGFA)是一种45KDa的肝素结合蛋白,长期以来被认为影响内皮细胞(EC)行为和维持血管完整性,因此在肿瘤生长过程中起着至关重要的作用[17],并在前列腺癌中过表达[20-21]。研究表明,VEGFA在前列腺癌组织中的表达增加与血管生成、疾病晚期、复发增加和患者生存率降低有关[22]。据报道,VEGFA抑制剂或抗VEGFA抗体治疗可通过抑制血管生成阻断前列腺肿瘤的生长[23],进一步支持了VEGFA介导的血管生成在前列腺癌进展中的作用。PTGS2也称为环氧酶(COX2),是前列腺素生物合成的关键酶。许多研究结果表明,PTGS2在PCa细胞中高表达,还发现COX-2/Mattritase信号通路参与了COX-2过表达的雄激素非依赖性PCa细胞的侵袭、肿瘤生长和转移[24],该蛋白的高表达可能为前列腺癌患者手术后提供一个独立的预后指标[25]。
GO富集分析表明,白术发挥抗前列腺癌的潜在机制可能是参与调节癌症的细胞增殖、血管生成、突出传递、NO生物合成、G蛋白偶联的乙酰胆碱受体信号通路、对缺氧的反应的调控等生物学过程。通过KEGG通路富集分析发现,白术治疗前列腺癌可能通过调控 PI3K-Akt信号通路来实现。越来越多的研究表明,PI3K/AKT信号通路是肿瘤中最常激活的信号转导通路之一,其参与细胞周期、细胞增殖、生长、迁移、血管生成和细胞凋亡[26-28]。PI3K-Akt信号通路与前列腺癌的发生发展具有密切的联系,通过阻断PI3K-Akt信号通路,可抑制前列腺癌的生长和转移,阻断前列腺癌细胞对靶向药物的耐药性[23-30],越来越多的体内外实验以及临床实验去发掘抑制PI3K/AKT信号通路活性的靶点,成为前列腺癌新的预后指标和潜在的治疗靶点。
总之,本研究通过网络药理学的方法研究白术治疗前列腺癌的机制,预测相关靶点及通路与目前的癌症研究结果趋势基本一致。但是本研究也存在局限性,首先,由于公共数据库的不断更新,因此,一些其他的生物活性成分和靶基因可能没有包括在我们的分析中;其次本研究基于数据分析,需要进一步的实验来验证我们的结果。
