正交设计优选牛大力种子发芽条件研究
2021-06-06朱惠牛俊奇莫昭展杨丽萍苏建睦
朱惠 牛俊奇 莫昭展 杨丽萍 苏建睦


摘 要:通过正交设计方法,研究了牛大力种子在不同浸种时间、培养温度、赤霉素浓度、基质、光照条件下的萌发情况,筛选出牛大力种子萌发的最佳条件,为牛大力规范化、规模化种植提供种苗繁育途径和方法。试验结果表明,牛大力种子萌发的最佳条件为:浸种时间0 h,培养温度30 ℃,赤霉素浓度30 mg/L,基质脱脂棉,光照强度1 000 lx。
关键词:正交设计;牛大力;种子;发芽条件
文章编号: 1005-2690(2021)06-0003-03 中国图书分类号: S567.239 文献标志码: B
牛大力(Millettia speciosa Champ)为蝶形花科鸡血藤属的干燥块根,外表灰黄色至土黄色,呈不规则的纵向粗皱纹和横向细纹,俗称为血藤九龙串珠、甜牛大力、扒山虎、大力薯、山莲藕、美丽崖豆藤、猪脚笠等,其主要成分为蛋白质、淀粉、生物碱等[1],性平、味甘、归肺、肾经,具有补虚润肺、强筋活络的功能,临床已证实其对多种慢性疾病有治疗作用[2]。
目前,牛大力主要以种子方式进行繁殖,但是种子在自然状态下发芽慢、发芽率低、出苗不整齐[3]。本试验旨在通过正交设计,找到种子萌发的最佳条件组合,并比较出对牛大力种子萌发影响最大的因素,为牛大力规模化生产中的种苗繁育提供科学依据和方法。
1 材料与方法
1.1 材料
牛大力种子于2016年10月采收于广西灵山县,试验选取籽粒饱满、质地均匀、无病虫害的种子。
1.2 方法
1.2.1 种子的筛选及处理
将饱满、均匀的牛大力种子平均分成25份,每份100粒,先用洗洁精清洗,之后用清水清洗干净后再用75%的酒精浸泡30 s,最后用清水清洗4~5次,将种子置于无菌培养皿中培养。
1.2.2 不同激素组合正交设计
使用不同浓度的吲哚丁酸(IBA)、萘乙酸(NAA)、赤霉素(GA3)和6-苄氨基嘌呤(6-BA)对牛大力种子进行浸种,激素组合使用L9(34)正交表,各因素水平见表1。浸种后,将种子置于25 ℃条件下催芽,7 d后统计发芽率。
1.2.3 不同培养方法正交设计
采用正交设计表 L16(45)设计试验,优选牛大力的浸种时间A(h)、培养温度 B(℃)、GA3浓度C(mg/L)、基质D、光照强度E(lx)的工艺条件,正交设计的因素水平见表2。将牛大力种子按每份60粒分装到3个培养皿中,将种子置于不同的培养条件下进行催芽,观察并记录每个处理水平下种子的生理变化及发芽情况。
1.2.4 测定指标
发芽率Gr(%)=∑Gt(14 d)/NT×100%,其中Gt表示t日时的发芽数,NT表示种子总数。
2 结果与分析
相应结果见表3~表6和图1。
2.1 不同激素组合正交设计
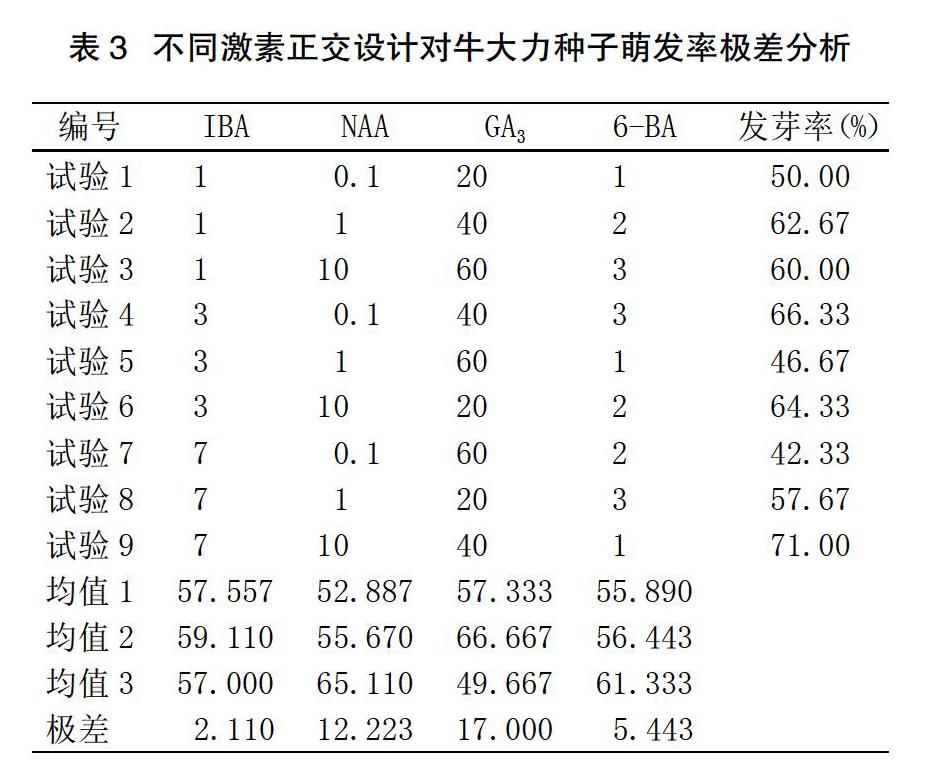
从表3可以看出,GA3浸种时发芽率的极差最大,为17.000;IBA浸种时发芽率极差最小,为2.110。由此可知,在试验4种激素中,GA3浸种对牛大力种子萌发率的影响最大,IBA浸种对牛大力种子萌发率的影响最小。
由表4方差分析结果显示,NAA和GA3对牛大力种子萌发率的影响具有显著性,IBA和6-BA对牛大力种子萌发率的影响不显著。
2.2 不同条件正交试验对牛大力种子发芽率的影响
从表5数据可以看出,培养温度的极差最大,为42.43;基质的极差最小,为15.75。说明培养温度对牛大力种子萌发的影响最大,基质的影响最小。在16个试验组合中,试验3(浸种时间0 h+培养温度30 ℃+GA3 30 mg/L+脱脂棉+光照强度1 000 lx)的萌发率最高,达88.33%。试验16(浸种时间36 h+培養温度35 ℃+
GA310 mg/L+脱脂棉+光照强度500 lx)的萌发率最低,为6.67%。
由图1可以看出,不同处理中牛大力种子的发芽率由高到低的顺序为:A1B3C3D2E3>A1B2C2D4E2>A2B3C4D1E2>A4B2C3D1E4>A2B2C1D3E3>A3B3C1D4E4>A3B2C4D2E1>A2B4C3D4E1>A1B4C4D3E4>A3B4C2D1E3>A4B3C2D3E1>A4B1C4D4E3>A2B1C2D2E4>A1B1C1D1E1>A3B1C3D3E2>A4B4C1D2E2。
由表6方差分析结果表明,α=0.05水平下,培养温度对牛大力种子萌发有显著影响,浸种时间、GA3浓度、基质和光照强度对牛大力种子萌发率影响不显著,与极差分析的结果一致。
3 讨论
3.1 不同激素浸种对牛大力种子萌发的影响
激素能通过信号传导对种子内各种生理变化作出响应,调节一系列蛋白质、酶的代谢,从而调控种子的休眠和萌发[4]。种子休眠与萌发的过程受到很多激素的影响,除脱落酸(ABA)、赤霉素(GA)和乙烯(ETH)外,油菜素内酯(BR)、细胞分裂素(CTK)、独脚金内酯(SL)和生长素(auxin)等也会发挥一定的作用[5-6]。
本试验使用不同浓度的IBA、NAA、GA3和6-BA浸种,探究其对牛大力种子萌发的影响,结果显示,GA3对
牛大力种子萌发的影响最大,最适合牛大力种子萌发的GA3浓度为30 mg/L。GAS对种子萌发的促进作用已在拟南芥中得到证实[7],但不同植物种子萌发所需要的赤霉素浓度不同。
细胞分裂素主要通过与ABA的相互作用来促进种子的萌发,而且与ABA具有一定的拮抗效应。ABA可以抑制不同浓度GAS对种子休眠的破除作用,而这种抑制效应又可被CTK解除,因此CTK又被人们认为是GAS在种子休眠与萌发过程中发挥生物学功能的“许可”因子[8]。6-BA是植物组织培养中常用的细胞分裂素,具有高效、稳定、廉价和易于使用等特点。本试验结果显示,在种子萌发试验中添加6-BA,对牛大力种子萌发的影响较小,各水平间没有显著差异。可能是由于牛大力种子本身内源激素已经达到适合萌发量,外源添加激素对牛大力种子的萌发影响不大。
3.2 不同培养条件对牛大力种子萌发的影响
温度在决定种子萌发中可能起双重作用,即直接影响种子萌发或通过间接调节种子休眠影响种子萌发[9-10]。种子萌发过程中进行着活跃的代谢反应,在一定的温度范围内,随温度升高种子萌发进程加快,但温度过高或过低都会使膜透性和酶活性改变而影响萌发[11]。本研究结果表明,在4个条件中,培养温度对牛大力种子萌发的影响最大,在20~35 ℃范围内,随着温度的升高,牛大力种子萌发率呈现先升高后降低的趋势,在30 ℃时萌发率最高,其次是25 ℃;温度过低,种子内部的酶活性没有达到适合的水平,从而影响下游一系列的生化反应,使种子不能更好地萌发。温度过高,一方面酶容易失活,另一方面会使种子更容易发霉。在研究中发现,牛大力种子在各温度条件下均会有少部分发霉的现象,温度越高,发霉情况越严重。种子发霉后,会产生抑制种子萌发的毒素,从而使种子萌发率降低。
根据种子萌发过程对光的不同响应,可将种子分为需光性、忌光性和光中性3类。需光性种子:萌发需要光照,在黑暗下不能萌发或萌发率降低。忌光性种子:光的存在诱导种子产生休眠。光中性种子:光照与否不影响种子萌发[12]。本研究发现,牛大力种子在光照强度为0 lx时,仍可以发芽,但发芽率最低;光照强度为1 000 lx时,发芽率最高;光照强度为1 500 lx时,发芽率又下降。由此可推测,牛大力种子可能为需光性种子。
研究表明,浸种时间过长或过短均不利于种子发芽 [13]。本试验中,牛大力种子在浸种0 h 后发芽率最高,随着浸种时间增加,发芽率逐渐降低。姚绍嫦认为,牛大力种子浸种12 h的发芽率最高,本试验的结果与其研究结果略有差异。原因可能是,在本研究中,虽然牛大力未浸种,但是在进行激素处理时,添加了不同浓度的激素溶液,而且一直保持激素溶液淹没至种子的1/2,因此,牛大力种子在这个过程中能够吸收足够的水分来进行萌发。经过浸种12 h、24 h、36 h的牛大力种子,可能会因缺乏足够的氧气进行有机物的分解,且可能会进行无氧呼吸产生毒素,从而造成萌发率降低。
种子萌发是一个复杂的生理过程,需要水分、氧气、光照和激素等条件协同作用,才能使种子更好地萌发。本研究初步探究了不同激素对种子萌发的影响和不同条件对牛大力种子萌发的影响。试验结果对牛大力种子育苗具有实践意义,但若需要阐明其中的机理,还需要更进一步的研究。
参考文献:
[ 1 ] 韦荣昌,白隆华.药用植物牛大力的研究概况[J].种子,2015(12):47-50.
[ 2 ] 广西壮族自治区卫生厅.广西中药材标准[M].南宁:广西科学技术出版社,1992.
[ 3 ] 姚绍嫦,白隆华.牛大力种子萌发特性研究[J].种子,2012(8):36-38.
[ 4 ] 杨荣超,张海军,王倩,等.植物激素对种子休眠和萌发调控机理的研究进展[J].草地学报, 2012,20(1):1-9.
[ 5 ] Toh S,Kamiya Y,Kawakami N,et al.Thermo inhibition uncovers a role for strigolactones in Arabidopsis seed germination[J].Plant Cell Physiol,2012,53(1): 107-117.
[ 6 ] Sirova J,Sedlarova M,Piterkova J,et al. The role of nitric oxide in the germination of plant seeds and pollen[J].Plant Sci,2011(181):560-572.
[ 7 ] Michaels SD,Amasino RM.The gibberellic acid biosynthesis mutant ga1-3 of Arabidopsis thaliana is responsive to vernalization[J].Dev Genet,1999,25 (3):194-198.
[ 8 ] 于敏,徐恒,張华,等.植物激素在种子休眠与萌发中的调控机制[J].植物生理学报,2016, 52(5):599-606.
[ 9 ] AN YY,LIANG ZS,ZHANG Y.Seed germination responses of Periploca sepium Bunge, adominant shrub in the Loess hilly regions of China[J].Journal of Arid Environments, 2011,75(5):504-508.
[ 10 ] 马红媛,梁正伟.不同贮藏条件和发芽方法对羊草种子萌发的影响[J].应用生态学报,2007,18(5):999-1004.
[ 11 ] 宋兆伟,郝丽珍,黄振英,等.光照和温度对沙芥和斧翅沙芥植物种子萌发的影响[J].生态学报,2010,30(10):2562-2568.
[ 12 ] 张敏,朱教君,闫巧玲.光对种子萌发的影响机理研究进展[J].植物生态学报,2012,36(8):899-908.
[ 13 ] 李清波,唐成霞,钱春荣,等.浸种时间对龙稻7号发芽势及发芽率的影响[J].黑龙江农业科学,2008(2):47.
