肝特异性造影剂与细胞外造影剂增强磁共振定量检测不均匀肝损伤的实验研究
2021-06-05于占江王国庆王志强陈智成刘屹
于占江,王国庆,王志强,陈智成,刘屹
(1.中国医科大学附属第一医院放射科,沈阳 110001;2.北票市中心医院放射科,辽宁 朝阳 122100)
各种原因造成的肝损伤直接导致肝脏功能受损,且往往表现为肝脏不均匀损伤[1]。目前临床常用的肝功能检测方法包括Child-Pugh分级、吲哚氰绿排泄试验等[2-3],但这些检测方法对肝功能的评价相对粗糙,更不能反映肝脏各叶、段的肝功能不均匀受损情况。肝穿刺活检是诊断肝脏病变的金标准[4],但存在操作复杂、价值局限及患者依从性差等问题。近年来,采用肝脏特异性造影剂钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)增强磁共振(magnetic resonance,MR)检查评价肝脏病变及功能成为研究热点,造影剂特殊的药代学特性使其对肝脏病变及功能的评价提供“一站式”服务,可通过肝胆期的信号增强程度反映肝功能,即肝脏损伤程度[5]。因此,本研究拟利用肝脏不均匀损伤模型,分别进行肝脏特异性造影剂Gd-EOB-DTPA和细胞外造影剂钆喷替酸葡甲胺(gadolinium diethylenetetramine pentaacetic acid,Gd-DTPA)增强MR检查,结合肝脏损伤病理评分,评价2种造影剂对肝损伤的诊断效能。
1 材料与方法
1.1 动物模型建立
24只雄性SD大鼠(购自辽宁省本溪市长生实验室,月龄3个月),体质量(210±20)g。腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉后,开腹,脾静脉注射0.25%秋水仙碱(0.4 mL/kg),缝合切口。术后常规饲养。
1.2 MR检查
术后第3天,将大鼠随机分为2组,每组12只。麻醉后,行常规MR轴位平扫(GE Signa HDx3.0T 磁共振扫描仪和腕关节线圈),一组先给予Gd-EOBDTPA(德 国Bayer Schering Pharma AG公 司,稀 释10倍,0.1 mL/100 g)尾静脉注射,20 min后行增强MR检查;间隔24 h后,再给予Gd-DTPA(德国Bayer Schering Pharma AG公司,稀释10倍,0.1 mL/100g)尾静脉注射,5 min后行增强MR检查。另一组大鼠采用相反顺序间隔24 h分别注入2种造影剂行增强MR检查。扫描序列及参数如下:层厚3 mm;视野(field of view,FOV)12 cm;翻转90°。T1WI 平扫(TR 360 ms;TE 10 ms;NEX 2;矩阵224×192;用时4 min 44 s)。T1WI 增强(TR 320 ms;TE 10 ms;NEX 2;矩阵224×192;用时4 min 44 s)。
1.3 MR图像数据采集与分析
每只大鼠所有序列均截取连续3个层面,包括肝脏左、右叶和脊柱旁肌肉组织,在每个层面的肝脏左、右叶和脊柱旁肌肉组织内设定感兴趣区(region of interest,ROI)3次。ROI选取要避开大血管(图1),计算3个层面内所得各数据的平均值。于各扫描时相和组织器官获得信号强度平均值后,计算以下参数:(1)肝脏与肌肉信号比(liver-to-muscle ratio,LMR)=肝实质信号/肌肉信号;(2)肝脏强化值(values of hepatobiliary phases contrast-enhancement,ELMR)=(增强后LMR-平扫LMR)/ 平扫LMR;(3)增强后肝脏左、右叶ELMR 差值的绝对值(ΔELMR)[6]。
图1 MR肝脏平扫及2种造影剂肝胆期的信号强度变化Fig.1 Changes of signal intensity in MR liver plain scan and two kinds of contrast agents in the hepatobiliary phase
1.4 病理评分
MR检查后留取肝脏标本进行常规包埋、切片、HE染色,对肝脏受损情况进行病理评分,包括肝细胞坏死、肝细胞水肿、炎症细胞浸润,评分标准为:0,无;1,轻度;2,中度;3,严重。最终评分为上述3项的评分之和。
1.5 统计学分析
采用SPSS 22.0软件进行统计学分析,符合正态分布的计量资料用表示。采用 Student’st检验或Mann-WhitneyU检验比较肝脏左、右叶各参数的差异,采用Spearman秩相关检验分析ELMR与病理学评分的相关性。P< 0.05为差异有统计学意义。
2 结果
2.1 肝脏病理评分改变
所有大鼠造模后存活,并顺利完成MR检查。光镜下可见不同程度的肝细胞坏死、水肿和核溶解,炎症细胞浸润(图2)。肝脏左、右叶病理评分有统计学差异(P=0.008)。

图2 肝脏损伤病理评分 HE ×100Fig.2 Score for liver injury HE ×100
2.2 MR数据分析结果
所有大鼠平扫肝脏左、右叶T1WI的LMR及2种造影剂增强后的ELMR均方差齐,符合正态分布,左、右叶的参数比较均有统计学差异(表1)。Gd-EOB-DTPA和Gd-DTPA增强检查所得ELMR和病理评分均呈负相关,Gd-EOB-DTPA的相关性(r=-0.865,P< 0.001)(图3A)高于Gd-DTPA(r=-0.532,P< 0.001)(图3B)。Gd-EOB-DTPA增强后肝脏左、右叶的ΔELMR大于Gd-DTPA(P< 0.05)(图4)。

表1 肝脏左、右叶MR各参数比较Tab.1 Comparison of MR parameters of all left and right lobes of liver
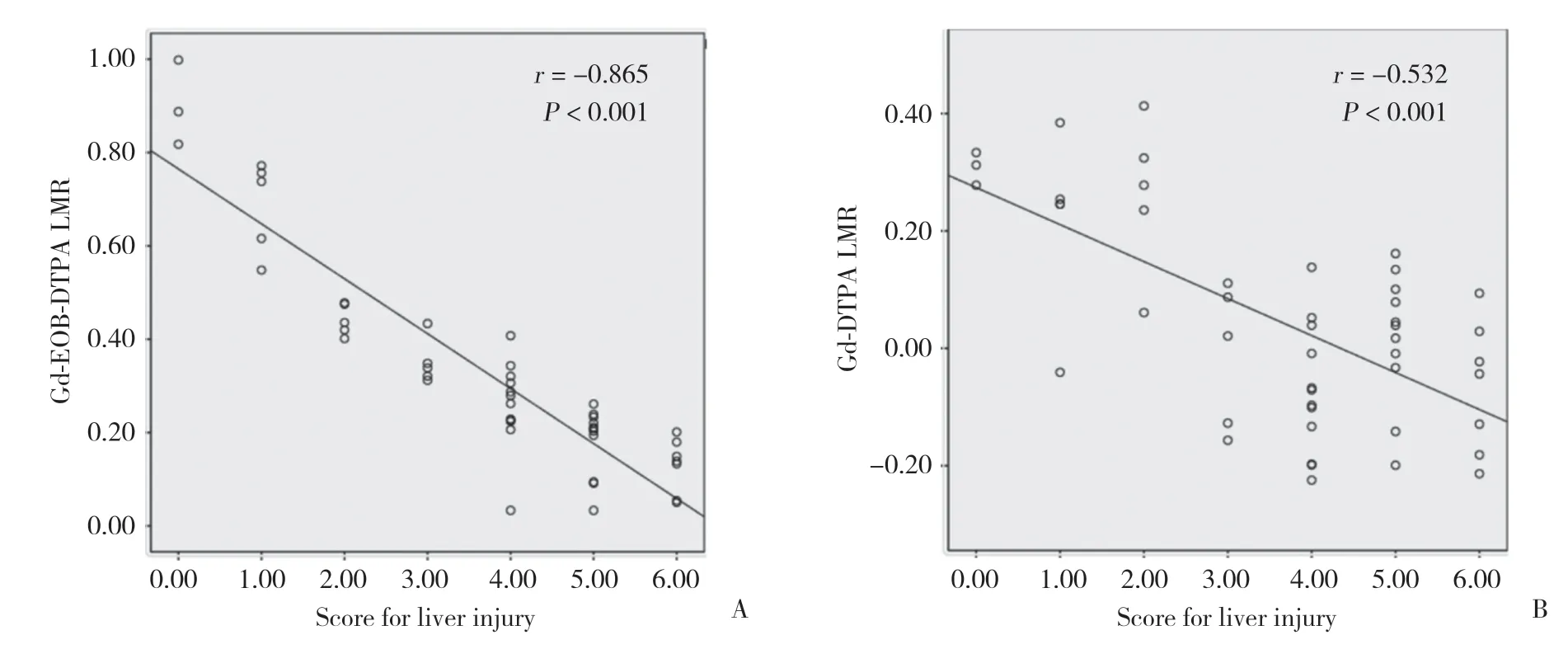
图3 Gd-EOB-DTPA、Gd-DTPA增强MR的ELMR与肝损伤病理评分的相关性Fig.3 Correlations between the signal intensity of ELMR on Gd-EOB-DTPA-enhanced or Gd-DTPA-enhanced MR and hepatic injury scores
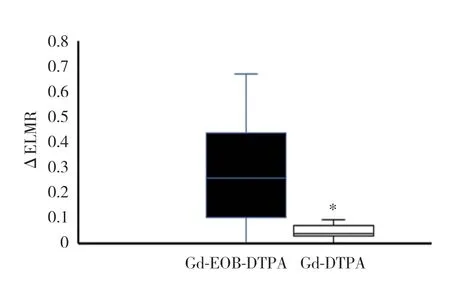
图4 Gd-EOB-DTPA及Gd-DTPA增强MR的ΔELMR比较Fig.4 Comparison of ΔELMR for quantitative detection hepatic injury with Gd-EOB-DTPA-enhanced MR and Gd-DTPAenhanced MR
3 讨论
肝功能变化通常与肝纤维化有关。肝纤维化的特征是小叶和血管结构破坏及肝组织结节性再生。病毒性肝炎、肝切除手术、肝脏血管栓塞术或放射治疗等都会引起不均匀的肝损伤,导致肝功能异常[7]。近年来,肝脏特异性造影剂MR检查精确检测肝功能日渐成为研究热点,但其相关研究缺乏标准化。
细胞外造影剂Gd-DTPA是一种顺磁性小分子亲水性化合物,静脉注射后迅速分布于血管内、外间隙,而极少与血浆蛋白结合,几乎不会被肝细胞摄取,亦不参与肝细胞代谢,增强过程中不同时相强化原因也不同。增强早期强化主要为富血供部位和病变,即动脉供血多,如动门脉瘘部位和原发性肝细胞癌、炎症肉芽组织等;肝实质期(延迟期)血管内、外间隙的造影剂浓度趋于平衡,因此肝脏的强化程度趋于均匀一致。本研究中,于Gd-DTPA注射5 min后进行肝脏增强扫描,此时造影剂均匀分布于血管内、外的细胞外间隙,大鼠的急性不均匀肝损伤造成肝组织内不均匀的肝细胞肿胀、坏死和炎症反应,肝组织内不均匀血供减少,具有血流和物质交换功能的血管内、外间隙不均匀减小,因此,增强后肝组织呈现不均匀强化减低现象,且病理损伤较重的局部信号减低更明显。肝脏左、右叶因损伤程度不同出现不同增强效果,且其ELMR与局部病理损伤评分呈负相关。
Gd-EOB-DTPA是一种肝脏特异性顺磁性对比剂。肝细胞基底侧细胞膜的有机阴离子转运多肽OATP1B1/B3是一类摄取型转运体,其底物众多,如吲哚青绿和Gd-EOB-DTPA。相对于细胞外造影剂,Gd-EOB-DTPA不仅可以检测肝脏的微循环状况,等同于细胞外造影剂功能,还可以被肝细胞特异性摄取,延长造影剂在肝内聚集时间,待细胞外间隙的造影剂被排泄后,检测残留于肝细胞内的造影剂,用于反映组织内肝细胞数量及肝细胞摄取功能,因此,能间接反映肝脏组织受损程度。本研究中,大鼠的急性不均匀肝损伤造成肝组织内不均匀的肝细胞肿胀、坏死和炎症反应,也导致肝细胞膜转运多肽减少。注射Gd-EOB-DTPA 20 min后进行MR扫描时,血管内及周围间隙的Gd-EOB-DTP基本已经过肾脏和胆道系统排泄到膀胱及肠管内,故肝组织MR信号强度主要取决于肝细胞数量和肝摄取Gd-EOBDTPA量,肝组织呈现不均匀强化减低现象,并且病理损伤较重的局部信号减低更明显。因此,肝脏左、右叶因损伤程度不同而出现不同的增强效果,且其ELMR与局部病理损伤评分呈负相关。
本研究结果显示,Gd-EOB-DTPA增强后肝脏左、右叶的ΔELMR大于Gd-DTPA。2种造影剂的增强到达肝胆期的延迟时间的设定与临床中一致。究其原因,可能是Gd-DTPA增强后延迟期(5 min后)反映的是单位体积肝组织内具有血流和物质交换功能的微血管内、外间隙的分布状况,即功能性微血管内、外间隙的密度,这种微观的密度差异体现为宏观的强化程度差异。而Gd-EOB-DTPA增强后延迟期(20 min后)则反映的是单位体积肝组织内肝细胞的数量和肝细胞摄取造影剂的能力,即肝细胞内残留造影剂的量,这种微观的浓度差异体现为宏观的强化程度差异。由此可见,肝组织内造影剂浓度差异比功能性微间隙差异更能准确反映肝脏组织受损程度的差异。
本研究采用的大鼠肝损伤模型是不均匀损伤模型,造模过程中每只大鼠肝脏的损伤部位和损伤程度具有不可控性(P=0.008),该模型是由本课题组前期研究的自创新模型,病理已证实其肝脏左、右叶不均匀损伤的可靠性[8]。这主要由于每只大鼠脾静脉回流血在肝脏组织内分布不同,具有明显的随机性,造成秋水仙碱在肝组织内的分布浓度不可控,因此,每只大鼠的肝组织受损部位和程度不可控。本研究中,2组大鼠采用不同顺序间隔24 h先后注射2种造影剂,进行了自身对照研究,就是为了有效减少每只大鼠肝脏不均匀损伤的个体差异造成的实验误差。另有研究[9-11]显示,注射造影剂12 h后,2种造影剂均可达到90%以上排出体外。故本研究采用间隔24 h先后注射2种造影剂进行增强MR检查。
本研究尚存在以下不足之处:肝脏病理评分存在人为主观因素,如结合生化检查佐证,结果将更为准确;MR图像分析中ROI的选择与病理标本切片部位难以做到精确一致,需要标准化测量和多学科协作;MR信噪比的不稳定性会影响实验结果的准确性;注射秋水仙碱后分别在第3天和第4天采集2种不同造影剂的增强MR数据,可能对实验结果产生一定影响,但前期研究结果显示,术后3 d肝急性损伤病理变化明显,且3~7 d时病理损伤评分相对稳定。
综上所述,肝脏特异性造影剂Gd-EOB-DTPA和细胞外造影剂Gd-DTPA增强MR对肝损伤均具有鉴别能力,但肝脏特异性造影剂Gd-EOB-DTPA的效果优于细胞外造影剂,本研究结果仍有待进一步深入研究。
