光路系统的优化配置在多色流式细胞术实验方案设计中的应用
2021-06-04付伟超梁昊岳于文颖王浩雨刘二涛高瀛岱
付伟超,梁昊岳,于文颖,王浩雨,刘二涛,高瀛岱*
(1.北京协和医学院,中国医学科学院血液病医院,中国医学科学院血液学研究所,实验血液学国家重点实验室,国家血液系统疾病临床医学研究中心,天津300020;2.天津市血液病基因治疗研究重点实验室,天津300020)
0 引言
流式细胞术(flow cytometry)是一种通过流式细胞仪对单个细胞或颗粒进行多参数分析、分选的技术,在血液学、免疫学和干细胞与再生医学等领域具有重要作用[1-2]。光路系统是常规流式细胞仪的核心部件,决定着仪器检测能力的高低,其主要由激光器和滤光片等元件组成,分别用于激发和接收相应的光信号[1-5]。光路系统中,激光器种类和数量较为固定,需根据仪器型号由厂家进行升级,但光路收集系统不是固定的,各种型号的滤光片可根据实验需要进行调配和更换。BD AriaⅢ流式细胞仪采用空间激发模式,光路收集系统采用八角形和三角形接收装置,每个激光器都有单独的接收装置。光信号被各种型号的滤光片分割,同时被相应的光电倍增管(photomultiplier tube,PMT)(作为荧光通道)接收,以达到荧光检测的目的[1-3,6-7]。
活性氧(reactive oxygen species,ROS)是细胞内正常代谢产生的含氧化合物,主要由线粒体产生。在正常生理条件下,ROS的产生和消除是一个动态平衡过程,在细胞信号介导、细胞周期和基因表达等过程中发挥着重要作用[8-9]。同时,高浓度ROS会诱导细胞中的氧化应激,导致细胞衰老和凋亡[8-9]。造血干祖细胞(hematopoietic stem and progenitor cell,HSPC)广泛存在于哺乳动物骨髓、脐带血和外周血中,在机体正常造血调控机制中发挥着十分重要的作用[10-13]。在正常生理条件下,通过流式细胞术检测HSPC中的ROS水平,可用于判断细胞分裂及分化的潜能[8]。
随着流式细胞术的发展,研究人员需要探索的细胞标记物逐渐增多,多色流式细胞术为实验室提供了重要技术支撑[11-13]。在多色流式细胞术相关实验中,研究人员需在已有抗体的基础上,结合流式细胞仪具体配置,合理进行配色方案设计,达到降低研究成本和使效益最大化的目的[6,14]。特别是在非常规染色流式实验中,新染料的激发光谱和发射光谱与常规染料有较大重叠,影响实验方案的设计,甚至出现常规光路收集系统无法接收相应发射光的问题,因此研究人员亟须探索合理优化检测方案的可行性方法。本研究通过对小鼠骨髓中的造血干细胞(hematopoietic stem cell,HSC)、造血祖细胞(hematopoietic progenitor cell,HPC)和多能祖细胞(multipotent progenitor cell,MPP)的ROS水平进行流式分析,验证切换滤光片对实现多色流式细胞术实验方案设计的有效性,旨在为多色流式细胞术实验人员改进工作方法、优化多色流式细胞术检测方案、扩大多激光流式细胞仪的检测能力提供借鉴。
1 材料和方法
1.1 主要材料
6~8周B6小鼠,饲养于中国医学科学院血液学研究所SPF级动物房;荧光彩虹微球,购自美国碧迪公司;Lineage磁珠、LS分选柱,购自德国美天旎公司;APC-Cy7标记的抗小鼠Lineage抗体、APC标记的抗小鼠c-Kit抗体、PE-Cy7标记的抗小鼠Sca-1抗体、BV421标记的抗小鼠CD150抗体、FITC标记的抗小鼠CD48抗体,所有单克隆抗体均购自美国eBioscience公司;MitoSOX Red染色液,购自中国翊圣生物科技有限公司;7-AAD染色剂,购自美国碧迪公司;磷酸盐缓冲液(phosphate buffer solution,PBS),购自无锡傲锐东源生物科技有限公司。
1.2 主要仪器
BD AriaⅢ流式细胞仪,购自美国Becton Dickinson公司。
1.3 方法
1.3.1 样本制备
断颈处死B6小鼠后取骨髓细胞,离心弃上清液,加入适量Lineage磁珠,4℃避光15 min后用PBS清洗,重悬过Lineage阴选柱子,富集Lineage阴性细胞。将Lineage阴性细胞分组,设置荧光减一(fluorescence minus one,FMO)对照管(标记所有抗体,不标记MitoSOX Red染色液)作为对照组,实验样本管(标记所有抗体和MitoSOX Red染色液)作为实验组,每管Lineage阴性细胞量约为1×106。对照组使用流式抗小鼠Lineage、c-Kit、Sca-1、CD48、CD150抗体染色,避光30 min后用PBS清洗后重悬备用。将MitoSOX Red染色液按说明书稀释成工作液,实验组每管加入500μL工作液,混匀,37℃避光孵育20 min后用PBS清洗重悬。上机前所有管中加入7-AAD染色剂去除死细胞。
1.3.2 流式细胞仪的调节与质控
将561 nm激光器对应的556LP、582/15滤光片(PE通道)与488 nm激光器对应的655LP、695/40滤光片(PerCP-Cy5.5通道)对调,此时PerCP-Cy5.5通道用于接收488 nm激光器激发、波长范围在574.5~589.5 nm的发射光(MitoSOX Red染色液发射光)。使用荧光彩虹微球检测各荧光通道信号。重复执行变更滤光片操作3次,分别记录PerCP-Cy5.5通道荧光强度中位值(median of fluorescence intensity,MFI)和相对变异系数%rCV。
1.3.3 样本检测
将所有样本管加入2μL 7-AAD染色剂,2 min后上机检测。调节前向角散射光(forward scatter,FSC)信号、侧向角散射光(side scatter,SSC)信号和各荧光通道电压,使得各通道细胞群处于合适位置。按照“横平竖直”原则,调节各荧光通道的补偿数值。分别记录对照组和实验组的流式结果,记录结果时各PMT的电压和荧光通道的补偿数值应保持一致。
1.3.4 数据处理
采用BD AriaⅢ流式细胞仪配置的Diva 8.0.1软件和专业流式数据分析软件FlowJo 10.6.2进行数据分析。使用IBM SPSS Statistics 20.0软件和GraphPad Prism 5软件进行统计学分析并绘制图形,P<0.05表示差异具有统计学意义。
2 结果
2.1 流式细胞仪滤光片变更结果
滤光片变更前后各荧光通道接收荧光波长范围的变化详见表1。滤光片变更直接影响PerCP-Cy5.5通道和PE通道捕获的发射光波长范围。MitoSOX Red染色液最大激发波长为510 nm,最大发射波长为580 nm,故使用488 nm激光器激发。仪器原配置没有适合此染色液的荧光接收通道,更换滤光片后可用PerCP-Cy5.5通道接收MitoSOX Red染色液的荧光信号。
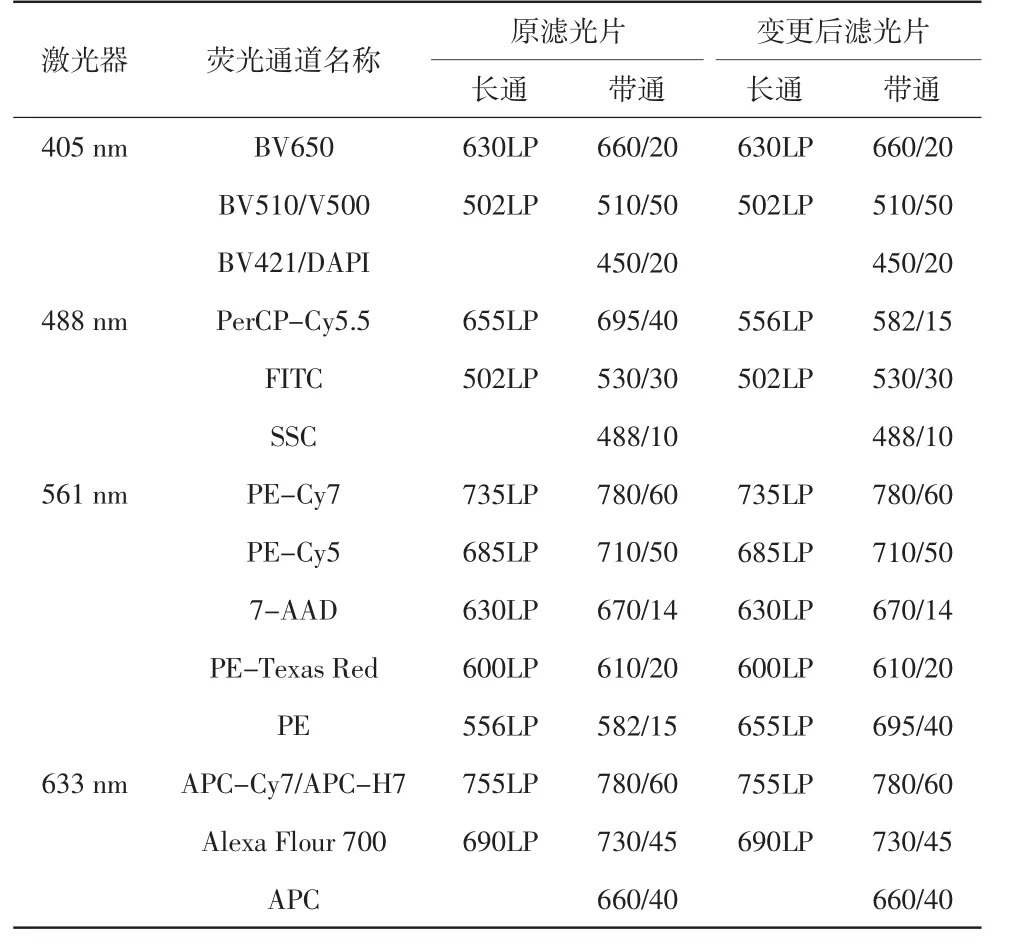
表1 滤光片变更前后各荧光通道接收荧光波长范围的变化
2.2 流式细胞仪质控结果
图1为滤光片变更之前流式细胞仪的质控结果,各荧光通道单参数直方图均为单峰,峰图清晰,说明各通道接收荧光信号正常。各荧光通道荧光质控结果显示,所有通道%rCV均在6%以下,处于合理数值,表明仪器处于正常状态,分析结果可靠。图2为滤光片变更之后流式细胞仪的质控结果,FSC、PerCP-Cy5.5、APC-Cy7、APC、DAPI、PE-Cy7、FITC、7-AAD 8个通道的荧光信号值与滤光片变更之前相比,荧光信号强度无明显差异,表明滤光片变更后对本实验设计方案中细胞表面标记物荧光染料的检测无影响。图3(a)为滤光片变更前PerCP-Cy5.5通道的直方图,其接收的荧光值范围为675~715 nm。图3(b)为滤光片变更之后PerCP-Cy5.5通道的直方图,其接收的荧光值范围变更为575~590 nm。可以看出滤光片变更后峰图位置发生明显右移,荧光信号强度增强。荧光参数结果显示本通道%rCV与变更滤光片前相比无明显变化,如图4(a)所示。数据统计结果显示,通过变更滤光片,PerCP-Cy5.5通道MFI增强(P<0.001),如图4(b)所示。上述结果表明仪器符合使用标准,变更滤光片后的PerCP-Cy5.5通道可正常接收相应荧光信号,并且接收效果有所提升,分析结果可靠。
2.3 对照组小鼠骨髓细胞中HSC、MPP、HPC分群实验结果
对照组中标记的各种抗原对小鼠骨髓中的各类干/祖细胞分型。小鼠全骨髓细胞Lineage阴选富集后进行抗体标记,利用鉴定细胞死活的7-AAD染色剂和抗小鼠Lineage、c-Kit、Sca-1、CD48、CD150抗体染色后上机进行流式分析。图5(a)中用FSC和SSC圈出细胞群,去除碎片,获得Lineage富集细胞。图5(b)中用SSC-W和SSC-H双参数去除粘连体,获得单个细胞。图5(c)为7-AAD染色剂染色结果。使用7-AAD染色剂染色,利用其非渗透性(不能透过活细胞细胞膜的特性)去除死细胞。图5(d)中利用细胞表面抗原信息,在活细胞中圈出Lineage阴性细胞,比例约为86.8%,说明磁珠富集纯度相对较高。图5(e)为c-Kit和Sca-1双参数流式分析结果,在Lineage阴性细胞中用c-Kit和Sca-1表达的流式图圈出Linc-Kit+Sca-1+细胞(简称“LSK细胞”),比例为2.31%。图5(f)中利用CD48和CD150的表达对LSK细胞进行分型[15-18]。其中,HSC的表型为LSKCD48-CD150+,在LSK细胞中占比10.1%;偏髓系分化的HPC的表型为LSKCD48+CD150+,命名为HPC1,在LSK细胞中占比2.69%;偏淋系分化的HPC的表型为LSKCD48+CD150-,命名为HPC2,在LSK细胞中占比56.9%;MPP的表型为LSKCD48-CD150-,在LSK细胞中占比16.9%。

图1 滤光片变更前各荧光通道流式细胞仪质控结果

图2 滤光片变更后各荧光通道流式细胞仪质控结果
2.4 实验组小鼠骨髓细胞中HSC、MPP、HPC1和HPC2的ROS水平结果
通过对比实验组和对照组中各细胞群PerCPCy5.5通道的荧光强度高低反映小鼠骨髓细胞中HSC、HPC1、HPC2和MPP的ROS水平。向小鼠骨髓细胞中加入抗小鼠Lineage、c-Kit、Sca-1、CD48、CD150抗体染色后,再使用MitoSOX Red染色液染色后上机分析。实验组中HSC、HPC1、HPC2和MPP圈门方法和对照组一致,与未加入MitoSOX染色液的样本(对照组)相比,4个细胞亚群在PerCP-Cy5.5通道的MFI(ROS水平)均增大。图6中4个直方图显示,和对照组相比,实验组PerCP-Cy5.5通道的荧光信号(ROS水平)整体右移,表明各细胞亚群均成功标记上MitoSOX Red染色液,并实现了多参数流式分析。
3 讨论
近年来,随着流式细胞术的发展,目前市场上流式细胞产品配置的激光器种类和数目不断增多,仪器自动化程度也在逐渐提高,仪器配置可以基本满足常规流式检测需求。与此同时,荧光素技术也在快速发展,很多更亮、性能更稳定的荧光染料不断问世[19-20]。市场上的多数荧光素的最大激发波长和最大发射波长存在差异,在多色流式细胞术相关实验中,如果光路系统完全固定,则每个荧光通道检测的波长范围就会固定,可能会导致仅可使用有限的几种荧光素进行实验搭配,不利于多色流式细胞术相关实验方案的设计与应用。通过变更滤光片来合理优化仪器的光路配置,可以大大改善荧光素使用的局限性。研究人员在使用新型荧光染料时,必须优先确定好流式细胞仪的硬件配置、激光器和接收PMT是否可以实现完全匹配。
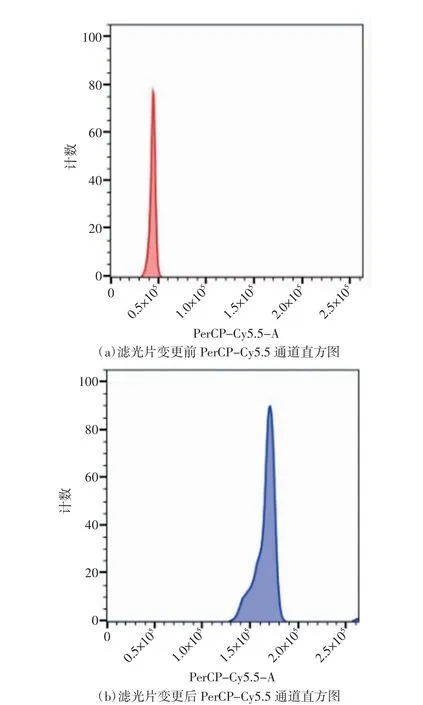
图3 滤光片变更前后PerCP-Cy5.5通道荧光信号对比图

图4 滤光片变更前后PerCP-Cy5.5通道质控情况

图5 小鼠骨髓HSPC各亚群流式结果

图6 小鼠骨髓细胞中HSC、HPC1、HPC2和MPP的ROS水平结果
国内大多数高校或科研院所的流式平台均配备自动化仪器,学者们对流式细胞仪最佳分选性能条件优化进行了探索,提出了包括喷嘴大小、鞘液压力和加电类型等一系列条件的技术参考[20-21]。针对流式细胞仪分析性能的相关研究报道较少,利用手动切换光路系统的情况不多,制约了一些用于细胞功能检测等荧光染料的使用范围,甚至会影响一些关键抗原信息的标记与识别[1]。通过灵活运用流式细胞仪相关硬件配置的技术方法,可有效改善仪器应用范围,为实验人员设计多色流式细胞术相关实验方案提供更广阔的思路。本实验所用的流式荧光素耦联抗体搭配方案见表2,总体实验方案涵盖7种染料。因为BD AriaⅢ流式细胞仪采用空间激发模式,有4个独立光斑用于接收发射荧光,故使用配置4种激光器(405、488、561、633 nm)的仪器可以将各种荧光素进行最大程度的激发,有效鉴定出弱表达群体。使用561 nm激光器,可使PE-Cy7获得更强的激发效果,有利于鉴别Sca-1阳性群体。多色流式细胞术相关实验中因4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染料具有和其他荧光素相比荧光溢漏较少的优势,常用于死/活细胞的鉴定。本实验设计中,7-AAD染色剂使用561 nm激光器激发,可有效降低与其他通道的荧光补偿数值,同时能空出较亮荧光素BV421通道,用于CD150的标记。

表2 多色流式实验抗体染料搭配方案
在配置561 nm激光器的流式细胞仪中,488 nm激光器的光路收集系统采用三角形接收装置,分别接收SSC、FITC和PerCP-Cy5.5通道的荧光信号,并未配置波长范围在580 nm左右的相关滤光片。本实验方案中没有使用PerCP-Cy5.5的PMT,可将此PMT用作接收MitoSOX Red染色液的接收通道,同时,所选荧光素中没有用到PE荧光素,PE通道作为561 nm激光八角形接收装置中最后一个PMT检测器,撤掉其相关滤光片(556LP和582/15)并不会影响其余通道荧光信号的接收。这种情况下,可以将556LP长通滤光片和582/15带通滤光片转换至PerCP-Cy5.5通道对应的PMT之前,实现对MitoSOX Red染色液发射荧光的接收,从而完成本实验中所有标记物的检测。
4 结语
通过流式细胞仪光路收集系统相关滤光片的变更,灵活搭配PMT前的滤光片型号,无需其他光路校准操作,可有效改变PMT检测器接收的荧光波长范围,大幅度增加流式细胞仪的应用范围。随着多色流式细胞术和荧光素耦联抗体技术的发展,流式细胞仪管理者和使用者需要更加精准地掌握仪器运行的相关原理,灵活利用其相关配置。这些方法有助于研究者更好地进行抗体组合,优化多色流式细胞术检测方案,扩展仪器应用范围,对流式细胞术的发展和科研成本的降低具有积极的影响。
流式细胞仪作为一种高灵敏度、强分辨力的细胞生物学研究工具,已成为免疫学和干细胞与再生医学等领域必不可缺的技术手段之一。未来在流式细胞仪光路系统的不断优化下,科研人员可更加方便地优化多色检测和抗体组合的设计,使多色流式细胞术的应用范围更加广泛和深入,为多细胞亚群鉴定、HSC纯化和细胞生理功能检测等方面提供更多的思路,使其在科学研究和临床诊断领域发挥更大的作用。
