耐热β-木糖苷酶的可溶性表达及其应用
2021-05-31罗佳年华董玉蓉张珊珊张小濛赵林果
罗佳年华,董玉蓉,张珊珊,张小濛,赵林果*
(1.南京林业大学江苏省南方现代林业协同创新中心,南京 210037;2.南京林业大学化学工程学院,南京 210037)
紫杉醇(Paclitaxel)是一种三环二萜类化合物,最早从短叶红豆杉(Taxusbrevifolia)的树皮中提取获得[1]。紫杉醇对多种癌症具有显著的抑制作用[2-5],此外,还对中风、老年痴呆等具有很好的疗效[6]。紫杉醇在临床上的需求极大,但其在红豆杉属植物中的含量极低(仅为0.005%~0.015%)。迄今为止,紫杉醇的制备方法包括传统的提取法、化学合成法、内生菌培养法和植物细胞培养法[7]等。然而,传统提取法费时费力;化学合成法路线复杂,且合成得率低,不适合工业生产;内生菌培养法无法达到工业产量需求;植物细胞培养法存在植物细胞易变异、紫杉醇表达水平低且产量不稳定等问题[8]。
7-木糖-10-去乙酰基紫杉醇(7-XDT)主要存在于树叶中,其含量远高于紫杉醇和其他紫杉烷类化合物,是紫杉醇含量的20~50倍[9]。因此,提取含量较高的7-XDT,并将其转化为紫杉醇,是一种有效利用植物资源的可持续途径[10]。迄今为止,有关β-木糖苷酶应用于转化7-XDT制备10-去乙酰基紫杉醇(10-DT) 的报道甚少。Cheng等[11]利用糖苷水解酶Lxyl-p1-2转化7-β-木糖基紫杉烷;Dou等[12]利用新型的类纤维素多酶复合物,其能对7-木糖基-10-去乙酰基紫杉醇进行高效糖苷水解。而应用于转化7-XDT制备10-DT的嗜热菌来源的β-木糖苷酶资源匮乏,仅Li等[13]报道了有关嗜热菌来源的且能用于7-XDT制备10-DT的β-木糖苷酶。
目前已报道的β-木糖苷酶多为低温、中温酶,其热稳定性普遍不高。然而,工业生产中常需要较高的反应温度来增加底物溶解度、降低污染风险、提高传质速率等。因此,从嗜热菌中筛选热稳定性强的β-木糖苷酶已成为当前研究的热点。β-木糖苷酶在大肠杆菌表达系统中异源表达时常会伴随着包涵体过多的现象,尤其是来源于嗜热菌的β-木糖苷酶,因其自身含有较多的二硫键,表达后若不能及时正确地折叠,更易形成包涵体,这将极大地影响目的蛋白的有效产量,并限制嗜热菌来源的β-木糖苷酶在大规模水解7-XDT中的应用。分子伴侣能够帮助异源表达的重组蛋白进行正确折叠,提高蛋白的可溶性表达,减少包涵体的形成[14]。因此,利用分子伴侣蛋白质粒(如pKJE6[15]、pTf16[16]等)与目的基因质粒共表达,是提高重组目的蛋白可溶性表达的一种有效手段。
以嗜热菌ThermotogapetrophilaDSM 13995来源的β-木糖苷酶Tpexyl3为研究对象,借助分子伴侣共表达、培养条件优化等方法,提高了该酶在大肠杆菌中的可溶性表达量,在此基础上,将其应用于转化7-XDT制备10-DT,并对该反应工艺进行了优化。
1 材料与方法
1.1 菌种与质粒
β-木糖苷酶基因Tpexyl3(序列数据库登录号:ABQ46867.1)来源于嗜热菌T.petrophila,重组质粒pET-28a-Tpexyl3由本实验构建并保藏;分子伴侣质粒(pKJE6、pKJE7、pG-KJE8、pG-Tf2、pTf16和pGro7),购自日本TaKaRa公司;EscherichiacoliDH5α及E.coliBL21(DE3)感受态细胞,购自南京诺唯赞生物技术有限公司。
1.2 主要试剂
酵母提取物、蛋白胨,美国Oxoid公司;麦芽糊精,市售;蛋白含量检测试剂盒,宝日医生物技术(北京)有限公司;对硝基苯酚木糖苷(pNPX)、考马斯亮蓝G-250、考马斯亮蓝R-250,美国Sigma公司;蛋白电泳缓冲液、预混蛋白电泳Marker,南京天为公司;卡那霉素、氯霉素、四环素、异丙基-β-D-硫代半乳糖苷(IPTG)、L-阿拉伯糖,生物工程(上海)生物科技有限责任公司。
1.3 培养基
溶菌肉汤(LB)培养基:质量分数1.0%蛋白胨、质量分数0.5%酵母提取物、质量分数1.0%氯化钠。富集肉汤(TB)培养基:A液(体积分数90%)为质量分数1.0%麦芽糊精(或其他碳源)、质量分数1.2%蛋白胨、质量分数2.4%酵母提取物;B液(体积分数10%)为磷酸二氢钾17 mmol/L和磷酸氢二钾72 mmol/L。
1.4 主要仪器与设备
Agilent 1260型高效液相色谱仪(HPLC)及S.No. USNH017518型C18 反向色谱柱(直径和长分别为4.6和250 mm,填料颗粒直径5 μm),美国安捷伦科技有限公司;超声波细胞破碎机,宁波新芝生物科技有限公司;ZHWY-2102C摇床,上海智城分析仪器制造有限公司;SpectraMax190型酶标仪,美国分子仪器公司;凝胶成像系统,美国BIO-RAD公司;电泳仪,美国GE Health公司。
1.5 实验方法
1.5.1 分子伴侣蛋白的筛选
6种分子伴侣质粒(pKJE6、pKJE7、pG-KJE8、pG-Tf2、pTf16、pGro7)的主要信息见表1。分别将6种分子伴侣质粒与重组β-木糖苷酶质粒pET-28a-Tpexyl3混合后热击转化至E.coliBL21(DE3)感受态细胞中,利用含有50 μg/mL卡那霉素和20 μg/mL氯霉素抗性的LB平板进行筛选,37 ℃过夜培养。分别挑取6种共表达阳性转化子于5 mL LB液体培养基中,于37 ℃、180 r/min摇床中培养,分别保存菌种。
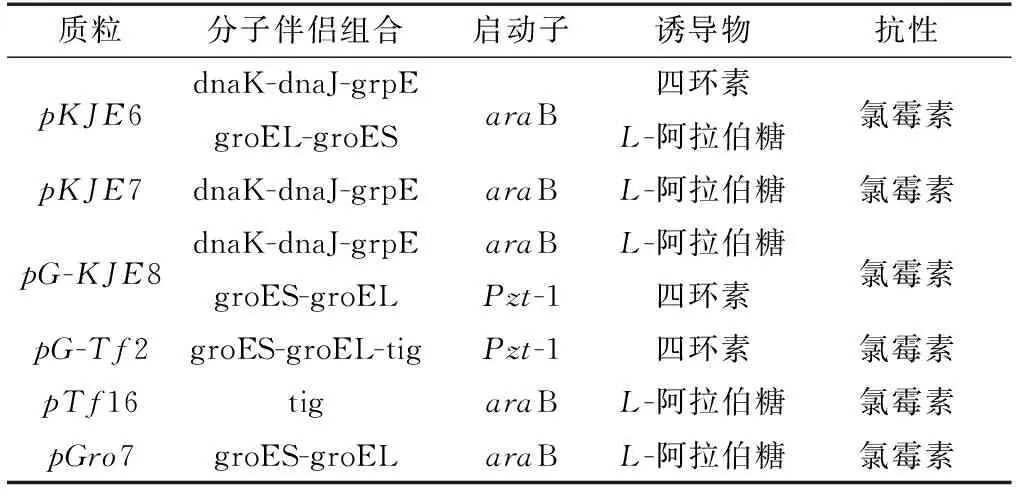
表1 分子伴侣质粒Table 1 Molecular chaperone plasmid
菌种复苏后,转接入含有50 μg/mL卡那霉素和20 μg/mL氯霉素的50 mL LB培养基中,添加0.5 mg/mLL-阿拉伯糖以及(或者)10 μg/mL四环素,于37 ℃、180 r/min摇床培养至600 nm下的吸光度(OD600)至 0.6~0.8,加入0.01 mmol/L的诱导剂IPTG,于37 ℃、180 r/min摇床培养7 h。收集菌液,10 000 r/min 离心10 min后收集菌体;再各用10 mL的20 mmol/L磷酸盐缓冲液重悬菌体,超声破碎后取样为全细胞样品;12 000 r/min离心10 min后收集上清液。分别测定各上清液酶活并进行酶活和聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,筛选出能提高目的蛋白表达的分子伴侣。
1.5.2 培养条件对重组菌生长和蛋白表达的影响
将筛选的共表达菌种接种至5 mL LB培养基中,于37 ℃摇床过夜培养复苏菌种。
TB培养基碳源种类优化:分别接种复苏菌液500 μL至50 mL含有不同碳源(质量分数1%麦芽糊精、1%甘油、1%蔗糖、1%葡萄糖和1%菊粉)的5瓶TB培养基(均含有50 μg/mL卡那霉素、20 μg/mL氯霉素和0.5 mg/mLL-阿拉伯糖)中,保持其他培养条件一致,当OD600约为 0.6时,加入0.01 mmol/L IPTG进行诱导,于37 ℃摇床培养48 h。10 000 r/min离心分别收集菌体、重悬菌体、超声破碎,破碎悬浮液取样为全细胞样品,12 000 r/min离心收集上清液。分别测定各上清液酶活并进行比较,筛选出TB培养基最佳碳源种类。
分别对TB培养基碳源质量分数(0.25%,0.50%,1.00%,2.00%,3.00%和4.00%)、IPTG浓度(0,0.01,0.02,0.05,0.10和0.20 mmol/L)、L-阿拉伯糖质量浓度(0,0.5,1.0,2.0,3.0和4.0 mg/mL)以及诱导温度(20,25,28,32,37和42 ℃)进行优化。重组菌的培养和酶活测定方法同上。
1.5.3 酶活力的测定
以20 mmol/LpNPX为底物,水解得到的对硝基苯酚(pNP)与碳酸钠发生显色反应,在405 nm的波长下测定产物的吸光度。反应体系为:10 μL 500 mmol/L柠檬酸-磷酸氢二钠缓冲液,5 μL底物,混匀预热后加入5 μL游离酶,在酶的最适温度和pH下反应5 min。以不加酶液的反应体系作空白对照,酶活力单位定义参照文献[17],酶活计算公式如下:
β-木糖苷酶酶活 (U/mL) =c/(t×V)×N
(1)
式中:c为酶反应后的对硝基苯含量,μmol;t为酶与底物反应时间,min;V为反应体系中酶液的体积,mL;N为酶液的稀释倍数。
1.5.4 重组蛋白的纯化
将粗酶液于55 ℃下保温30 min,12 000 r/min离心30 min,收取上清液为热处理后酶液。将热处理后酶液上样至Ni+亲和层析柱,使用含有不同浓度咪唑(30,100,200 和400 mmol/L)的洗脱缓冲液进行洗脱,并收集洗脱液。使用SDS-PAGE对纯化的酶液进行分析,采用考马斯亮蓝法测定蛋白质含量。
1.5.5 反应条件对重组酶转化底物的影响
向200 μL的25 mmol/L磷酸氢二钠-柠檬酸缓冲反应体系中加入终质量浓度为500 mg/L 的7-XDT和不同添加量的Tpexyl3,在一定温度下反应3 h后加入200 μL 甲醇终止反应,样品过膜后用HPLC进行检测。改变缓冲溶液的pH(4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5和8.0)、温度(60,70,80,90和99 ℃)以及酶用量(10,25,50,75,100,250和500 U/mL),从而考察pH、温度和酶用量对Tpexyl3水解7-XDT的影响。
Tpexyl3水解7-XDT的时间反应历程检测:Tpexyl3水解7-XDT于90 ℃下反应12 h,每个时间点取样加入200 μL甲醇,样品过膜后用HPLC进行检测。
2 结果与分析
2.1 分子伴侣蛋白的筛选
将重组质粒pET-28a-Tpexyl3分别与6种分子伴侣质粒等体积混合后,共同转入E.coliBL21(DE3)表达宿主中,获得6种共表达菌株:pET-28a-Tpexyl3-pKJE6、pET-28a-Tpexyl3-pKJE7、pET-28a-Tpexyl3-pG-KJE8、pET-28a-Tpexyl3-pGro7、pET-28a-Tpexyl3-pG-Tf2和pET-28a-Tpexyl3-pTf16。培养后收集菌体,经SDS-PAGE对目的蛋白的表达进行分析,结果如图1所示。其中,质粒pKJE6、pKJE7、pG-KJE8和pGro7分别与pET-28a-Tpexyl3共表达时,包涵体沉淀较pET-28a-Tpexyl3单独表达时明显减少。
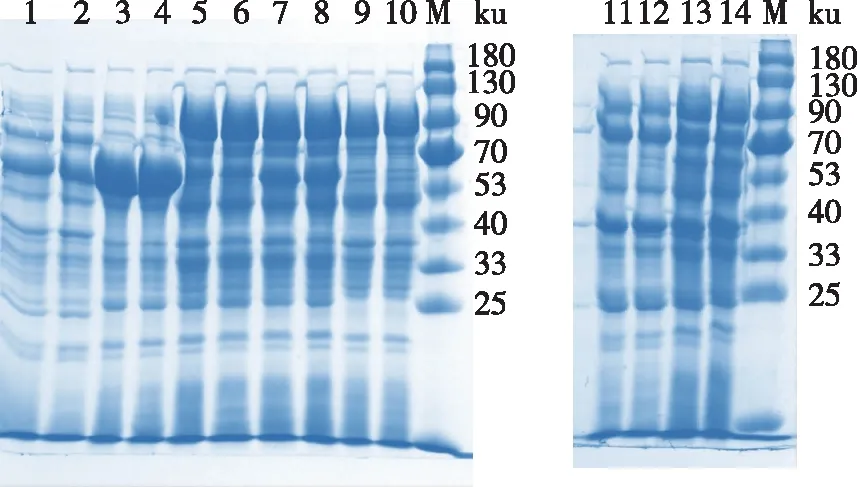
1)Tpexyl3全细胞;2)Tpexyl3上清液;3)pET-Tpexyl3-pG-KJE8全细胞;4)pET-Tpexyl3-pG-KJE8上清液;5)pET-Tpexyl3-pG-Tf2全细胞;6)pET-Tpexyl3-pG-Tf2上清液;7)pET-Tpexyl3-pTf16全细胞;8)pET-Tpexyl3-pTf16上清液;9)pET-Tpexyl3-pGro7全细胞;10)pET-Tpexyl3-pGro7上清液;M)蛋白Marker;11)pET-Tpexyl3-pKJE6全细胞;12)pET-Tpexyl3-pKJE6上清液;13)pET-Tpexyl3-pKJE7全细胞;14)pET-Tpexyl3-pKJE7上清液。图1 分子伴侣筛选的SDS-PAGE分析Fig. 1 SDS-PAGE analysis of chaperones screening
分别测定各自上清液的酶活并进行比较,结果如图2所示,pET-28a-Tpexyl3-pKJE7的酶活明显高于其他共表达菌株,这表明当分子伴侣蛋白质粒pKJE7与重组质粒pET-28a-Tpexyl3共表达时能显著减少包涵体含量,提高目的蛋白的有效表达。因此,选取pET-28a-Tpexyl3-pKJE7进行后续实验。
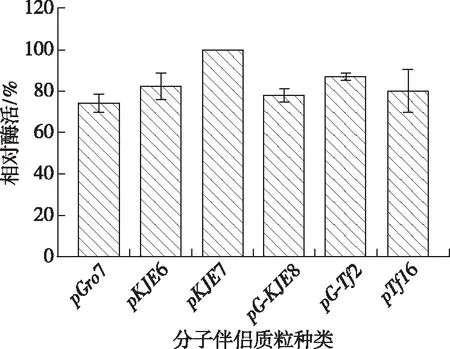
图2 分子伴侣种类筛选酶活测定Fig. 2 Chaperones screening and enzyme activities
2.2 Tpexyl3与分子伴侣共表达的条件优化
为进一步获得目的蛋白的高效表达,使用TB培养基对pET-28a-Tpexyl3-pKJE7进行培养条件优化,结果见图3。由图3可以得知,pET-28a-Tpexyl3-pKJE7表达目的蛋白的最优条件为:质量分数1.00% 的麦芽糊精作为TB培养基的碳源,不添加诱导剂,于32 ℃摇床培养48 h,最高表达量可至190 U/mL,是无分子伴侣参与下LB培养基中表达量(6.81 U/mL)的27.9倍,且高于其在7.5 L发酵罐中连续发酵10 h后的表达量(151.43 U/mL)。目的蛋白Tpexyl3在不添加诱导剂时即可达到高效表达。这可能是由于在培养基中微量的乳糖已足够启动目的基因的转录,其本底表达即可获得极高的表达量,即使微量的IPTG都会降低目的蛋白的表达量,这在实际应用中更具有应用前景。
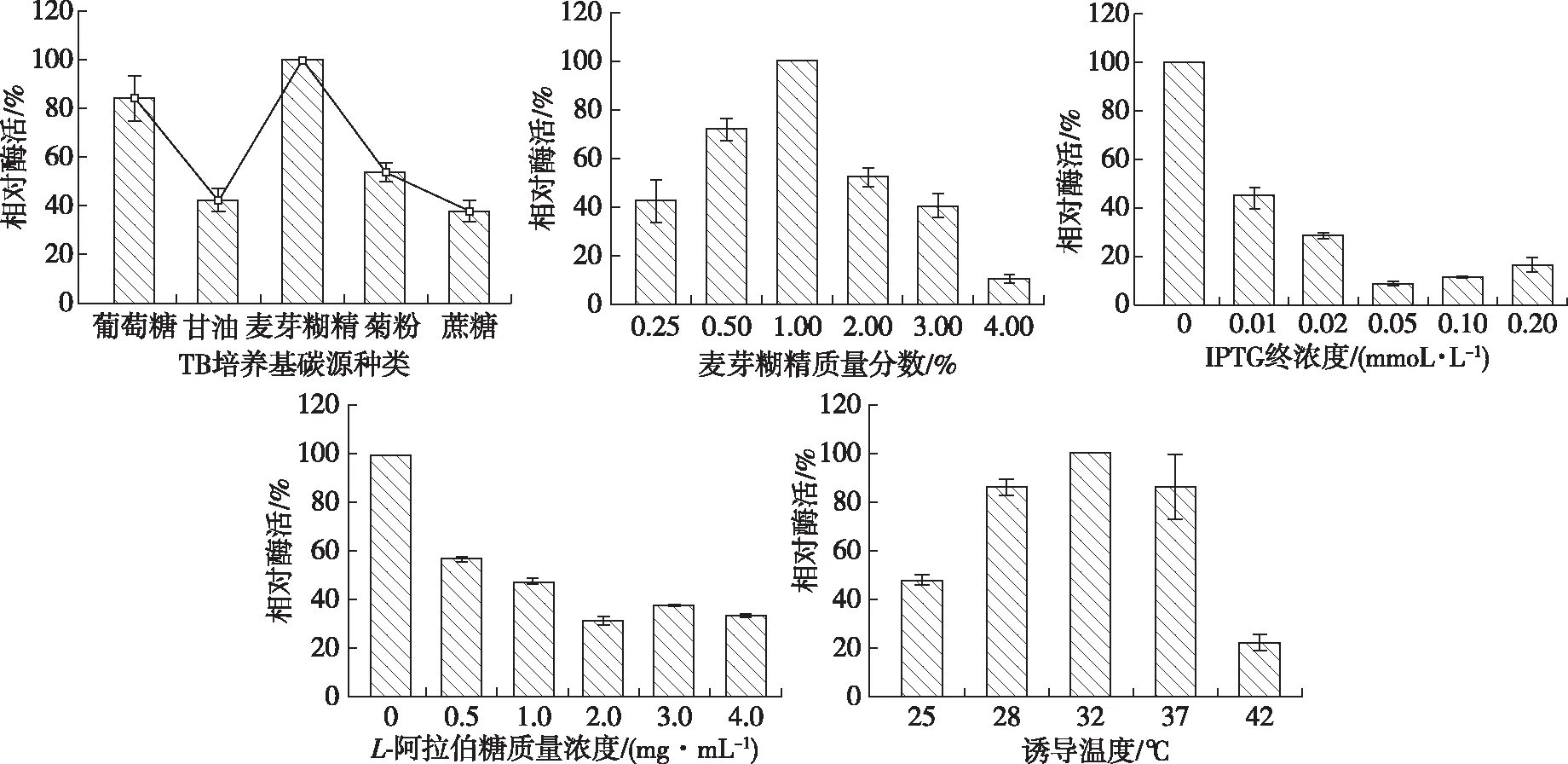
图3 重组酶Tpexyl3的表达条件优化Fig. 3 Optimization of expression conditions and purification of recombinant Tpexyl3
2.3 Tpexyl3的纯化及酶活性测定
诱导后的pET-28a-Tpexyl3-pKJE7,经超声破碎、热处理和亲和层析纯化后获得了电泳纯的目的蛋白,纯化过程及结果如表2所示。由表2可知,pET-28a-Tpexyl3-pKJE7的比酶活为205.76 U/mg,得率为6.57%,纯化倍数为2.46倍。经SDS-PAGE凝胶电泳分析,结果如图4所示,在87 ku(预测目的蛋白理论大小)左右,有单一条带,纯化获得电泳纯重组酶Tpexyl3。
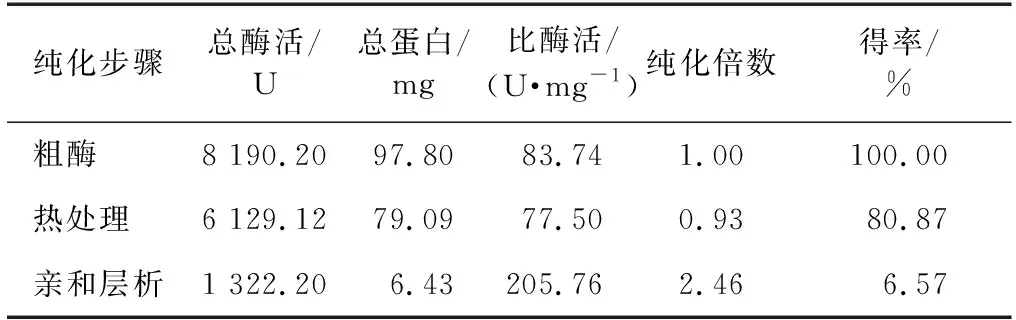
表2 重组酶Tpexyl3的纯化Table 2 Purification of recombinant Tpexyl3
获得纯化酶后,对Tpexyl3的最适反应温度与最适反应pH再次进行测定,结果表明,Tpexyl3的最适反应温度为90 ℃,最适反应pH为6.0,结果与Zhang等[18]测定结果一致。可见与分子伴侣共表达时,Tpexyl3的基本性质未受影响,目的蛋白正确折叠。
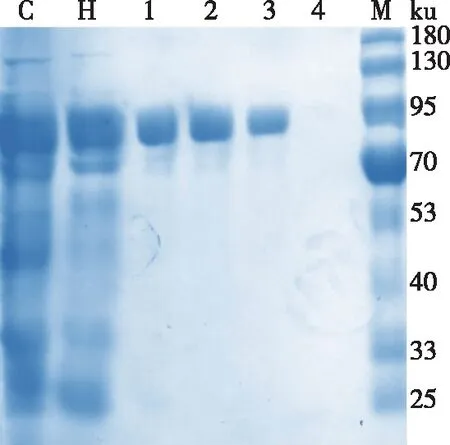
C为粗酶液;H为热处理;1~4为咪唑洗脱液(30, 100, 200和400 mmol/L);M为蛋白Marker。图4 重组酶Tpexyl3 SDS-PAGE分析Fig. 4 SDS-PAGE of recombinant enzyme Tpexyl3
2.4 Tpexyl3转化7-XDT的反应条件优化
7-XDT与紫杉醇具有相同的母核结构(图5),对7-XDT的C-7位去木糖基化,是以7-XDT为底物酶法制备紫杉醇过程中的关键步骤。为了获得Tpexyl3水解7-XDT的最适pH、最适温度、最适反应时间及最适用酶量,以灭活的Tpexyl3 处理7-XDT的含量为对照,结果如图6所示。在pH 5.5、80 ℃温度下,添加250 U/mL Tpexyl3反应4 h,可将500 mg/L 7-XDT转化为162 mg/L 10-DT,物质的量转化率可至45.59%。
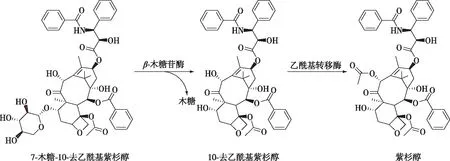
图5 酶法转化7-XDT生成紫杉醇流程图Fig. 5 Biotransformation of 7-XDT into taxol
参考Tpexyl3的热稳定性,4 h反应后体系中应仍有残余酶存在。因此,为最大限度发挥添加酶的利用度及检测反应过程中各组分的变化,通过分时段取样,研究了延长反应时间至12 h的整体反应历程,结果如图6d所示。在整个转化过程中,7-XDT含量逐渐降低,10-DT含量逐渐增高,2 h内产物量达到最高,2 h后反应体系各组分保持不变。底物未能完全转化,这可能与反应体系中的产物抑制相关。
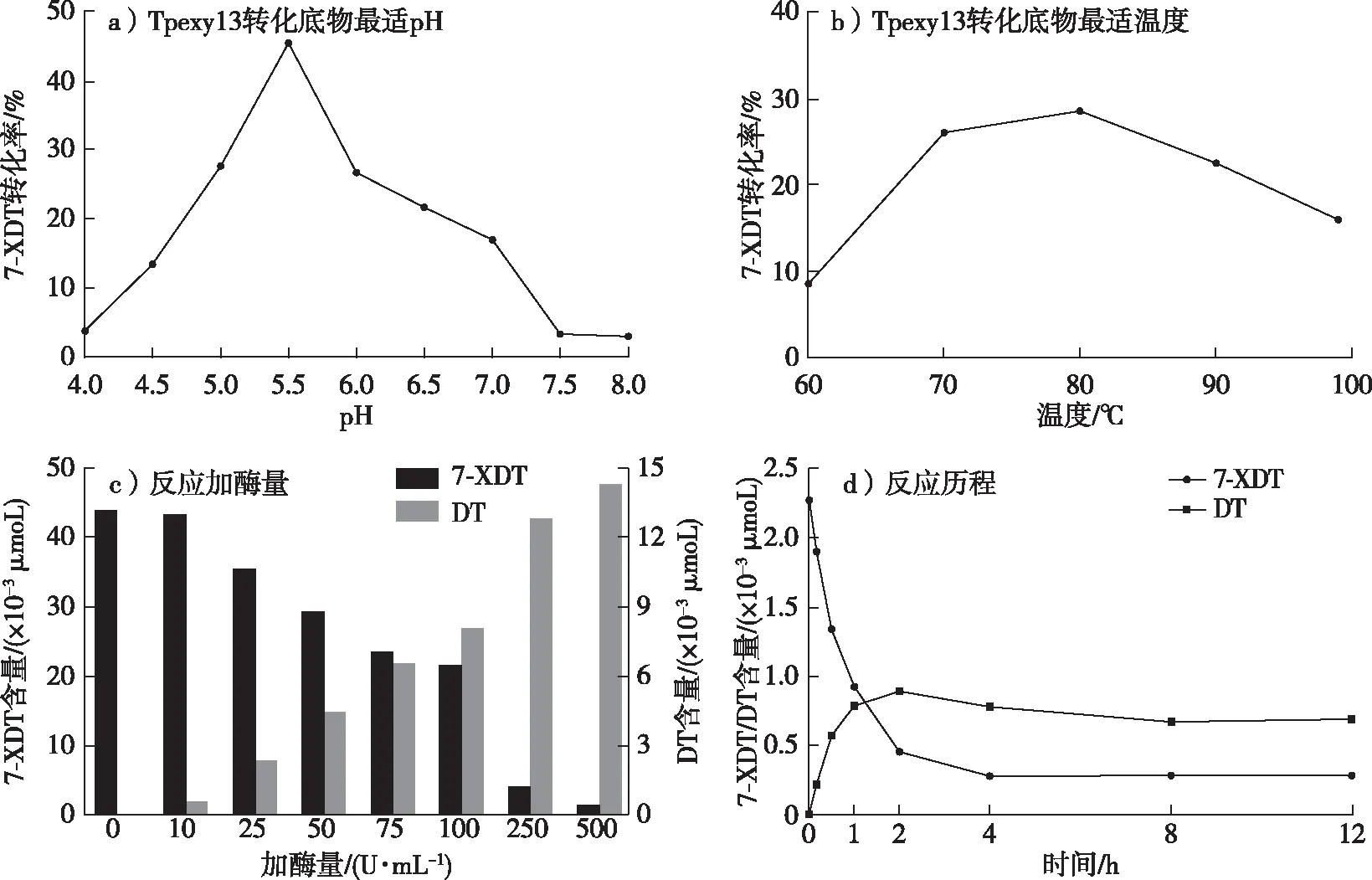
图6 重组酶Tpexyl3转化7-XDT生成10-DT反应条件优化Fig. 6 Optimization of reaction conditions for the transformation of 7-XDT to 10-DT by recombinant enzyme Tpexyl3
3 结 论
1)将分子伴侣蛋白质粒与目的蛋白质粒在大肠杆菌中共表达,经筛选后发现伴侣蛋白dnaK-dnaJ-grpE能成功帮助嗜热菌T.petrophilaDSM 13995来源的β-木糖苷酶Tpexyl3正确折叠,提高目的蛋白可溶性表达量。经优化,Tpexyl3的表达量最高可达190 U/mL。研究结果为提高大肠杆菌表达系统中目的蛋白的可溶性表达,提供了一种较为可行的方法。
2)Tpexyl3能有效转化7-XDT生成10-DT,在pH 5.5、80 ℃、酶用量 250 U/mL等适宜条件下反应4 h,可将500 mg/L 7-XDT转化为162 mg/L 10-DT,物质的量转化率为45.59%。下一步将通过酶的定向改造、催化转化体系等方法进一步优化,提高7-XDT转化为10-DT的效率,为以7-XDT为底物制备紫杉醇的技术创新提供支撑。
