热处理及脱木质素对南方松木材吸湿极限与细胞壁饱和状态的影响
2021-05-31李京予马尔妮
李京予,马尔妮
(北京林业大学木材科学与工程北京市重点实验室,北京 100083)
木材与水分的关系是木材科学领域的重要课题之一,其中,关于木材纤维饱和点(fiber saturation point, FSP,公式中记为FSP)的研究备受关注。通常,由不同测量方法所测得的FSP存在差异,其测量方法大致可分为直接测量法和间接测量法两种[1],前者主要包括溶剂排出法、多孔板法、离心脱水法等实测法,即木材经过饱水或高湿处理后通过直接测量结合水含量来确定其纤维饱和点,所测数值一般偏高;后者主要为外推法,即通过等温吸附曲线拟合估算纤维饱和点,其值偏低。Babiak等[2]曾将木材置于100%的相对湿度中平衡5个月后再用水浸泡1个月,发现试样发生进一步润胀,进而建议将纤维饱和点分为吸湿极限(hygroscopicity limit, HL)与细胞壁饱和(cell wall saturation, CWS)两种表达方式。因此,直接测量法所测得的FSP可能与CWS状态相对应,而间接测量法所测得的FSP或许反映了木材在HL状态下的含水率。此外,也有相关学者研究发现木材吸湿极限和细胞壁饱和之间的不同[3-4],佐证了HL与CWS状态之间的差异是细胞壁进一步润胀所导致。
时域核磁共振(time domain nuclear magnet field resonance,TD-NMR)技术主要通过考察自旋核之间以及自旋核和周围环境之间的弛豫特性来进行分子种类的鉴别[5]及分子动力学研究[6]。木材中的水分含有大量的1H,是核磁共振能够测定的原子核之一。基于对木材中水分横向弛豫时间(T2)的考查,近年来木材与水分相互作用的研究取得了长足进步。根据核磁共振反演图谱中峰的分布,可实现对木材中水分状态和含量的定性、定量分析,辅以冻融技术可确定细胞壁润胀状态时木材中的结合水含量(即CWS状态下的FSP)[3,7-9]。
对木材细胞壁中水分环境的表征主要是对其物理环境(细胞壁孔隙)和化学环境(亲水性基团)进行研究。在木材改性研究中,通常从细胞壁的物理环境和化学环境变化的角度揭示木材细胞壁的改性机理。热处理是木材改性技术中广泛应用的一种方法,可以单独使用或与其他浸渍改性方法复合,从而提升木材尺寸稳定性、防水性、耐生物劣化性和耐候性等。另一方面,脱木质素近年来成为木材功能性改良的重要预处理手段之一,将木材中的木质素部分或全部脱除,便于细胞的进一步压缩,或后续浸渍功能性改良试剂。以上两种处理方法都会改变细胞壁的物理环境和化学环境,进而导致HL和CWS状态下的水分分布和FSP变化。
本研究旨在通过热处理和脱木质素处理改变木材细胞壁的物理环境及化学环境,进而考察处理后细胞壁水分在HL和CWS状态下的变化情况,最终进一步明确HL与CWS差异产生的机理。
1 材料与方法
1.1 试验材料与设备
采用南方松(Pinusspp.)作为试验用材,选择早晚材分布均匀、无明显生长缺陷的边材部分,以首尾相连的方式加工成5 mm(R)×5 mm(T)×20 mm(L)的试样。
Niumag NMRC12-010V核磁共振仪,磁体强度0.5 T,线圈直径10 mm,磁体温度32 ℃,外接控温系统,可提供测试温度范围为-40~25 ℃,苏州纽迈电子科技有限公司;Autosorb-iQ2-MP比表面积和孔径分布分析仪,美国康塔仪器公司;VERTEX 70V傅里叶变换红外光谱仪,德国BRUKER公司;101-1AB电热鼓风干燥箱,上海一恒科学仪器有限公司;MHGB-120CAUB恒温恒湿箱,上海一恒科技有限公司;AL204电子分析天平,梅特勒-托利多国际贸易(上海)有限公司;自制真空加压浸渍设备。
1.2 试验方法
将试样置于电热鼓风干燥箱内,在(103±2)℃下干燥至绝干,记录质量和尺寸。
1.2.1 高温热处理
预热干燥箱至60 ℃,将试样放入其中平衡0.5 h;随后缓慢升温至225 ℃,待温度稳定0.5 h后保持4 h;之后降温冷却,整个过程在水蒸气保护下进行;最后将高温热处理后的试样干燥至绝干,记录质量和尺寸。
1.2.2 脱木质素处理
首先对试样进行苯醇抽提,脱除抽提物;将试样浸泡在苯醇混合溶液(体积比2∶1)中充分抽提48 h后,放入温度为60 ℃的水浴锅中加热3 h,用蒸馏水洗净,气干后放入干燥箱烘至绝干;将绝干试样放入装有967 mL蒸馏水、20 g亚氯酸钠和13 mL冰醋酸混合溶液的烧杯中,于40 ℃的恒温水浴锅中隔水加热30 h即可脱去部分木质素[17];最后用蒸馏水充分洗净试样,气干后进一步干燥至绝干,记录质量和尺寸。
1.2.3 氮气吸附及傅里叶红外光谱检测
将未处理组命名为对照组,热处理组和脱木质素处理组分别命名为TM和DL,共3组,每组5个平行试样。各组中随机取2个试样,利用粉碎机将试样粉碎,并筛选出粒径0.250~0.425 mm(40~60目)的木粉,随后进行氮气吸附测试以表征试样细胞壁孔隙结构(物理环境)变化,以及傅里叶红外光谱(FT-IR)检测以考察化学组分(化学环境)变化。
1)氮气吸附测试。取约0.2 g木粉在40 ℃下真空干燥8 h,之后采用比表面积和孔径分布分析仪测量氮气吸附等温线。测试分为真空脱气和氮气吸附两部分,脱气温度为80 ℃,脱气时间为11 h。
2)傅里叶红外光谱检测。将筛选出的木粉、溴化钾试剂放在干燥箱中分别以105和120 ℃烘至绝干。将木粉与溴化钾按1∶100的质量比混合均匀,压片后检测。扫描范围400~4 000 cm-1,扫描次数32次,分辨率4 cm-1。
1.2.4 试样调湿处理
将3组绝干处理后的试样调湿至HL和CWS状态。
1)HL组:在25 ℃恒温环境下,利用去离子水形成100%的相对湿度环境。试样绝干处理后,置于上述环境中吸湿,定期测量试样质量并计算含水率。当含水率变化达到每日不超过0.02%时,认为试样达到吸湿极限。
2)CWS组:将HL状态试样置于真空加压罐中饱水处理,即先抽真空至-0.1 MPa,保持30 min后通入去离子水,再加压至0.5 MPa并保压1 h;放出液体卸压后,用纸巾拭去试样表面多余水分,测量饱水质量;随后将试样浸泡在去离子水中备用。
1.2.5 TD-NMR试验
利用CPMG脉冲序列获取自旋-自旋弛豫时间,序列参数设置需保证试样内水分完全弛豫,设定如下:90°脉冲宽度5 μs,180°脉冲宽度10 μs,采样频率250 kHz,累加次数128,重复等待时间3 000 ms,半回波时间100 μs,回波个数10 000。测试结束后利用SIRT算法进行反演。在常温条件(25 ℃)下,首先对HL状态的试样(共3组,每组3个)进行TD-NMR测试,试样经过饱水处理达到CWS状态后再次进行TD-NMR测试,随后从各组试样中随机选出一个试样进行-3 ℃条件下的TD-NMR测试。通过对比-3与25 ℃条件下检测到的试样T2弛豫信号总量,即可得到细胞壁饱和状态时的结合水含量。
1.3 数据分析
经调湿处理及饱水处理后的试样含水率[MC-HL(MC-CWS)]计算公式为:
(1)
式中,ms为试样经水分处理(调湿处理或饱水处理)后的质量,g。
根据-3和25 ℃下的TD-NMR反演曲线计算CWS状态下的细胞壁水分含量。在-3 ℃条件下,细胞腔内自由水冻结,通过直接对比-3 ℃与常温条件下检测到的试样T2弛豫信号总量,可得到细胞壁饱和状态时的水分含量,即CWS状态下的FSP[6,10]。根据公式(2)计算-3与25 ℃条件下的峰面积比例,可得到木材细胞壁水分含量(Mb):
(2)
式中:S-3 ℃为-3 ℃时CWS状态的T2反演峰总面积;S25 ℃为25 ℃时检测到的试样内水分T2反演峰总面积。
由于NMR信号强度与温度成反比,需考虑冷冻处理温度对反演峰信号的影响,因此,不同温度下的数据比较需对测得的信号量进行修正。本研究以室温25 ℃(298 K)为参考温度,其他参数不变,因此,-3 ℃(270 K)条件下测得的信号峰面积需乘以修正系数270/298[12]。
2 结果与分析
各组试样的质量损失率和体积变化率如表1所示。在近似的热处理和脱木质素处理条件下,两组质量损失率数值与以往研究相近[18-19],出现的差异可能是由树种和处理设备不同引起的。高温热处理后细胞壁化学成分降解[20],部分细胞壁无定形区被破坏[21],木质素的缩聚导致细胞壁微纤丝内部和外部空隙减少[22]。脱除木质素后,胞间层和细胞角隅出现空隙,在干燥作用下,细胞间隙减少,试样整体尺寸产生收缩[23]。

表1 不同试样的质量损失率和体积变化率Table 1 Mass loss rates and volumetric changes of different samples %
2.1 结构分析
2.1.1 氮气吸附分析
各组试样的氮气吸附-脱附曲线见图1a,依据IUPAC的分类,均属于IV型等温线,存在H3型回滞环,主要具有介孔、一定数量大孔以及极少量微孔结构。根据前人的研究[24],孔径2~50 nm的介孔结构主要对应于细胞壁孔隙;孔径大于50 nm的大孔结构主要对应于细胞腔、细胞间隙以及纹孔。同时,细胞壁孔隙主要产生于微纤丝内部无定形区,以及微纤丝间填充的木质素与半纤维素基质(matrix)。
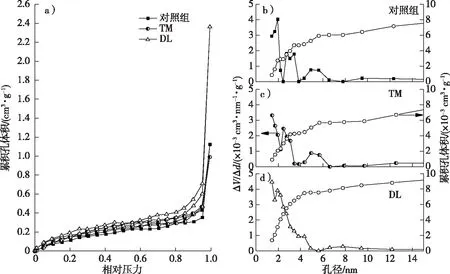
图1 各试样氮气吸附-脱附等温线(a)及0~15 nm范围内的累积孔体积和通过BJH法计算得出的介孔孔径分布(b)~(d)Fig. 1 Nitrogen adsorption-desorption isotherms (a), accumulated pore volume and the BJH mesopore-size distribution in the range of 0-15 nm of different samples (b)-(d)
从图1a中可以看出,相比对照组,热处理组吸附氮气量减小,脱木质素处理组吸附氮气量增加。0~15 nm孔径分布和累计孔体积见图1b~d。从对照组孔径分布图中可以观察到3个峰,分别出现于2,3和5 nm附近,表明这3处孔径范围内孔隙出现频率较高,该结果与其他研究相近[19],其差异可能与树种不同有关。与对照材相比,经过热处理后,2 nm以下的孔径分布数量减少,整体孔径分布向左移动,孔隙孔径减小。经过脱木质素处理后,2 nm以下的孔径分布数量增多,表明该孔径范围内的孔隙数量增加,整体孔径分布向左移动,孔隙孔径呈减小趋势。
不同试样的比表面积、总孔容和介孔孔径见表2。从表2中可以看出,经热处理和脱木质素处理后的木材孔隙比表面积均有所增大。热处理组总孔容由1.74×10-3cm3/g降低到1.53×10-3cm3/g,介孔孔径减小,这是因为热处理过程中木材细胞壁的半纤维素发生降解,纤维素无定形区存在一定降解,木质素缩聚,细胞壁matrix部分形成交联结构[25-26]。在处理后的干燥过程中,纤维素的角质化程度增强[27],因此,细胞壁孔隙的孔径和孔容均有所减小。脱木质素组总孔容升高到3.65×10-3cm3/g,而介孔孔径减小,结合孔径分布分析可得,脱木质素后的细胞壁出现更多小孔径介孔。其原因可能是被脱除的matrix产生新的孔隙,并且在后续干燥时细胞壁剩余的matrix出现孔隙塌陷现象[28],因此,细胞壁孔隙的孔容增大,孔径减小。此外,由图1a可知,在较高的相对压力区域,脱木质素处理后的试样吸附量明显增大,表明细胞壁或胞间层中出现介孔及以上尺度的较大孔隙[23],这种变化可能是由于细胞角隅或胞间层部分木质素被脱除[19],使得细胞壁暴露出新的孔隙[23]。因此,热处理和脱木质素处理均可使细胞壁的介孔孔径减小,不同的是,脱木质素后细胞壁孔隙数量增加,孔容增大,细胞壁可及吸着位点增多[23]。

表2 不同试样的比表面积、总孔容和介孔孔径Table 2 Specific surface area, total pore volume and average mesopore diameters of different samples
2.1.2 傅里叶红外光谱分析

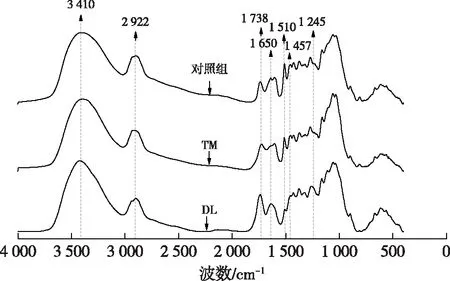
图2 不同处理材的红外光谱图Fig. 2 FT-IR spectra of different samples
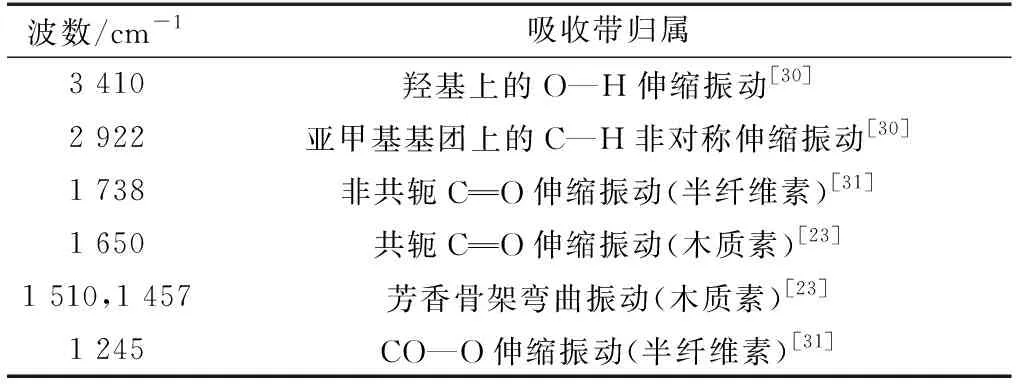
表3 南方松红外光谱特征峰归属表Table 3 FT-IR absorption peak assignment of southern pine
2.2 HL与CWS状态下各组试样水分的T2分布
在-3 ℃条件下测得的各组试样在CWS状态时的T2分布,以及在25 ℃条件下测得的各组试样分别在HL和CWS状态时的T2分布如图3所示。信号峰从左至右依次被标记为1,2,3。T2的大小通常与水分受到木材的束缚程度有关,一般取决于水分在木材中的物理及化学环境。对于物理环境,水分在较小的孔隙中会受到更大的束缚[18];对于化学环境,水分与亲水性基团的氢键结合状态也对其弛豫行为造成影响[32]。因此,可以将T2值不同的反演峰归属于木材中受束缚程度不同的水分。其中,结合水与木材结合紧密,存在于细胞壁较小孔隙中,T2较短,通常小于10 ms;反之,自由水没有与木材实质产生氢键结合,存在于孔隙较大的细胞腔中,T2较长,可达几十到几百毫秒[33]。
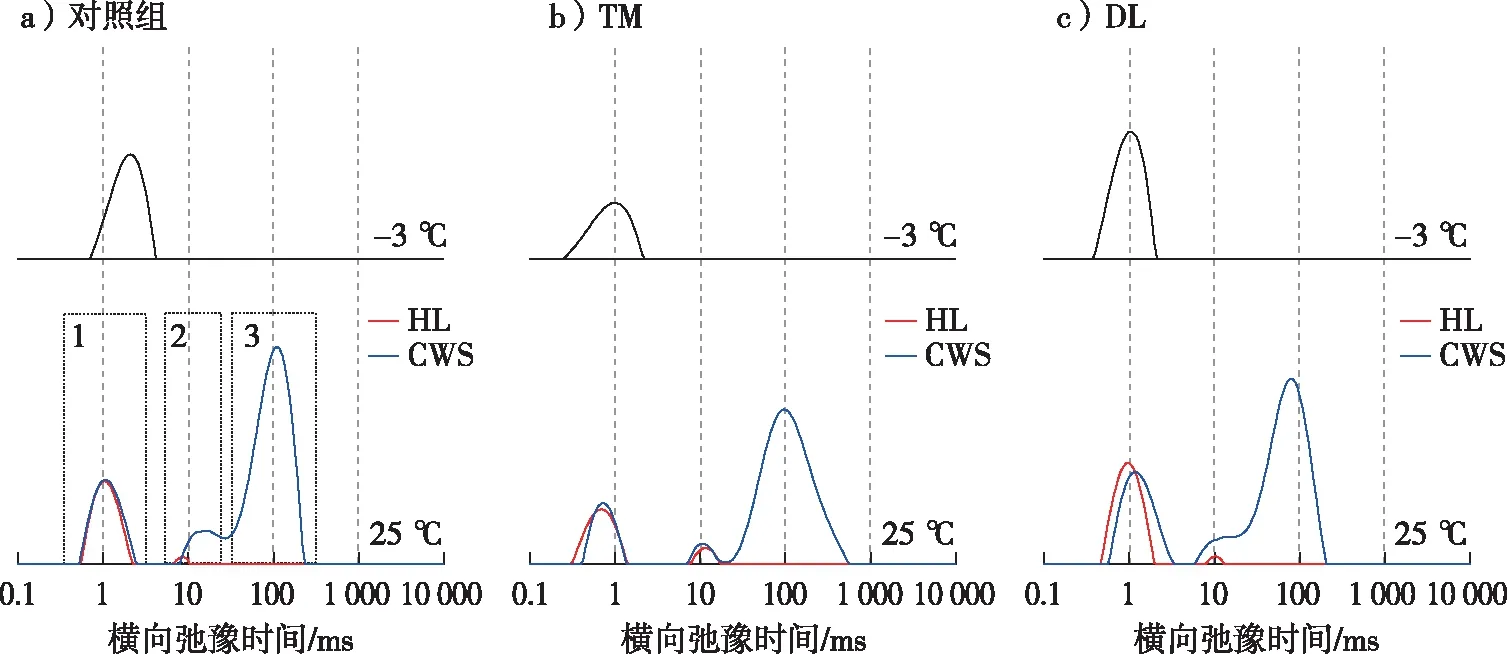
图3 不同试样-3 ℃时CWS状态以及25 ℃时HL和CWS状态的T2分布Fig. 3 T2 distribution of different samples in the CWS state at -3 ℃ and HL and CWS states at 25 ℃
由图3可知,25 ℃时HL状态下存在2个信号峰(红线),水分主要以结合水的形式存在于细胞壁中,峰2可能是在高湿度下形成的毛细管凝结水[5,34];CWS状态下存在3个峰(蓝线),经过饱水处理后,细胞腔内出现自由水,其中峰2和峰3两峰相连,表明峰2和峰3所对应的水分存在交换[11]。因此,根据以往研究结果可知,峰1是位于细胞壁中的结合水,峰2是位于孔径较小空隙(如纹孔以及管胞尖端)中的水分,峰3是位于管胞腔中的自由水[11,35]。
当温度降低到-3 ℃时,仅存在一个结合水信号峰(黑线)。有研究指出,受信号反演算法的制约,细胞壁结合水的信号受到自由水信号的影响,直接以常温条件T2弛豫分布评估细胞壁结合水含量并不准确[10,36]。因此,采用冻融分析技术将自由水冻结,单独获取结合水弛豫信号。通过对比常温与-3 ℃条件下检测到的试样内水分T2弛豫信号总量,可精确计算细胞壁饱和时的结合水含水率,即CWS状态下木材的FSP。
试样在25 ℃下HL和CWS状态的MC、在-3 ℃时CWS状态下的FSP及其各信号峰T2分布范围见表4。与对照组相比,经过处理后的试样在HL状态下峰1均向左移动,结合水受束缚的程度增强。如孔隙结构表征和红外检测结果所示,热处理改变了细胞壁的物理环境,细胞壁孔隙孔径减小,对水分的束缚程度增强;脱木质素处理后,水分吸着位点暴露增多,并且增加了细胞壁微孔数量,共同起到对水分束缚程度增强的效果[11,19]。从图3中可以看出,25 ℃下每组试样在HL和CWS这两种状态时的峰1分布不完全重合,结合表4中的各峰分布区域,以对照组为例,可以进一步确定饱水处理后峰1向右移动(由0.56~2.10 ms移至0.56~2.41 ms)。有研究指出,CWS峰1区域包含两种存在于细胞壁的水分形式,一种通过氢键与木材细胞壁的化学组分进行结合,另一种则占据细胞壁内的孔隙[7,37],且后者受束缚程度低于前者。结合差式量热扫描法的研究结果[38],将该部分水分定义为自由结合水[10]。因此,峰1的右移是由于经过饱水处理后,细胞壁进一步润胀,进入细胞壁微孔的水分使其T2变长,饱水处理后细胞壁对水分的束缚程度减弱。通过表4分析可知,经过热处理后,峰1分布区域由HL状态下的0.32~1.38 ms移至CWS状态下的0.43~1.29 ms,分布区域稍向右侧移动;脱木质素处理后,峰1呈现明显右移的趋势(由0.49~1.96 ms移至0.60~3.18 ms)。与对照组相比,经过饱水处理后,热处理组试样的细胞壁对新进入细胞壁的水分限制程度更强,膨胀行为减弱,而脱木质素组对细胞壁水分的限制程度减弱,膨胀行为增强。两种处理方法之间的差异在于热处理能够减少羟基结合位点,细胞壁中的木质素因热处理缩聚,纤维素角质化增强,形成了更坚固的结构;而脱木质素处理会暴露更多的羟基结合位点,且细胞壁加固的成分减少,化学组分更容易滑移。
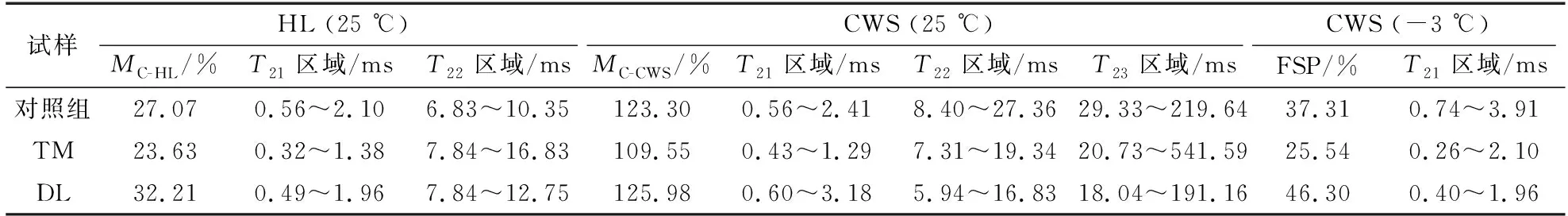
表4 不同试样25 ℃时HL和CWS状态下,以及-3 ℃时CWS状态下的含水率及其T2分布范围Table 4 The MC of the HL and CWS at 25 ℃, and CWS at -3 ℃ of different samples and their T2 distributions
从表4中可以看出,相比于对照组的峰2和峰3分布(8.40~27.36和29.33~219.64 ms),处理组在CWS状态下都呈现左移趋势(热处理组分别为7.31~19.34和20.73~541.59 ms;脱木质素组分别为5.94~16.83和18.04~191.16 ms)。由图3可知,峰2与峰3之间的融合情况在热处理后减弱,在脱木质素处理后增强。热处理使得部分纹孔发生闭合[22],减弱了细胞腔不同位置水分的交换,而脱木质素处理则起到了相反的效果,纹孔膜上的小孔增加,增强了水分交换。
2.3 HL与CWS状态下各组试样的水分含量变化
根据公式(2)可以计算出CWS状态下的FSP,由表4可以看出各组试样在25 ℃时的HL状态与-3 ℃时的CWS状态下细胞壁水分含量变化。
经过饱水处理后,试样的细胞壁水分含量进一步增加,新进入细胞壁的水分使细胞壁的纤维素分子链产生滑移并软化细胞壁基质,由此产生新的瞬时孔隙并暴露出更多亲水性基团吸着点,因此可容纳更多水分[7],该部分水分可能属于自由结合水。分别对各组的HL、CWS状态下的细胞壁水分含量进行比较,可以得出,经过热处理后,HL与CWS状态试样的细胞壁水分含量下降,这与FT-IR的测试结果一致,表明热处理过程中木材细胞壁吸湿性成分的降解,从而使其细胞壁化学环境发生改变,与水分进行结合的吸着点数量减少[4],并最终导致结合水含量下降。经过脱木质素处理后,HL与CWS状态下试样细胞壁水分含量提高,脱木质素处理使得试样半纤维素相对含量增加,暴露出更多水分吸着位点,吸湿能力增强,作为细胞壁的黏结物质,木质素的脱除促进了纤维素分子链之间的滑移;而脱木质素处理后细胞壁介孔及微孔增多,在饱水作用下可容纳更多水分。对照组、热处理组和脱木质素组的HL、CWS状态下的细胞壁含水率差值分别为10.24%,1.91%和14.09%,即经热处理后差值减小,经脱木质素处理后差值增大。因此,热处理可以减小HL与CWS状态之间的含水率差异,而脱木质素处理则相反。
未处理材CWS与HL状态之间具有差异的水分,即自由结合水,可能存在于饱水处理后细胞壁形成的新孔隙中,则脱木质素处理使两者差异进一步变大的原因可能为脱木质素处理后,微孔及小孔径介孔分布增加,饱水处理后可容纳更多的水分[23],为自由结合水的形成提供了物理环境。同时,脱木质素暴露出更多水分结合位点,为自由结合水的形成提供了化学环境。而热处理后半纤维素降解,降解产物以共价键的方式产生交联,木质素发生缩聚,共同限制细胞壁与水分的相互作用,且介孔数量减少、孔径减小,进而降低细胞壁可容纳水分的能力[27],难以形成自由结合水。
从实际应用角度分析,HL和CWS代表了两种FSP,两者之间存在差值。HL是木材细胞壁与水分进行氢键结合的极限状态,该状态下的细胞壁并没有达到饱和状态[3,7];而CWS则是细胞壁容纳水分最大限度的状态。此外,用材性转折点法测得的FSP约为30%[1],与HL状态测得的结合水含量(27.07%)相近,表明HL状态下的FSP可以预测试样的尺寸和强度等开始突变时的含水率,而CWS状态下的FSP则可用于进一步评估改性剂的浸渍情况。
3 结 论
本研究以南方松为研究对象,先对其进行热处理以及脱木质素处理,然后进行调湿处理与饱水处理,分别达到其HL与CWS状态,并采用TD-NMR研究热处理材和脱木质素处理材两种FSP之间的差异。
1)经热处理后,木材细胞壁孔隙的总比表面积增大,总孔容和介孔孔径均减小。热处理过程中发生了半纤维素和木质素的降解,以及木质素的缩合反应。经过脱木质素处理,比表面积增大,总孔容增大,介孔孔径减小。脱木质素处理可以使细胞壁产生新的小孔径介孔。
2)在25 ℃条件下,各组试样的HL状态包含2个反演峰,分别代表结合水与部分毛细管凝结水;CWS状态包含3个峰,分别对应结合水、存在于纹孔或较小孔径位置的自由水、细胞腔中的自由水。对照组、热处理组以及脱木质素组在HL状态下的FSP分别为27.07%,23.63%和32.21%,在CWS状态下的FSP分别为37.31%,25.54%以及46.30%。
3)HL状态下细胞壁没有达到完全饱和,而饱水处理可以使细胞壁进一步饱和,两者之间产生的含水率差异是由自由结合水引起的。相比于未处理材,热处理材HL与CWS状态下的结合水含量差异减小,而脱木质素处理材的差异增大。
