高效苯酚降解菌Bacillus sp. L5-1的分离及其降解特性
2021-05-29刘庆辉王志宇张玮川贾银娟张秋根罗旭彪
刘庆辉,李 剑,杨 航,王志宇,李 艳,张玮川,贾银娟,张秋根,罗旭彪
高效苯酚降解菌sp. L5-1的分离及其降解特性
刘庆辉,李 剑*,杨 航,王志宇,李 艳,张玮川,贾银娟,张秋根,罗旭彪
(南昌航空大学,重金属污染物控制与资源化国家地方联合工程研究中心,江西 南昌 330063)
从污水处理厂活性污泥中分离筛选出一株高效苯酚降解菌L5-1,经菌落形态观察和16S rDNA基因测序,结果表明菌株L5-1为蜡样芽胞杆菌(),美国国家生物信息中心(NCBI)的注册号为MN784421.将苯酚设置为唯一碳源,对其生长和苯酚降解特性展开研究.结果表明: 菌株L5-1在10%接种量、温度30~35℃、pH值7~8的条件下,均能高效降解培养基中苯酚(培养基体积为100mL,初始苯酚浓度为500mg/L,14h时降解率>93%).而在最优降解条件下(10%接种量,培养温度为35℃,pH值7.0,NaCl浓度为1%),初始苯酚浓度为500mg/L,菌株在14h内的苯酚降解率可达97.1%;而当初始苯酚浓度为1000mg/L,菌株也可在46h内达到97.71%的降解率.运用Haldance方程动力学模拟菌株在不同浓度苯酚下的生长过程,其最大比生长速率为0.355h-1,半饱合常数104.27mg/L,抑制常数为322.83mg/L,2=0.997.菌株L5-1为目前已报道的菌属中降解苯酚能力较强的菌株,为实际处理含酚废水中提供理论参考.
;苯酚;生物降解;动力学
苯酚污染废水是一种典型的高毒性工业废水,是纺织加工、煤炭气化、石油精炼、皮革制造、树脂合成、医药制造、香料生产、合成纤维等许多工业过程中常见的有机污染物[1].并且苯酚具有很强的流动性,在浓度很低时(1mg/L)也能快速渗透到周围生态环境中,导致水体有难闻的气味和味道,对动植物有长效性和生物积累性[2].美国和中国也先后将苯酚列入首批水中优先控制污染物名单[3].目前含酚废水的处理方法主要有物理法、化学法和生物法.利用生物法替代物理化学法矿化废水中的苯酚具有成本低、效率高等特点,且降解后的最终产物多为环境无害物质,如低碳化合物,二氧化碳和水[4-5].因此,利用生物法处理含酚废水受到广泛关注.
近年来,国内外学者就如何利用微生物降解苯酚污染废水进行了大量的研究, 筛选出多种菌株,有根瘤菌()[6]、不动杆菌如[7]和sp.AQ5NOL 1[8]、红球菌如[9]和spp.CM-HZX1[10]、产碱杆菌(sp.)[11]等.其中有许多能降解高浓度苯酚并具有良好耐受性的微生物,如Jiang等[12]从湖北某药厂的生物池中分离出genus,能在72h内降解800mg/L苯酚.陈晓华等[13]从北京一处人工湿地分离出的sp.可耐受1300mg/L苯酚并在48h内对1000mg/L苯酚降解率达到82.2%,王图锦等[14]从一个焦化厂受污染的土壤中分离出不动杆菌,能在60h内完全降解初始浓度1200mg/L苯酚. Shourian等[15]从制药处理废水中分离出的sp.能在85h内降解1000mg/L苯酚.在目前发现的众多苯酚降解菌中,有不少研究报道菌属能有效降解苯酚.J20 在120h内对700mg/L的苯酚降解率为88.6%[16],降解1000mg/L苯酚需132h[17].其中降解废水中苯酚的研究较少,苯酚降解效率也较低,菌株F6在8h内仅能降解100mg/L苯酚[18],B3降解800mg/L的苯酚需72h[19].
本文取江西南昌象湖污水处理厂的曝气池活性污泥,在实验室模拟工业含酚废水逐步驯化苯酚降解菌,筛选出一株对高浓度苯酚耐受并且降解效果优异的菌株L5-1,探讨了培养条件(接种量、温度、pH值、盐度、初始苯酚浓度)对L5-1生长及苯酚降解的影响.并将实验数据与Haldance方程动力学模型相拟合,探究了菌株生长和初始苯酚浓度之间的关系,以期为微生物处理苯酚污染废水提供理论参考.
1 材料与方法
1.1 菌种的来源
本研究用来分离筛选菌株的样品取自江西南昌象湖污水厂曝气池活性污泥(黑色絮状).
1.2 培养基的制备
无机盐培养基(g/L):NH4NO31.50,KH2PO41.50, K2HPO41.2, NaCl 5.00, MgSO40.06, MnSO40.02, H3BO30.02,ZnSO4.7H2O 0.03, FeSO40.05,通过1mol/L的NaOH和HCl调节pH值.定容至指定体积后灭菌备用.
富集培养基(g/L):牛肉浸膏4,蛋白胨8,NaCl 4.定容至指定体积后灭菌备用.
固体培养基:在已配好的液体培养基中加入1.8%(质量分数)的琼脂粉制成固体培养基,经高压灭菌锅中灭菌后倒入无菌培养皿冷却备用.
1.3 菌种的富集与驯化
将适量活性污泥加入到100mL无菌生理盐水中,在30℃,150r/min下充分振荡1h,取10%体积的菌液,在无菌环境下接种到灭菌后的富集培养基中.在30℃,150r/min下培养到对数增长期后,取10mL富集菌液接种到90mL的无机盐培养基中,并添加苯酚作为唯一碳源.在同样的培养条件下重复此操作,以100mg/L为增加量逐步提升苯酚浓度至1000mg/L. 选择生长较好的培养基进行下一步实验.
1.4 苯酚降解菌的筛选与纯化
用无菌水将培养至对数期的菌液稀释成不同浓度梯度.在无菌环境下均匀地涂布在固体培养基表面.在恒温培养箱中倒置培养,定时观察,挑取形态及大小、颜色不同的单一菌落,于事先配置好的300mg/L苯酚的固体无机盐培养基上划线,得到单一纯菌.将分离的单一纯菌富集培养至OD600为1.0左右,作为接种体备用.以10%(体积比)的接种量加入到无机盐培养基中,添加苯酚作为唯一碳源.在30℃、150r/min,以相同条件下没有加入菌液但添加了相同浓度苯酚的无机盐培养基作为对照组,通过定时检测各培养基的苯酚浓度选择出降解效果最好的菌株,最后再反复划线确保得到单株菌种.并用斜面低温保存.
1.5 菌株生长和苯酚降解率的测定
细菌生长量的测定:采用不含菌液的无机盐培养基作为对照参比,在波长600nm处测定菌种吸光值(OD600).代入公式(1)计算菌体质量浓度(DCW)[19].
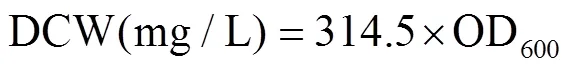
苯酚浓度采用4-氨基替比林法测定苯酚浓度[20],代入公式(2)计算培养基苯酚降解率

1.6 菌株的鉴定及系统发育树的构建
1.6.1 形态学及生理生化鉴定 将菌株接种于固体培养基中观察其菌落形态,采用扫描电镜(SU1510)在10000倍下观察菌株L5-1的表面形态.测定菌株革兰氏染色、好氧性等生理生化指标.
1.6.2 16S rDNA序列分析 将要鉴定的菌株在固体培养基中划线培养至对数期后,用试剂盒(上海生工)提取分离出菌株L5-1的基因组DNA,采用细菌通用引物27F 和反向引物1492R 扩增反应DNA序列[21].将产物电泳检测后进行测序分析(上海生工).测序结果在BLAST和MEGA4.1软件中进行基因库比对分析和以邻位相接法构建系统发育树,初步获得菌株的生物学分类地位.
1.7 菌株生长及降解苯酚特性
以不同体积比的接种量(6%、8%、10%、12%、14%)、不同培养温度(15, 20, 25, 30, 35, 40, 45℃)、不同pH值(4, 5, 6, 7, 8, 9, 10)、不同NaCl浓度(0%、2%、4%、6%、8%、10%、12%、14%、16%)在体积为100mL,初始苯酚浓度为500mg/L的无机盐培养基中进行单因素试验,在150r/min的振荡培养箱中培养, 间隔1h取一次样,测定培养基中生物量和苯酚降解率,确认其最适宜的苯酚降解条件.
菌株在不同初始苯酚浓度下的降解:根据以上试验确定的最佳接种量、温度、pH值以及NaCl浓度接种于不同初始苯酚浓度(200~1400mg/L)的无机盐培养基中,在150r/min的培养箱中间隔2h取一次样,测定培养基中的生物量和苯酚含量.以上试验均重复3次.
1.8 苯酚降解动力学分析
在微生物降解苯酚的过程中,降解底物苯酚既作为微生物的唯一碳源,又因为其毒性会对微生物生长产生抑制作用[22].因此本研究采用Haldane方程来描述初始苯酚浓度对菌株L5-1生长的影响[23], 如公式(3)所示
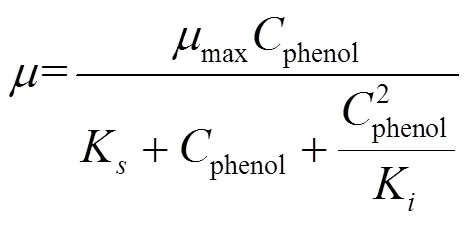
式中:为微生物比生长速率, h-1;max为最大比生长速率, h-1;phenol为苯酚质量浓度, mg/L;s为半饱和常数, mg/L;K为抑制常数, mg/L.并用Origin8.0将实验数据与动力学方程拟合.
2 结果与讨论
2.1 苯酚降解菌的筛选与鉴定

图1 菌株L5-1的扫描电镜图

图2 菌株L5-1的16S rDNA序列进化树
通过多次富集驯化和分离纯化后,本研究得到4株对高浓度苯酚具有较高降解效果且能够良好生长的菌株,其中一株菌株具有良好的苯酚耐受性以及高效的苯酚降解率,将该菌株命名为L5-1,观察其菌落形态和部分生理生化特征,结合16S rDNA鉴定其菌种.经观测,L5-1菌落形态为白色,圆形,不透明,表面粗糙.革兰氏染色呈红色,为革兰氏阳性菌.进行琼脂柱穿刺实验发现其为兼性好氧菌.扫描电镜(10000×)结果如图1所示,可以看出菌体为杆状,表面较为平整,不透明,大小在1.5~2mm左右,且生长状况良好.
测定16Sr DNA核酸序列,并将序列在GenBank数据库中作比对分析,构建了菌株L5-1与其他相近菌株之间的系统发育关系(图2).结果显示菌株L5-1与蜡样芽孢杆菌(. MH19)相似性为99.6%,根据同源性分析结果,该菌株归属于sp.,鉴定结果为蜡样芽孢杆菌().该菌株的基因序列已提交至NCBI基因库,其注册号为MN784421.
2.2 接种量对菌株L5-1降解苯酚的影响
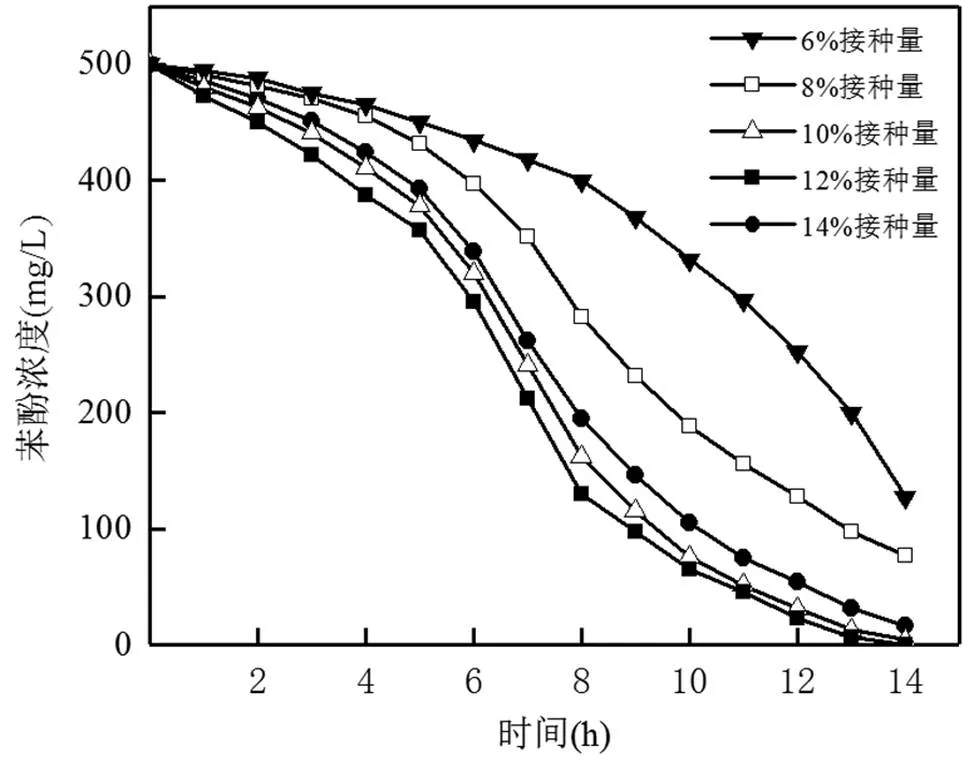
图3 不同接种量对菌株L5-1降解苯酚的影响
接种量的多少会对菌株降解苯酚产生直接影响,接种量过少会导致菌株更容易受到苯酚的抑制作用,接种量过高则会增加投入成本,会造成菌株之间对碳源的竞争,影响降解效果.如图3所示,接种量为6%菌液时,培养基中菌株在14h内对500mg/L苯酚的降解率为74.4%,菌株降解苯酚的停滞期随着接种量的增高而明显缩短,培养基中苯酚的浓度也在不断降低,接种量为10%、12%时,在14h内培养基中浓度为500mg/L的苯酚均被完全降解,接种量为14%时,在14h内培养基中苯酚降解率为96.8%.说明适当的提高接种量是提升菌株降解苯酚效果的一种有效途径.可以看出接种量超过10%时菌株对苯酚的降解效果提升不明显,接种量过大时反而影响到菌株的降解效果,且会增加经济成本,综合考虑选择10%作为菌株L5-1的最佳接种量.
2.3 温度对菌株L5-1生长和降解苯酚的影响
温度是影响微生物生长繁殖的重要因素,选择出合适的温度能有效提高微生物酶活性,有助于提升参与苯酚降解的酶促反应速率[23].从图4中可以看出,菌株L5-1的最佳生长和降解苯酚温度为35℃,并在30~35℃之间对500mg/L苯酚在14h的降解率都大于95%(30℃为95.4%,35℃为96.9%),且生长状况良好.该菌株具有典型的嗜中温特点,培养温度在15和45℃时生物量和降解率都达到最低(15℃时降解率19.7%,45℃时降解率24.6%).这可能是因为培养温度过低会使参与酚类降解的微生物酶活性降低,细菌新陈代谢速率变慢,温度过高则容易让微生物酶失去活性[24].

图4 温度对菌株L5-1生长及苯酚降解的影响
初始苯酚浓度500mg/L,14h
2.4 pH值对菌株L5-1生长和降解苯酚的影响
如图5所示,菌株L5-1的最佳生长和降解苯酚pH值为7.0,14h内对500mg/L苯酚降解率为97%,培养基中pH值低于7.0后,随着pH值的下降菌株对苯酚的降解率逐渐下降,当培养基中pH值为4.0时,菌株基本不生长.当pH值超过7.0后,菌株在碱性条件下对苯酚的降解率和生长状况相比酸性条件下有明显提高(pH值为5.0时31.3%,pH值为6.0时70.6%,pH值为8.0时93.4%,pH值为9.0时61.7%,pH值为10.0时7.8%).这是因为苯酚在降解过程中会产如己二酸、丙酮酸等有机酸,致使培养基的pH值逐渐降低,所以中性和偏碱性环境相比酸性环境更有利于菌株降解苯酚[25-26].并且在偏酸和偏碱的条件下,菌株L5-1的生长和苯酚降解效率都明显下降.这可能由于pH值影响到了微生物的生长和代谢,进而影响到微生物对培养基中营养物质的吸收和苯酚的降解[27].在pH值为6.0~9.0条件下,菌株L5-1在14h内对苯酚的降解率都大于60%,表面菌株L5-1对pH值有良好的耐受范围且该菌株更耐碱性环境.
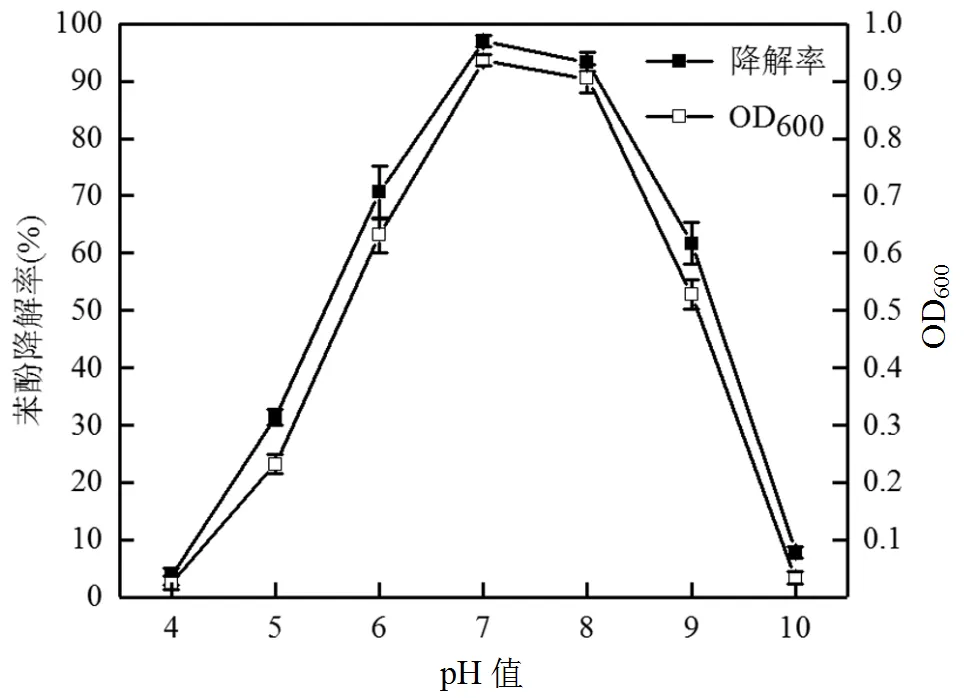
图5 pH值对菌株L5-1生长及苯酚降解的影响
初始苯酚浓度500mg/L,14h
2.5 NaCl对菌株L5-1生长和降解苯酚的影响
在工业废水的排放过程中,除了高浓度含酚污染物之外,通常还含有大量盐分,过高的盐分会抑制菌株的生长且对微生物有一定的毒害作用[28].如图6所示,菌株最适宜NaCl浓度为1%.当NaCl浓度在2%~6%范围内时,菌株L5-1和苯酚降解率在68h内对500mg/L苯酚降解率都为97%左右,当培养基中NaCl浓度超过6%时,菌株的生长和苯酚降解随着NaCl浓度的升高而明显受到抑制.当培养基中NaCl浓度增加至10%时,菌株L5-1的生长量和苯酚降解率仍达到0.58和62.7%,表明菌株对盐浓度有很好的耐受性.王丽娟等[29]发现sp.CCZU-R6在5%的盐度下降解500mg/L苯酚,72h时内降解率仅在50%左右,在8%的盐度下降解500mg/L苯酚,72h时降解率仅在20%左右.黄中子等[30]发现一株sp.在5%的盐度下降解500mg/L苯酚,72h内的去除率达98%.因此,菌株L5-1与现有的菌株相比具有较宽的盐浓度适应范围和较快的降解速率,在处理含盐苯酚废水中有一定的优势.

图6 NaCl浓度对菌株L5-1生长及苯酚降解的影响
初始苯酚浓度500mg/L,68h
2.6 菌株生长与苯酚的降解
菌株L5-1在最佳降解条件下(10%的接种量、温度为35℃、pH值为7.0、NaCl浓度为1%)接种至初始苯酚浓度为500mg/L的无机盐培养基中,其随时间的生长与苯酚降解曲线如图7所示.
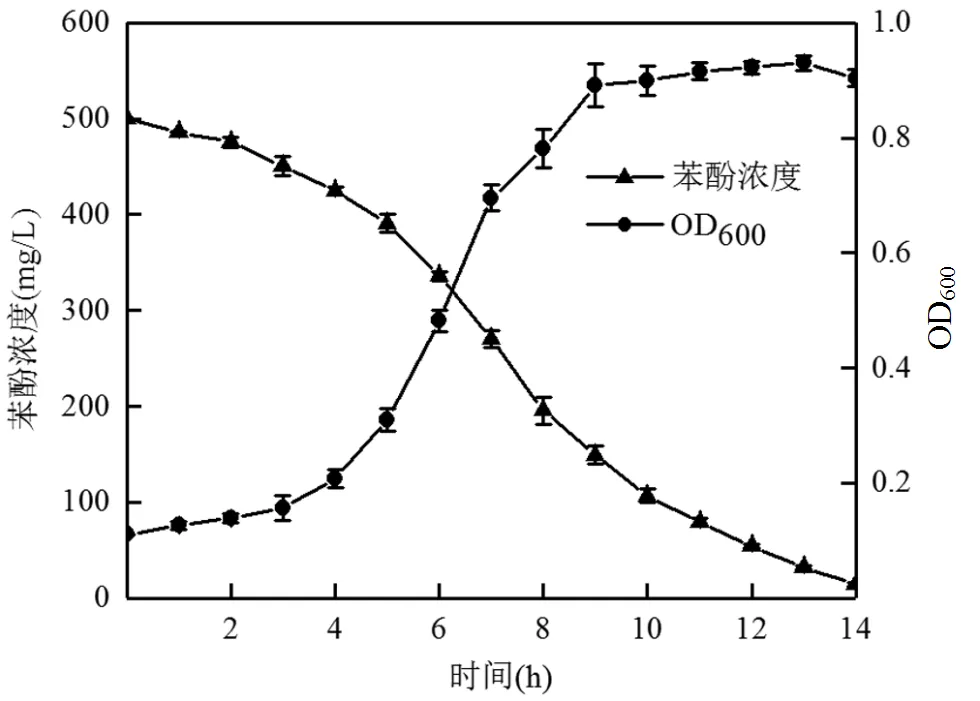
图7 最佳条件下菌株L5-1的生长及苯酚降解曲线
由图7可知,L5-1经历了近4h的停滞期,在此期间苯酚浓度下降缓慢,5~9h进入对数生长期,细菌数量增长极其迅速,苯酚含量随着细菌数量的增加而迅速下降,并在接种13h后达到静止期,此时培养基中细菌总数达到最大,其OD600值为0.93.到14h时,对500mg/L苯酚的降解率达到97.1%.
2.7 初始苯酚浓度对降解率的影响
菌株在不同初始苯酚浓度下,苯酚浓度随时间降解效果如图8所示.当初始苯酚浓度为200mg/L时,在6h内苯酚降解率达到89%.46h对1000mg/L苯酚的降解率达到97.71%.随着初始苯酚浓度的提高,菌株的停滞期也相应的增加,菌株降解相同含量的苯酚所需的时间逐渐延长.当初始苯酚浓度为1200mg/L时,66h才将培养基中苯酚浓度降解到32mg/L左右,降解率为97.4%.而当初始苯酚浓度为1400mg/L时,苯酚66h内的降解率仅为29.0%,由此可见,高浓度苯酚对菌株L5-1的生长有强烈的抑制或毒害作用,使得菌株降解苯酚速率变得尤为缓慢.
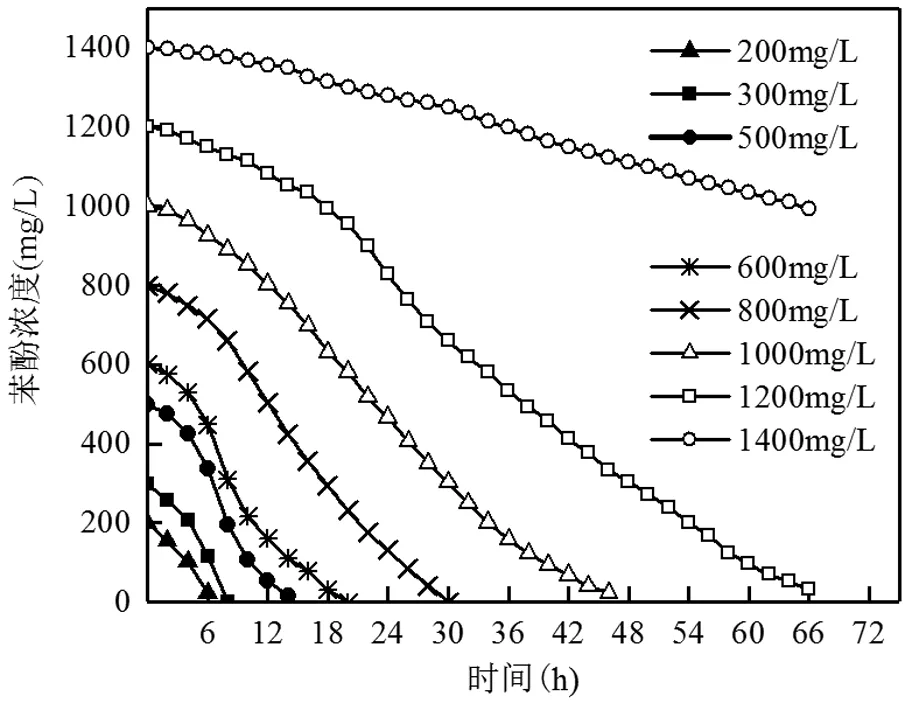
图8 不同初始苯酚浓度对菌株L5-1降解苯酚的影响
2.8 菌株L5-1对苯酚的降解动力学研究
将微生物比生长速率和苯酚初始质量浓度通过非线性最小二乘法按照方程拟合(图9),方程动力学参数为:max=0.355h-1,s=104.27mg/L,K为322.83mg/L,降解苯酚最适浓度为183.78mg/L.实验数据与模型拟合吻合良好,相关系数2为0.997.结果表明,苯酚是一种抑制底物,初始苯酚浓度低于183.78mg/L时,菌株L5-1的比生长速率与初始苯酚浓度成正比关系,这是因为培养基中降解菌缺乏足够的碳源供其生长,此时培养基中底物的浓度对菌株的生长速率起主导作用.初始苯酚浓度高于183.78mg/L时,菌株L5-1的比生长速率成负相关,此时初始苯酚浓度的升高使其对菌株抑制作用逐渐增强.
表1中为目前已报道的几种微生物苯酚降解动力学参数,其中max表示最大比生长速率,s饱和常数大小表示菌株对苯酚的亲和性,s越小表示菌株对苯酚的亲和性越大,菌株的比生长速率也就更快, K抑制常数则表示苯酚对菌株的抑制强度和毒害大小, K值越大,苯酚对菌株的抑制和毒害作用也就越小,菌株耐受苯酚程度就越大[22].由表可以看出,菌株L5-1比较于其它苯酚降解菌的最大比生长速率和饱和常数相差不大,属于一般水平,其抑制常数大于sp.CH10[13]、波茨坦短芽孢杆菌[22]和n.sp[31]等其它苯酚降解菌,说明菌株L5-1具有良好的苯酚耐受能力.

表1 不同微生物的苯酚降解动力学Haldhance方程参数
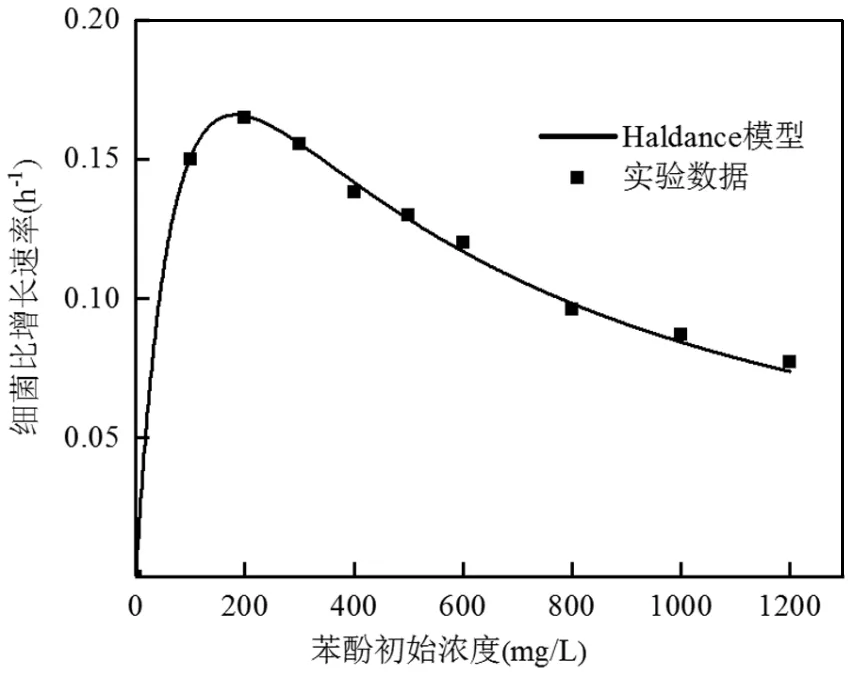
图9 菌株L5-1苯酚降解动力学
3 结论
3.1 从污水处理厂活性污泥中分离出一株苯酚降解菌.鉴定分析为芽孢杆菌属(sp.),命名为L5-1.该菌株对苯酚具有高效的降解能力.其中最佳降解条件是接种量为10%,生长温度为35℃,pH值7.0,NaCl浓度为1%.
3.2 菌株降解不同初始浓度苯酚动力学与Haldance模型吻合良好,经拟合其生长参数为max= 0.355h-1,s=104.27mg/L,K=322.83mg/L.相关性系数(2)为0.997.
3.3 该菌株相比于其他降酚菌株具有较宽的环境适应范围和更高的降解效率,14h对500mg/L苯酚的降解率达到97.71%,46h对1000mg/L苯酚的降解率达到97.7%.因此,该菌株在含酚废水的生物降解领域有极大的应用潜力.
[1] Mao Z, Yu C, Xin L. Enhancement of phenol biodegradation bysp. through ultraviolet-induced mutation [J]. International Journal of Molecular Sciences. 2015,16(12):7320-7333.
[2] Massalha N, Shaviv A, Sabbah I. Modeling the effect of immobilization of microorganisms on the rate of biodegradation of phenol under inhibitory conditions [J]. Water Research, 2010,44(18): 5252-5259.
[3] 王 兵,刘璞真,任宏洋,等.非均相催化臭氧化降解水中苯酚动力学[J]. 环境工程学报, 2016,10(7):3427-3433. Wang B, Liu P Z, Ren H Y, et al. Degradation kinetics of catalytic ozone oxidation of phenol in water [J]. Chinese Journal of Environmental Engineering. 2016,10(7):3427-3433.
[4] 陈治希,刘昭文,杨 凯,等.微生物降解酚类污染物的研究进展[J]. 广州化学, 2015,40(1):72-78. Chen Z X, Liu Z W, Yang K, et al. Progress of phenolic compounds degradation by microbes [J].Guangzhou Chemistry, 2015,40(1):72-78.
[5] Lu Z, Guo X, Li H, et al. High-throughput screening for a moderately halophilic phenol-degrading strain and its salt tolerance response [J]. International Journal of Molecular Sciences. 2015,16(12):11834- 11848.
[6] Wei G H, Yu J F, Zhu Y H, et al. Characterization of phenol degradation bysp. CCNWTB 701isolated from Astragalus chrysopteru in mining tailing region [J]. Journal of Hazardous Materials, 2008,151(1):111-117.
[7] 陈 明,张 维,徐玉泉,等.醋酸钙不动杆菌PHEA-2对苯酚的降解特性研究[J]. 中国环境科学, 2001,21(3):226-229. Chen M, Zhang W, Xu Y Q, et al. Study on characteristics ofPHEA-2 for phenol degradation [J]. China Environmental Science, 2001,21(3):226-229.
[8] Ahmad S A, Shamaan N A, Arif N M, et al. Enhanced phenol degradation by immobilizedsp. strain AQ5NOL 1[J]. World Journal of Microbiology and Biotechnology, 2012,28(1): 347-352.
[9] 刘艳霞.降酚菌的定向驯化及其对含酚废水的降解作用[D]. 北京:北京化工大学, 2011. Liu Y X. The teaming of phenol-degraded bacteria and its biodegradability to phenolic wasterwater [D]. Beijing: Beijing University of Chemical Technology, 2011.
[10] 魏 霞,周俊利,谢 柳,等.苯酚降解菌CM-HZX1菌株的分离、鉴定及降解性能研究[J]. 环境科学学报, 2016,36(9):3193-3199. Wei X, Zhou J L, Xie L, et al. Isolation, identification and characterization of phenol-degrading strain CM-HZX1 [J]. Acta Scientiae Circumstantiae. 2016,36(9):3193-3199.
[11] 徐 庆.苯系物降解菌的筛选及其降解特性研究[D]. 曲阜:曲阜师范大学, 2017. Xu Q, Screening of benzene series degradation bacteria and study on their degradation characteristics [D]. Qufu: Qufu Normal University.
[12] Jiang Y, Yang K, Wang H, et al. Characteristics of phenol degradation in saline conditions of a halophilic strain JS3 isolated from industrial activated sludge [J]. Marine Pollution Bulletin, 2015,99(1/2):230-234.
[13] 陈晓华,魏 刚,刘思远,等.高效降酚菌株sp. CH10生长动力学和苯酚降解特性的研究[J]. 环境科学, 2012,33(11):3956- 3961. Xu X H, Wei G, Liu S Y, et al. Growth kinetics and phenol degradation of highly efficient phenol-degradingsp. CH10 [J]. Environmental Science, 2012,33(11):3956-3961.
[14] 王图锦,潘 瑾,刘雪莲.高效苯酚降解菌PDB1的筛选及降解特性研究 [J]. 科学技术与工程, 2017,17(2):301-304. Wang T J, Pan J, Liu X L, et al. Breeding of Phenol-degradation Bacteria and Studyon Phenol Biodegradation by the Strain PDB1[J]. Science Technology and Engineering, 2017,17(2):301-304.
[15] Shourian M, Noghabi K A, Zahiri H S, et al. Efficient phenol degradation by a newly characterizedsp. SA01 isolated from pharmaceutical wastewaters [J]. Desalination, 2009,246(1-3): 577-594.
[16] Ereqat S I, Abdelkader A A, Nasereddin A F, et al. Isolation and characterization of phenol degrading bacterium strainJ20 from olive waste in Palestine [J]. Journal of Environmental Science and Health, Part A. 2018,53(1):39-45.
[17] Arutchelvan V, Kanakasabai V, Elangovan R, et al. Kinetics of high strength phenol degradation using[J]. Journal of Hazardous Materials. 2006,129(1-3):216-222.
[18] 刘鸿杰,何熙璞,李 浩,等.苯酚降解菌F6的筛选鉴定及降解特性[J]. 基因组学与应用生物学, 2017,36(1):233-238. Liu H J, He X P, Li H, et al. Isolation and identification of phenol degradation strain F6 and its degradation characteristic [J]. Genomics and Applied Biology, 2017,36(1):233-238.
[19] 于彩虹,陈 飞,胡琳娜,等.一株苯酚降解菌的筛选及降解动力学特性[J]. 环境工程学报, 2014,8(3):1215-1220. Yu C H, Chen F, Hu L N, et al. Selection of phenol degradation bacteria and characteristic of degradation kinetics [J]. Chinese Journal of Environmental Engineering, 2014,8(3):1215-1220.
[20] HJ 503-2009 水质水中挥发酚类测定4-氨基安替比林分光光度法[S]. HJ 503-2009 Water quality-ddetrmination of volatile phenolic compounds-4-AAP spectrophotometric method [S].
[21] 冯玉雪,毛 缜,吕蒙蒙.一株DDT降解菌的筛选及其降解特性 [J]. 中国环境科学, 2018,38(5):1935-1942. Feng Y X, Mao Z, Lv M M. Screening and degradation characteristics of a DDT-degrading bacteria [J]. China Environmental Science, 2018,38(5):1935-1942.
[22] 葛启隆,王国英,岳秀萍.波茨坦短芽孢杆菌降解苯酚特性及动力学研究 [J]. 生物技术通报, 2014,(3):117-122. Ge Q L, Wang G Y, Yue X P. Phenol degradation byand kinetic analysis [J]. Biotechnology Bulletin, 2014, (3):117-122.
[23] 赵娜娜,许继飞,宋晓雪,等.嗜盐高效降酚菌株sp. H17的筛选及降解苯酚特性 [J]. 环境科学学报, 2019,39(2):318-324. Zhao N N, Xu J F, Song X X, et al. Screening and phenol-degrading characteristics of a highly efficient phenoldegrading halophilic bacterial strainsp.H17 [J]. Acta Scientiae Circumstantiae, 2019,39(2):318-324.
[24] Levén L, Nyberg K, Schnürer A. Conversion of phenols during anaerobic digestion of organic solid waste – A review of important microorganisms and impact of temperature [J]. Journal of Environmental Management, 2012,95(1):S99-S103.
[25] Kuang Y, Zhou Y, Chen Z L, et al. Impact of Fe and Ni/Fe nanoparticles on biodegradation of phenol by the strain Bacillus fusiformis (BFN) at various pH values [J]. Bioresource Technology, 2013,136(Complete):588-594.
[26] 张安龙,王 晔,王雪青,等.一株高效苯酚降解真菌的分离鉴定及其菌剂的制备 [J]. 微生物学通报, 2018,45(7):1450-1461. Zhang A L, Wang Y, Wang X Q, et al. Isolation and identification of a high-efficiency phenol-degrading fungi and the preparation of its microbial inoculum [J]. Microbiology China, 2018,45(7):1450-1461.
[27] 张立国,刘建忠,班巧英,等.弱酸性条件下丙酸富集培养物的降解特性[J]. 中国环境科学, 2016,36(12):3724-3728. Zhang L G, Liu J Z, Ban Q Y, et al. Degradation characteristics of a propionate enriched culture at slightly acidic conditions [J]. China Environmental Science, 2016,36(12):3724-3728.
[28] Li H, Meng F, Duan W, et al. Biodegradation of phenol in saline or hypersaline environments by bacteria: A review [J]. Ecotoxicology and Environmental Safety, 2019,184:109658.
[29] 王丽娟,钱子雯,沈海波,等.一株耐盐菌的分离及其降解特性[J]. 化工进展, 2017,36(3):1047-1051. Wang L J, Qian Z W, Shen H B, et al. Separation and biodegradation characteristics of a halotolerant strain [J]. Chemical Industry and Engineering Progress, 2017,36(3):1047-1051.
[30] 黄中子,李 辉,刘勇弟,等.一株中度嗜盐菌sp.PDB-F2对苯酚的降解特性[J]. 环境科学与技术, 2015,38(12):1-5. Huang Z Z, Li H, Liu Y D, et al. Characteristics of phenol biodegradation by a moderately halophilic bacteriumsp. PDB-F2 [J]. Environmental Science & Technology, 2015,38(12):1-5.
[31] 马溪平,艾 娇,徐成斌,等.耐低温苯酚降解菌的降解动力学研究[J]. 环境保护科学, 2009,35(5):18-21. Ma X P, Ai J, Xu C B, et al. Study on kinetics of phenol biodegradation by low temperature- resistance strain [J]. Environmental Protection Science, 2009,35(5):18-21.
[32] Jiang Y, Wen J, Bai J, et al. Biodegradation of phenol at high initial concentration by[J]. Journal of Hazardous Materials, 2007,147(1/2):672-676.
Isolation and degradation characteristics of highly efficient phenol-degrading bacteriasp. L5-1.
LIU Qing-hui, LI Jian*, YANG Hang, WANG Zhi-yu, LI Yan, ZHANG Wei-chuan, JIA Yin-juan, ZHANG Qiu-gen, LUO Xu-biao
(National-Local Joint Engineering Research Center of Heavy Metals Pollutants Control and Resource Utilization, Nanchang Hangkong University, Nanchang 330063, China)., 2021,41(5):2441~2448
A highly efficient phenol-degrading bacterium named L5-1 was isolated and screened from the activated sludge from a sewage treatment plant. The colony morphology observation and 16S rDNA gene sequencing showed that the strain L5-1 was, with the registration number of MN784421 in the US National Center for Biotechnology Information (NCBI). A series of experiments with Phenol as the only carbon source were conducted to study the growth and phenol degradation characteristics of this strain L5-1. The results showed that underthe conditions of 10% inoculum, temperature range of 30 to 35℃, pH range of 7 to 8, the strain L5-1 effectively degraded phenol in the culture medium (with the 100mL of medium volume and the initial phenol concentration of 500mg/L), the degradation rate wasbetter than 93% in 14h.Under optimal degradation conditions (10% inoculum, culture temperature at 35℃, pH 7.0, and NaCl concentration at 1%), The phenol degradation rate reached97.1%within 14 hours when the initial concentration was set at 500mg/L. When the initial phenol concentration was set to 1000mg/L, the strainL5-1 still reached 97.71% degradation rate within 46 hours. The Haldane kinetic model was used to simulate the growth process of strains under different concentrations of phenol. The maximum specific growth rate was 0.355h-1, the semi-saturation constant was 104.27mg/L, the inhibition constant was 322.83mg/L,2=0.997. This study confirmed Strain L5-1 was astrainswith strong phenol degradation ability among the reported strains of the genus, and provided certain theoretical references for the actual treatment of phenol-containing wastewater.
;phenol;biodegradable;kinetics
X172
A
1000-6923(2021)05-2441-08
刘庆辉(1998-),男,江西吉安人,南昌航空大学硕士研究生,主要从事挥发性有机物的生物降解研究.
2020-09-25
国家自然科学基金资助项目(21467018);江西省教育厅项目(GJJ170576);江西省重点研发计划项目(20181ACG70021)
* 责任作者, 副教授, lijian@nchu.edu.cn
