西藏酵母对玉米赤霉烯酮的清除效果及作用机理研究
2021-05-29郭倩倩周海芳郝佳容叶昀恺刘兴泉
郭倩倩,周海芳,郝佳容,叶昀恺,曹 阳,刘兴泉,胡 浩
(1.浙江农林大学 农业与食品科学学院,浙江 杭州 311300;2.国家粮食和物资储备局科学研究院,北京 100037)
玉米赤霉烯酮(Zearalenone,ZEN)是一种非类固醇霉菌毒素,广泛存在于玉米、小麦、大麦等谷物及其加工副产物中[1]。该毒素主要由镰刀菌属(Fusariumsp.)真菌通过聚酮类合成代谢途径产生,具有生殖和发育毒性,细胞和遗传毒性,对肿瘤细胞生长具有促进作用,可导致生殖器官发生癌变[2]。因此迫切需要相关手段对 ZEN进行清除、脱毒,从而保证谷物及其加工产物的安全性,对我国的粮食安全具有十分重要的意义。
清除ZEN主要通过化学、物理、生物三种方法[3]。物理化学清除法能耗高、易造成营养损失,甚至造成二次污染[4]。生物清除法不易造成粮食的营养成分流失,且具有专一性强、转化率高、环境污染小等特点,已成为真菌毒素清除的研究热点。相关研究发现一株枯草芽孢杆菌在48 h内对初始浓度为10 mg/L的ZEN降解率为99.7%[5];一株解淀粉芽孢杆菌NS2对5 mg/L的ZEN标准品的降解率为96.0%[6];11株对ZEN有降解能力的芽孢杆菌,72 h后其降解率在58%~96.9%[7]。上述研究表明,生物法对ZEN具有较好清除效果,但该法易受环境因素影响,稳定性较差。
目前,用于ZEN生物降解的微生物主要为细菌、真菌、霉菌[8]。其中,根霉菌和酵母菌等可将 ZEN降解为低毒的 β-玉米赤霉烯醇或其他无毒产物。特别是酵母菌,降解效果好,其本身大多对人畜无致病性危害[9-10],同时对多种胁迫、逆境具有较强耐受力、对营养要求低。西藏地区微生物不仅种类丰富,而且受高海拔、强紫外线、低温、低氧等环境因素影响,具有更好的功能特性和环境胁迫耐受能力。因此利用西藏地区菌种资源进行粮食毒素清除研究更具应用和开发价值,且可克服生物清除效果稳定性差的难题。
1 材料与方法
1.1 试验材料
本试验酵母均由西藏大学提供,其中胶红酵母(Rhodotorulamucilaginosa)为已鉴定保藏菌种(编号CGMCC10223),NYDA培养基4 ℃冰箱保存;甲醇(色谱级)、乙醇(色谱级):Fisher科学世界公司;ZEN毒素标准品:北京百奥莱博公司;牛肉膏、无水葡萄糖、酵母粉、琼脂粉:北京奥博星生物技术有限公司。
1.2 仪器与设备
Agilent 1100液相色谱仪:美国安捷伦公司;岛津 8060NX液质联用色谱仪:日本岛津公司。
1.3 试验方法
1.3.1 HPLC-FLD检测条件
激发波长274 nm,发射波长440 nm;流动相V(甲醇)∶V(水)=80∶20;流速1.5 mL/min;柱温30 ℃;进样量10 µL。
1.3.2 液质联用检测条件
色谱检测条件:液相系统流速:0.7 mL/min;柱温:30 ℃;进样量:20.0 μL;荧光检测器,检测波长:274 nm,发射波长:440 nm;流动相:流动相A为0.1%甲酸水溶液,流动相B为色谱级甲醇。
质谱检测条件:电喷雾离子源(ESI);检测方式为多反应监测模式(MRM);离子源温度:350 ℃;干燥气流速度:9.0 L/min;雾化气压力:30 psi;毛细管电压:3.5 kV;碎裂电压:0.1 kV;碰撞电压:40 eV;检测驻留时间:100 s。
1.3.3 酵母培养
1.3.3.1 培养基 NYDA培养基:牛肉膏8 g,无水葡萄糖10 g,酵母粉5 g,琼脂粉20 g,蒸馏水1 000 mL;NYDB培养基:牛肉膏8 g,无水葡萄糖10 g,酵母粉5 g,蒸馏水1 000 mL。培养基配置好后,高压蒸汽灭菌(121 ℃,15 min)。
1.3.3.2 酵母菌活化 用无菌接种环挑取一环保存在4 ℃冰箱中的酵母接种于NYDA培养基中,在28 ℃下恒温培养48 h。
1.3.3.3 液体培养 挑取一环经活化后的酵母接种于装有50 mL NYDB培养基的锥形瓶中,然后将上述培养液在 150 r/min,28 ℃下进行摇床培养24 h。
1.3.3.4 调整浓度 将液体培养24 h后的酵母菌液,在4 ℃、5 000×g转速下,离心10 min,除去上层清液,无菌水洗涤两次后,再用无菌水重新悬浮。悬浮后的酵母细胞用无菌水进行梯度稀释并用血球计数板计数,选择试验所需浓度加入培养基。
1.3.4 清除ZEN的酵母菌株的筛选
在装有50 mL NYDB培养基的锥形瓶中,加入1 mL浓度为1×108cells/mL的酵母菌悬液,再加入适量 ZEN储备液,控制 ZEN初始浓度为5 µg/mL,在摇床转速150 r/min,28 ℃条件下培养24 h,分别在0 h和24 h取样。对照组加入1 mL无菌水,设置三组平行。取样品500 µL于1.5 mL离心管中,加入500 µL乙醇(HPLC级),涡旋震荡均匀后,静置30 min,用0.22 µm滤膜过滤后置于–20 ℃冰箱中保存待测。
1.3.5 酵母对ZEN的清除效果研究
1.3.5.1 酵母对不同浓度ZEN的清除效果 酵母培养方法同 1.3.3,ZEN 终浓度分别为 5、10、15 µg/mL,在摇床转速150 r/min,28 ℃条件下培养24 h,分别在0 h和24 h取样。对照组加入1 mL无菌水,设置三组平行。取样品500 µL于1.5 mL离心管中,加入500 µL乙醇(HPLC级),涡旋震荡均匀后,静置30 min,用0.22 µm滤膜过滤后置于–20 ℃冰箱中保存待测。
1.3.5.2 不同菌种浓度对 ZEN清除效果的影响在装有50 mL NYDB培养基的锥形瓶中,加入1 mL浓度分别为 1×106、1×107、1×108、1×109cells/mL的酵母菌液的酵母菌悬液,再加入适量ZEN储备液,控制ZEN初始浓度为5 µg/mL,在摇床转速150 r/min,28 ℃条件下培养24 h,分别在0 h和24 h取样。对照组加入1 mL无菌水,设置三组平行。取样品500 µL于1.5 mL离心管中,加入500 µL乙醇(HPLC级),涡旋震荡均匀后,静置30 min,用0.22 µm滤膜过滤后置于–20 ℃冰箱中保存待测。
1.3.6 酵母清除ZEN的主要途径研究
将活化培养得到的酵母细胞浊液分成三组进行不同处理。活酵母细胞:用无菌水重新悬浮,并用血球计数板计数将浓度调整为1×108cells/mL;热杀死酵母细胞:将酵母菌悬液置于100 ℃水浴中加热30 min杀死酵母,用血球计数板计数将浓度调整为1×108cells/mL;酵母上清液:将活化、培养后的酵母液,在4 ℃,5 000 r/min下离心10 min,取上清液用经灭菌的0.22 µm滤膜过滤,得到无细胞滤液。加入适量ZEN储备液,控制ZEN初始浓度分别为5 µg/mL,然后分别在50 mL NYDB培养基的锥形瓶中分别加入浓度为 1×108cells/mL的活酵母细胞和热杀死酵母细胞悬浮液1 mL,在摇床转速150 r/min,温度28 ℃下培养48 h,分别在 0、6、12、18、24、30、36、48 h取样。对照组加入1 mL无菌水,设置三组平行。将样品在4 ℃,5 000 r/min下离心10 min后,经0.22 µm滤膜过滤,取上清液500 µL于1.5 mL离心管中,加入500 µL乙醇(HPLC级),涡旋震荡均匀后,静置30 min使其充分浸提,置于–20 ℃冰箱中保存待测。
1.3.7 酵母ZEN降解作用的测定
酵母培养方法同1.2.3。对照组加入1 mL无菌水,处理组加入终浓度为5 μg/mL的ZEN,每个处理设置三组平行。每组样品取500 µL于1.5 mL离心管中,加入500 µL乙醇(HPLC级),涡旋震荡均匀后,静置30 min,用0.22 µm滤膜过滤后利用LC-MS进行产物测定。
1.3.8 胁迫耐受能力测定
1.3.8.1 氧化胁迫 制备浓度为 1×108cells/mL的酵母悬浮液,分别加入过氧化氢,制备过氧化氢终浓度为10、20和50 mmol/L的10 mL酵母悬浮液。将配制好的悬浮液在28 ℃,200 r/min下放置 40 min后,稀释后,各取 100 μL涂布于NYDA平板,同体积未经过氧化氢处理的酵母悬浮液为对照,实验室酿酒酵母做对比。平板28 ℃培养 2天后统计菌落数。3个平行处理,试验重复2次。
1.3.8.2 低温胁迫 低温胁迫采用快速冷冻方法进行。将培养好的西藏胶红酵母用0.05 mol/L PBS缓冲液(pH 7)配制成浓度为1×108cells/mL的细胞悬浮液,取1 mL置于1.5 mL离心管中,在–80 ℃下快速冷冻30 min后取出,常温水浴(25 ℃)孵育20 min,梯度稀释后取100 μL涂布于NYDA平板,28 ℃下培养48 h后统计低温处理前后菌落总数,同样处理的实验室酿酒酵母为对照。3个平行处理,试验重复2次。
1.4 数据分析
试验每组处理设置3次平行,结果以均值±SD表示。采用SPSS 25.0软件进行单因素方差分析,P<0.05表示差异显著。利用GraphPad Prism 8软件作图。
2 结果与分析
2.1 筛选降解ZEN的酵母
以西藏大学提供的西藏地区 10株酵母为研究对象,研究其在实验条件下对 ZEN的清除效果,如表1所示,经24 h培养后,西藏胶红酵母对ZEN具有较好的清除效果,对ZEN的清除率达到90%以上,其余菌种对ZEN的清除效果则较为有限,因此,本试验选取西藏胶红酵母开展进一步研究。
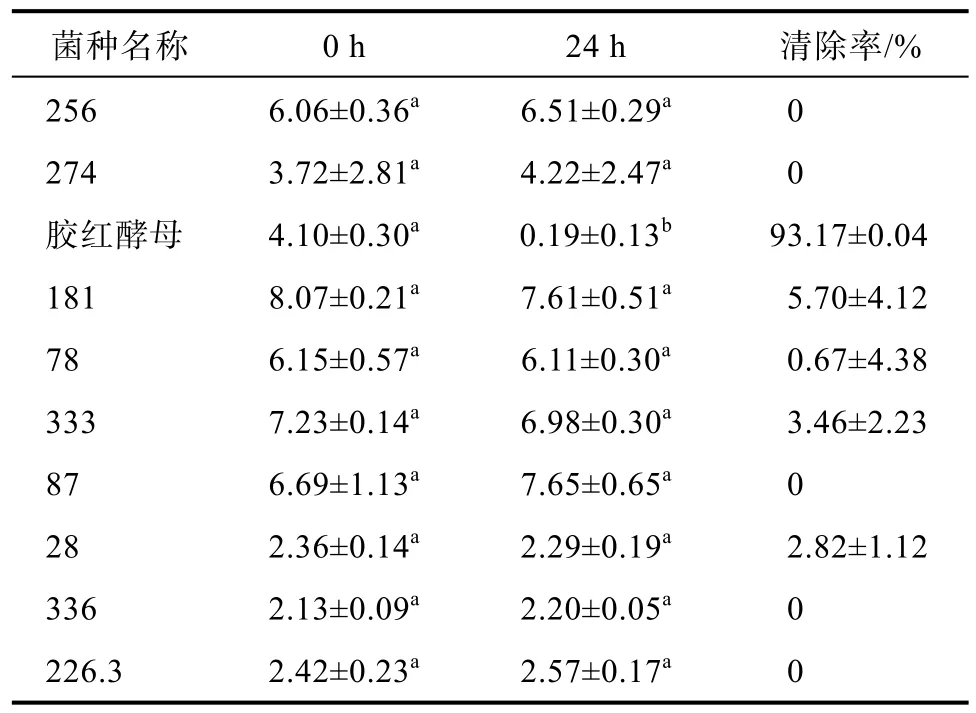
表1 不同酵母对ZEN的清除率Table 1 The elimination rate of ZEN by different yeasts
2.2 胶红酵母对ZEN的清除效果研究
胶红酵母对不同浓度ZEN清除效果的影响结果见表2所示,当ZEN初始浓度为5 μg/mL时,经24 h培养后,西藏胶红酵母将 ZEN清除至0.19 μg/mL。当ZEN初始浓度为10 μg/mL和15 μg/mL时,该酵母将ZEN清除至1.14 μg/mL和1.49 μg/mL。由此可见,随着ZEN初始浓度的增加,胶红酵母对ZEN的清除效果会有所降低,但其清除率仍可达80%以上。上述结果表明该酵母对ZEN的清除作用相对较为稳定。不同浓度胶红酵母悬浮液对ZEN的清除效果研究表明该酵母在低浓度时即可有效清除ZEN(见表3),随着浓度的增加,其清除效果具有一定的提升。
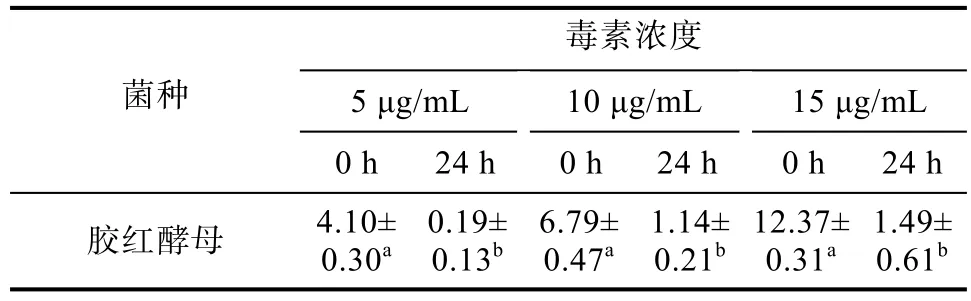
表2 胶红酵母对不同浓度ZEN清除效果的影响Table 2 Effect of R.mucilaginosa on the removal effect of ZEN at different concentrations
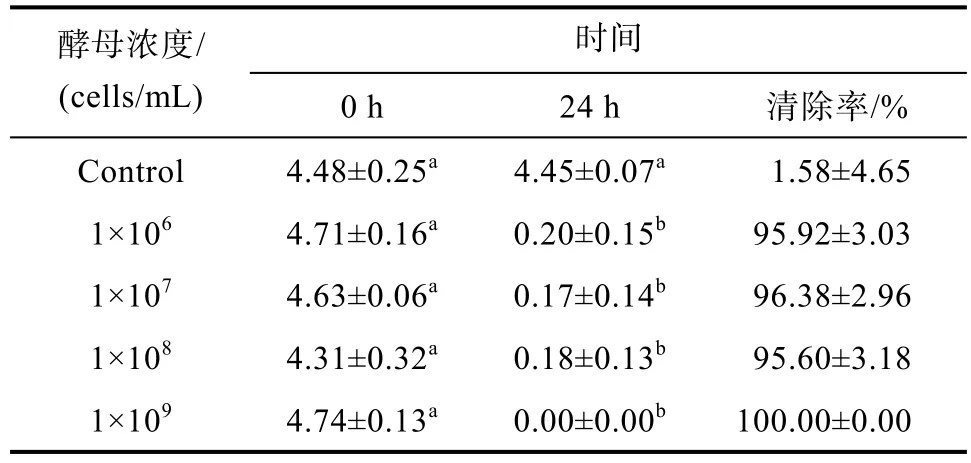
表3 不同浓度胶红酵母对ZEN的清除效果Table 3 The removal effect of different concentrations of R.mucilaginosa on ZEN
2.3 胶红酵母清除ZEN的作用途径研究
试验通过评价不同胶红酵母处理液对ZEN的清除效果来确定其主要作用途径。如图1所示,与对照组相比,经过灭活处理的酵母热杀死液可以显著降低培养基中ZEN含量。其中,前6 h对ZEN的清除效果与活酵母组基本相同,可使ZEN含量迅速降低,而活酵母组中ZEN含量随着时间的延长继续降低,24 h时ZEN含量基本为0。酵母热杀死液18 h后对ZEN的清除效果略逊于活酵母,30 h时无ZEN检出,而酵母上清液对ZEN的清除效果较为有限。
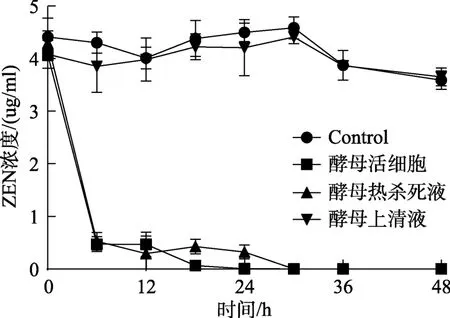
图1 胶红酵母不同处理液对ZEN的清除作用Fig.1 The removal effect of different treatments of R.mucilaginosa on ZEN
试验结果表明,胶红酵母对ZEN清除主要通过吸附作用进行,酵母活细胞由于酵母活性较好,细胞数不断增多,对培养基中ZEN可持续吸附;而酵母热杀死液在细胞灭活时,可能由于部分细胞的葡聚糖结构发生变化,葡聚糖能够通过糖苷键与毒素产生吸附作用[11]。
2.4 胶红酵母对ZEN降解作用研究
为进一步确定胶红酵母是否在胞内对ZEN具有降解作用,试验提取了酵母胞内的ZEN,并利用LC-MS进行了鉴定。通过比较图2~4可知,西藏胶红酵母吸附 ZEN后具有一定的降解作用,ZEN的降解产物相对分子质量为320,可能是玉米赤霉烯醇或玉米赤霉酮。但其具体降解产物的化学结构进一步的确认。
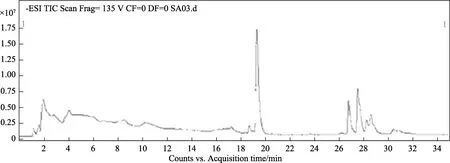
图2 西藏胶红酵母对玉米赤霉烯酮的降解产物LC-MS检测色谱图Fig.2 LC-MS detection chromatogram of the degradation product of zearalenone by Tibet R.mucilaginosa
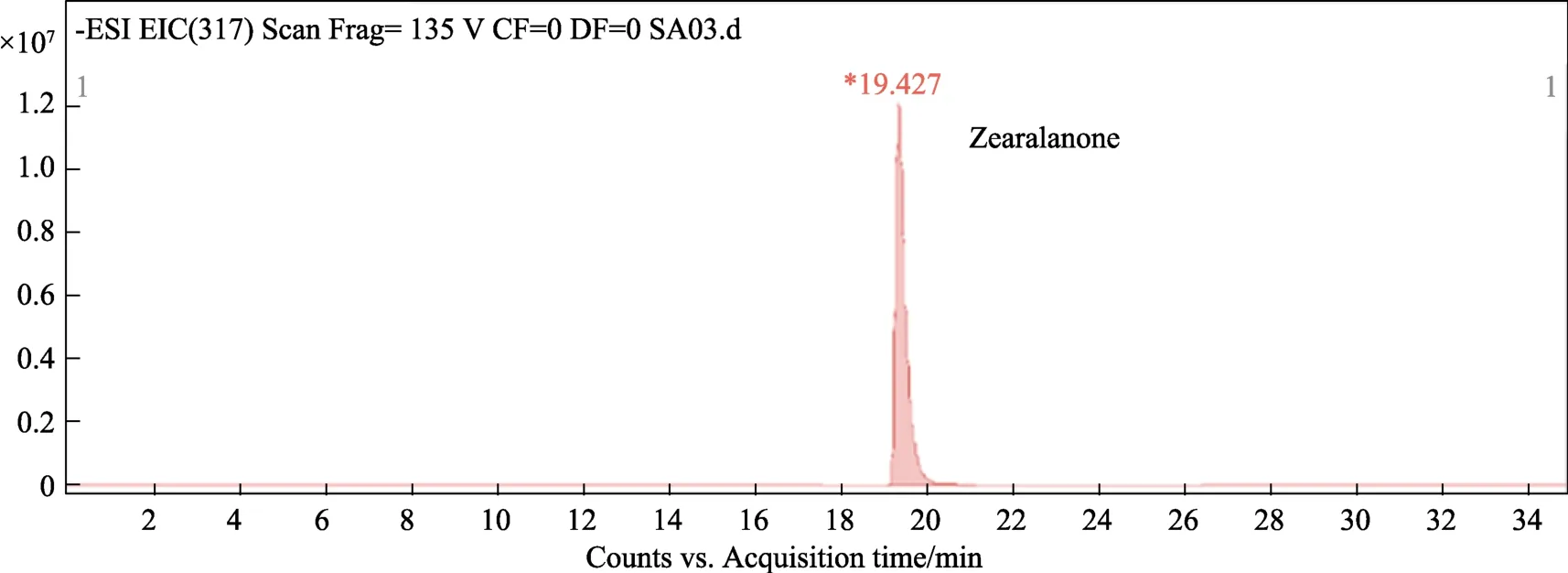
图3 玉米赤霉烯酮LC/MC检测质谱图Fig.3 LC/MC detection mass spectrum of zearalenone
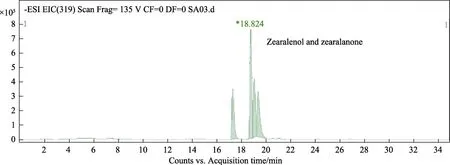
图4 玉米赤霉烯醇、玉米赤霉酮LC-MS检测质谱图Fig.4 LC-MS detection mass spectrum of zearalenol and zearalenone
2.5 胶红酵母胁迫耐受能力研究
西藏胶红酵母对胁迫的耐受特性是其影响生物清除法稳定性的关键。如表4所示,西藏胶红酵母与实验室普通酿酒酵母XZ-9和XZ-10相比,在10和20 mmol/L的低浓度氧化胁迫条件下具有较好的胁迫耐受能力;同时,经–80 ℃下快速低温胁迫后,胶红酵母的活菌菌落数显著高于XZ9和 XZ10(P<0.05)。上述结果表明,西藏胶红酵母具有较好的环境胁迫耐受能力,降低细胞损伤和凋亡的速率,提高酵母胞内物质活性对ZEN的吸附作用,具有较好的清除效果。
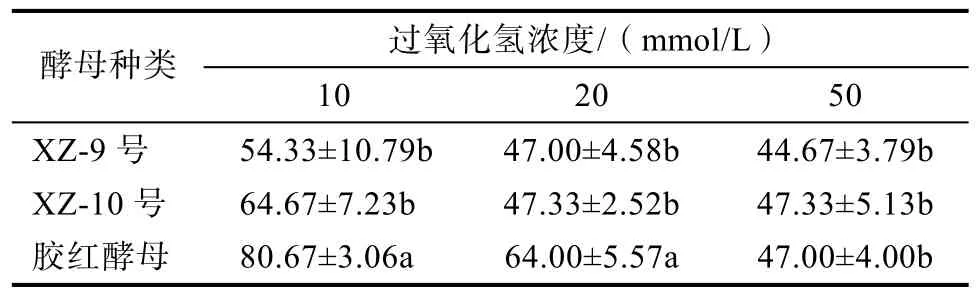
表4 胶红酵母对氧化胁迫的耐受能力Table 4 The tolerance of R.mucilaginosa to oxidative stress
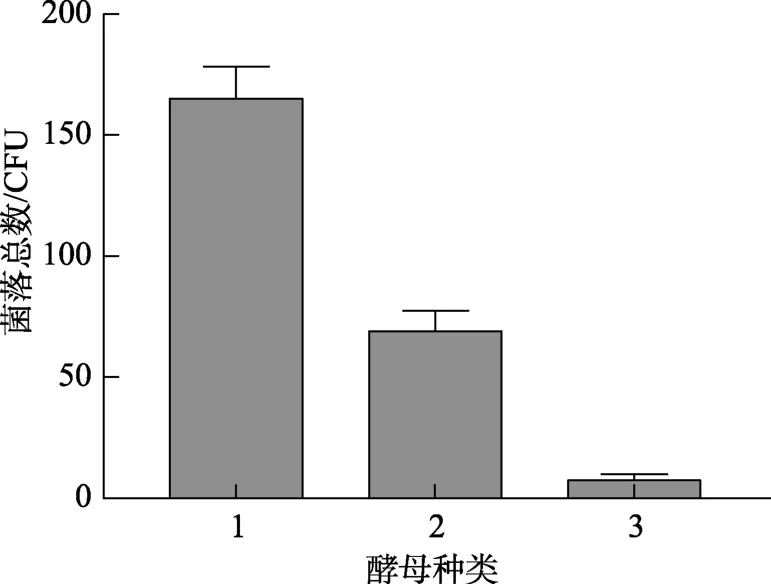
图5 胶红酵母对低温胁迫的耐受能力Fig.5 The tolerance of R.mucilaginosa to low temperature stress
3 结论
通过研究西藏酵母对玉米赤霉烯酮的清除效果,发现西藏胶红酵母对ZEN具有较好的清除能力,具体作用规律如下:(1)西藏胶红酵母对ZEN的清除机制主要为吸附作用,同时该酵母在吸附ZEN后存在一定的胞内降解作用;(2)西藏胶红酵母与实验室普通酵母相比,对氧化胁迫和低温胁迫具有较好的耐受能力,可作为克服真菌毒素生物清除缺陷的潜在菌种。
备注:本文的彩色图表可从本刊官网(http://lyspkj.ijournal.cn/ch/index.axpx)、中国知网、万方、维普、超星等数据库下载获取。
