花后渍水时长对小麦根系形态和抗氧化酶活性及产量的影响
2021-05-25马尚宇刘雅男王笑然姚科郡黄正来张文静樊永惠
马尚宇,刘雅男,王笑然,姚科郡,黄正来,张文静,樊永惠
(1.安徽农业大学农学院/农业部黄淮南部小麦生物学与遗传育种重点实验室,安徽合肥 230036; 2.江苏省现代作物生产协同创新中心,江苏南京 210095)
小麦是世界范围内重要的粮食作物之一,其生产对保障全球粮食安全具有重要的意义[1]。长江中下游麦区是我国小麦主产区,该地区小麦播种面积占全国的20%,产量占全国小麦总产的22%[2]。近年来持续性降雨等极端气候事件频发,长江中下游小麦在生长中后期常受到渍害胁迫,使根系生长发育受阻[3],造成产量减少 20%~50%[4-5]。渍水胁迫会影响小麦正常的有氧呼吸,导致生物量降低50%[6-7]。渍水后小麦根系生物量越到中后期下降幅度越大,在灌浆期渍水10 d和20 d后根系生物量与不渍水处理相比分别下降41.3%和53.6%[8]。小麦种子发芽后淹水1~4 d和4~8 d时,初生根长度减少93.7%~94.5%;分蘖期和拔节期分别渍水15 d时,开花期次生根总根长比对照减少20%~31%[9]。盆栽试验条件下,在小麦群体最大时渍水15 d后,开花期根系平均直径比不渍水处理高50%,但挑旗期渍水15 d处理下开花期根系平均直径与不渍水处理无显著差异[10]。同时,渍水后小麦根系细胞膜脂过氧化程度加剧,大量有害物质产生,丙二醛和超氧阴离子自由基含量升高,超氧化物歧化酶活性显著降低,加速了根系细胞的衰老或死亡[11]。
田间试验条件下,分蘖期渍水15 d后,小麦产量降低47%,其主要原因是小麦穗数和穗粒数分别降低50%和28%[12]。在盆栽试验条件下,小麦拔节期和开花期渍水对穗数影响不显著,但降低了穗粒数、千粒重和产量,且渍水时间越长,三者下降幅度越大[13]。其主要原因是渍水会缩短小麦籽粒灌浆持续时间,抑制营养器官贮藏物质向籽粒的再分配,最终影响粒重,导致其产量下降[14-15]。在小麦分蘖期连续渍水60 d会减少穗数和穗粒数,最终导致产量降低27%[16]。
目前关于渍水胁迫对小麦根系形态和根系衰老相关酶活性的影响已有较多研究,但对于花后渍水对小麦根系形态和抗氧化酶活性的影响研究较少。本研究选用小麦品种齐民7号和淮麦44为材料,人工模拟花后渍水逆境,分析了花后渍水时长对两个小麦品种根系形态和抗氧化酶活性及产量的影响,以期加深认识小麦对渍水胁迫响应的机理,为小麦抗渍水栽培提供参考。
1 材料与方法
1.1 试验设计
试验于2018年11月-2019年5月在安徽省合肥市庐江县郭河镇安徽农业大学郭河试验基地(117°01′E,30°57′N)进行,供试材料为小麦品种齐民7号和淮麦44。试验基地小麦生长季降水量和日平均气温如图1所示。
选用直径11 cm、长度100 cm的PVC管作为栽培容器。将PVC管埋入田间,使其上沿与地表持平,底部通过沟渠相连,保证小麦生长期间水分的排灌。取田间地表土,过筛后装入管中,用水把土沉实,重复多次,最终实现灌水后PVC管中土壤不塌陷,土层距PVC管上沿2~3 cm。播种前土壤pH值为6.30,有机质含量23.41 g·kg-1,全氮含量0.99 g·kg-1,碱解氮含量 121.00 mg·kg-1,有效磷含量33.60 mg·kg-1,速效钾含量356.00 mg·kg-1。播种前每管施有机肥80 g、复合肥1.7 g、尿素1.08 g,将肥料撒施于管中土壤表层,然后与5 cm以上表层土混匀。播种时间为2018年11月1日,收获时间为2019年5月28日,每个品种种植100管。每管播种3粒,小麦三叶期后定苗,每管留苗1株。小麦拔节期每管追施纯氮0.5 g。其他管理措施按照大田高产要求进行。
渍水处理前,PVC管底部沟渠开放,地上部正常灌溉。开花期开始渍水,每个品种设置0 d、3 d、6 d和9 d四个渍水时长,分别用W0、W3、W6和W9表示。渍水处理开始后,封闭PVC管底部沟渠,从地上部灌水,使土壤表层保持1 cm水层,渍水处理结束后打开底部沟渠将水排净,之后保持正常灌溉。W0处理保持PVC管底部沟渠开放,地上部正常灌溉。开花后每7 d进行一次调查取样,取样时将PVC管从土壤中取出,用高压水枪冲洗PVC管中的土壤,然后迅速将根系与地上部分开,洗净后测定各项指标。每处理每次取样6管,其中三管用于扫描根系形态,另外3管用于测定抗氧化酶活性等指标。
1.2 测定项目与方法
1.2.1 根系形态及干重测定
将根系洗净后使用WinRHIZO Pro2016根系形态扫描仪进行根系形态扫描,并分析根系平均直径、总根体积和总根长数据,然后将其置于75 ℃烘箱中烘干至恒重,称量根干重。
1.2.2 根系丙二醛(MDA)含量和抗氧化酶活性测定
将洗净后的根系放入液氮中保存,带回实验室测定MDA含量及抗氧化酶活性。其中,MDA含量用硫代巴比妥酸法测定;超氧化物歧化酶(SOD)活性用NBT光化还原法测定;过氧化物酶(POD)活性用紫外吸收法测定;过氧化氢酶(CAT)活性用紫外线吸收法测定[17]。
1.2.3 产量及其构成因素测定
成熟期各处理调查5管有效穗数和穗粒数,并收获脱粒,籽粒自然晾干后测定千粒重及含水率,折算为含水量13%的产量。
1.3 数据统计与分析
采用Excel 2019进行数据计算和绘图,用SPSS 10.0进行单因素方差分析,用LSD法进行差异显著性检验。
2 结果与分析
2.1 花后渍水时长对小麦根系平均直径的影响
由表1可知,花后0 d和7 d,齐民7号和淮麦44的根系平均直径在不同渍水处理之间无显著差异。花后14 d,齐民7号和淮麦44根系平均直径在W6和W9处理间无显著差异,但二处理均显著低于W0和W3处理;W0和W3处理之间无显著差异。花后21 d,齐民7号和淮麦44的W9处理根系平均直径显著低于其他处理;其次为W6处理;W3和W0处理的根系平均直径最大,二者之间无显著差异。以上结果表明,花后渍水3 d对小麦根系平均直径无显著影响,渍水6 d和9 d会显著降低灌浆中后期根系平均直径。
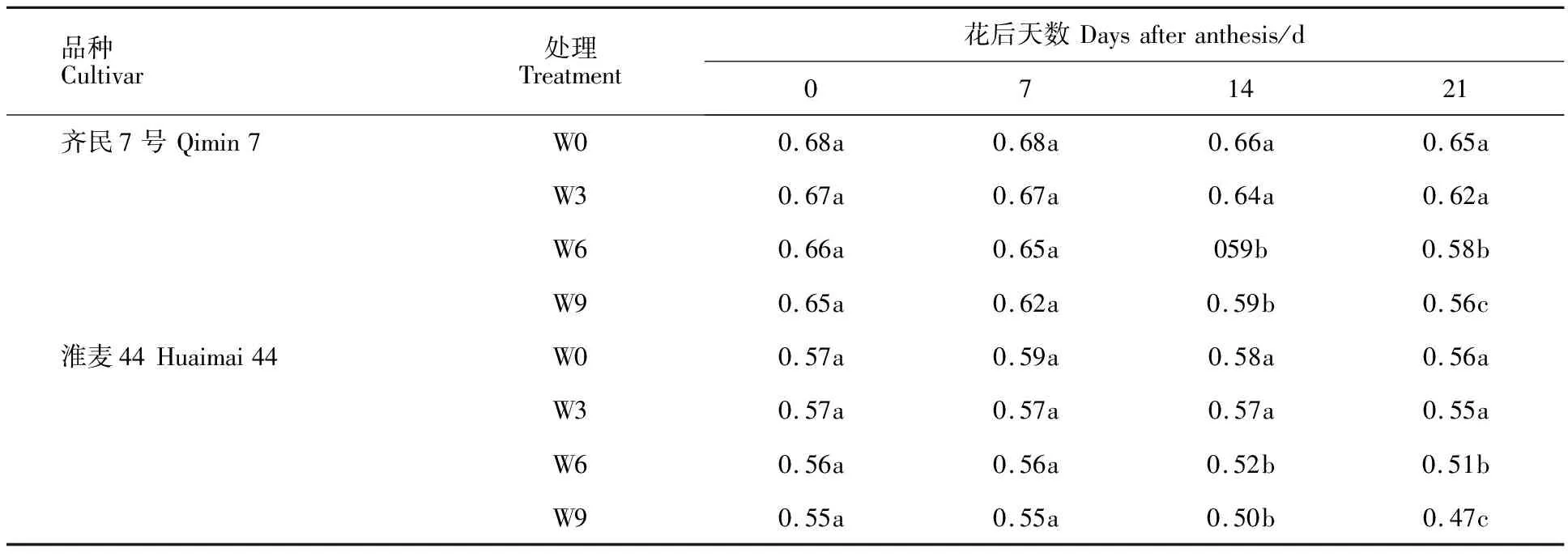
表1 不同渍水时长下小麦根系平均直径
2.2 花后渍水时长对小麦根系总体积的影响
由表2可知,花后0 d和7 d,两个品种的根系总体积在不同处理间无显著差异。花后14 d和21 d,齐民7号和淮麦44的根系总体积在W3与W0处理间均无显著差异,W6和W9处理的根系总体积显著低于W0和W3处理,且W9处理显著低于W6处理,表明渍水3 d对小麦根系总体积无显著影响,随着渍水时长的增加,小麦根系总体积显著减小。
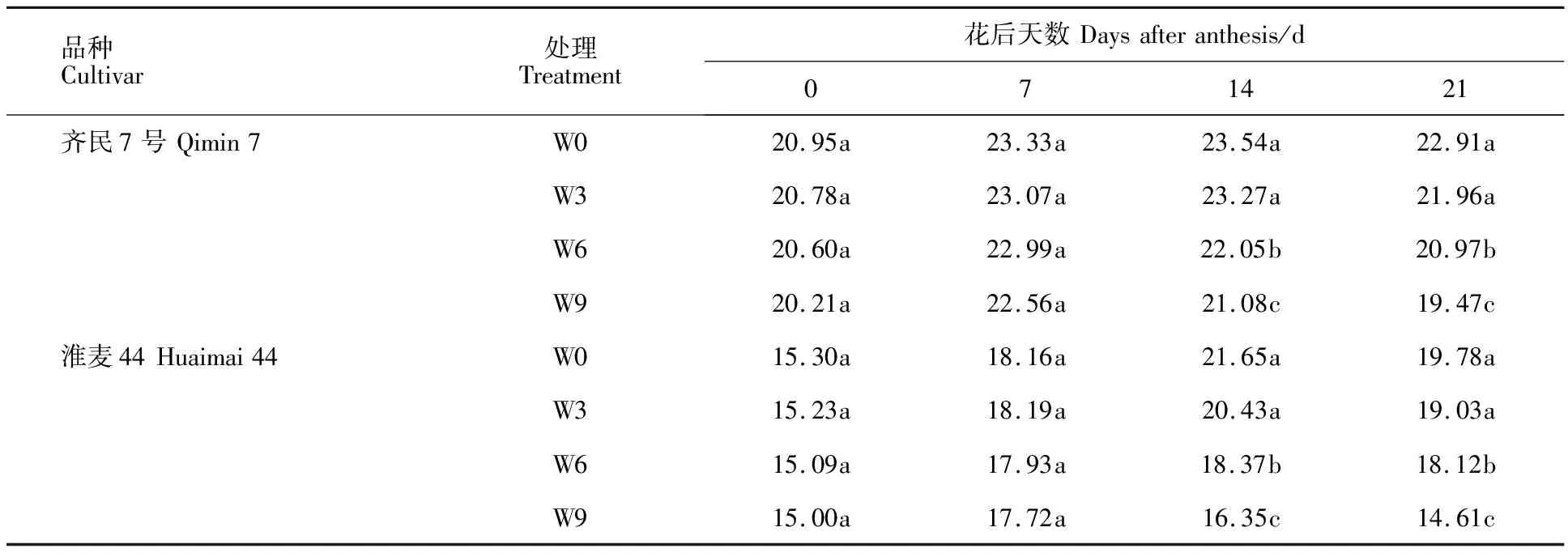
表2 不同渍水时长下小麦系总体积
2.3 花后渍水时长对小麦总根长的影响
由表3可知,花后0 d和7 d,两品种的总根长在不同处理间无显著差异。花后14 d,两品种W9处理的总根长显著低于其他处理,其他处理之间无显著差异。花后21 d,两品种W0与W3处理的总根长显著高于W6和W9处理,W0与W3处理之间无显著差异,W9处理的总根长显著低于W6处理。这表明,花后渍水3 d对小麦总根长无显著影响,渍水9 d会导致小麦灌浆中后期总根长显著下降。

表3 不同渍水时长下小麦总根长
2.4 花后渍水时长对小麦根系干重的影响
由表4可知,花后0 d、7 d和14 d,两品种根系干重在不同渍水处理之间无显著差异。花后21 d,齐民7号和淮麦44 W6和W9处理的根系干重均显著低于W0和W3处理。这说明渍水时长增加会导致小麦灌浆后期根系干重显著下降。

表4 不同渍水时长下小麦根系干重
2.5 花后渍水时长对小麦根系丙二醛(MDA)含量的影响
由图2可知,在花后7 d、14 d和21 d时,两个品种的W6和W9处理根系MDA含量均显著高于W0和W3处理,W0和W3处理之间无显著差异;花后7 d,W6和W9处理间无显著差异;花后14 d和21 d,W9处理的根系MDA含量显著高于W6处理。这表明,花后渍水3 d对小麦根系MDA含量无显著影响,渍水6 d和9 d会导致根系MDA含量显著增加,加剧膜脂过氧化程度。
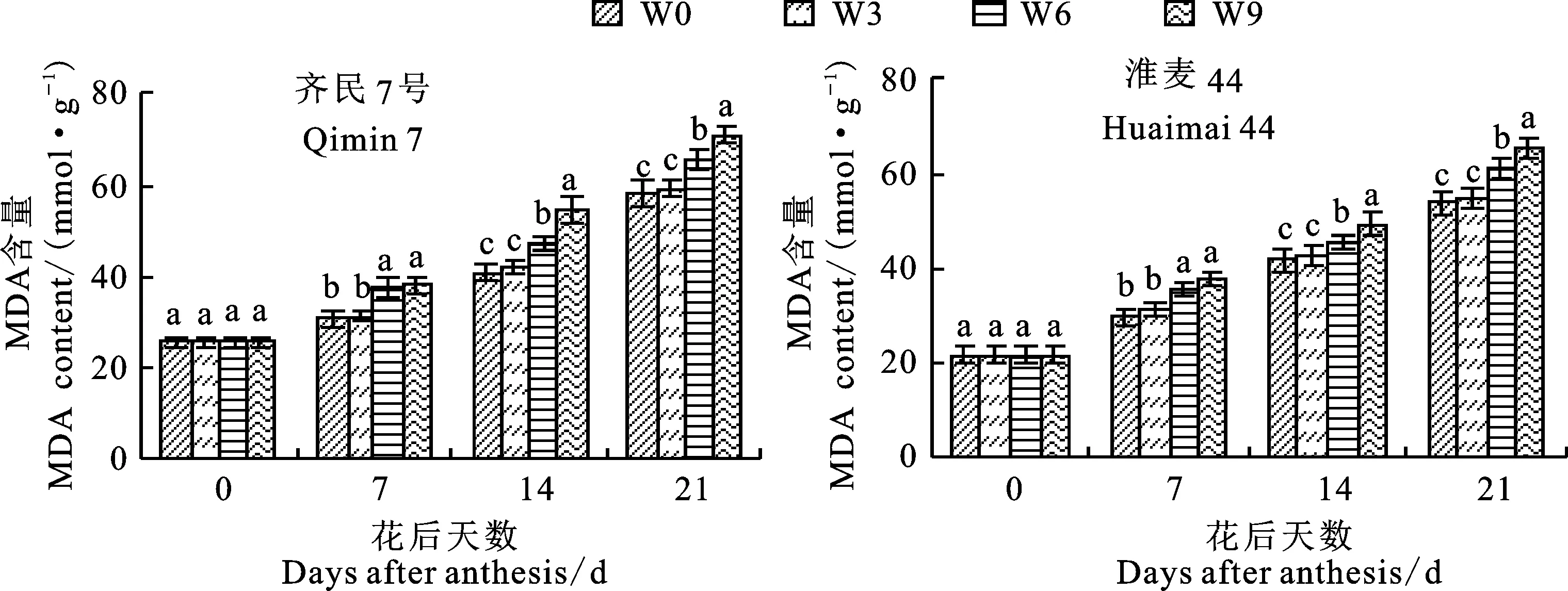
图柱上不同小写字母表示同一时间不同渍水时长间差异显著(P<0.05)。下图同。
2.6 花后渍水时长对小麦根系超氧化物歧化酶(SOD)活性的影响
由图3可知,花后7 d和14 d,齐民7号的W6和W9处理根系SOD活性显著低于W0和W3处理,W6和W9处理之间无显著差异;花后21 d,W9处理根系SOD活性显著低于其他处理。淮麦44花后7 d的根系SOD活性在不同处理间无显著差异;花后14 d和21 d,W6和W9处理的根系SOD活性显著低于W0和W3处理,且W9处理的根系SOD活性显著低于W6处理,W0和W3处理之间无显著差异。以上试验结果表明,随着渍水时长的增加和生育进程的推进,小麦根系的SOD活性显著降低,其中渍水6 d和9 d后小麦灌浆中期根系SOD活性显著下降。

图3 不同渍水时长下小麦根系超氧化物歧化酶(SOD)活性
2.7 花后渍水时长对小麦根系过氧化物酶(POD)活性的影响
由图4可知,花后7 d,齐民7号的根系POD活性在不同处理之间无显著差异;花后14 d和21 d,W6和W9处理的POD活性显著高于W0和W3处理,W9处理显著高于W6处理,但W0和W3处理之间无显著差异。淮麦44花后7 d的根系POD活性在不同处理之间无显著差异;花后14 d,W9和W6处理间无显著差异,但均显著高于W0和W3处理,W3处理显著高于W0处理;花后21 d,W9处理的POD活性显著高于W6处理,W0和W3处理的POD活性最低。因此,随渍水天数的增加,小麦根系POD活性呈上升趋势,渍水6 d和9 d时根系POD活性显著提高。

图4 不同渍水时长下小麦根系过氧化物酶(POD)活性
2.8 花后渍水时长对小麦根系过氧化氢酶(CAT)活性的影响
由图5可知,花后7 d和14 d,齐民7号和淮麦44的根系CAT活性在不同处理之间无显著差异;花后21 d,W3处理的根系CAT活性与W0处理无显著差异,W6和W9处理的CAT活性均显著低于W0和W3处理,且W9处理的CAT活性显著低于W6处理。这表明,渍水3 d对小麦根系CAT活性无显著影响,渍水6 d和渍水9 d均显著降低了小麦灌浆后期根系CAT活性。
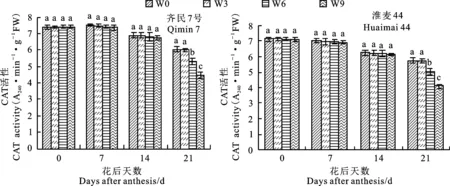
图5 不同渍水时长下小麦根系过氧化氢酶(CAT)活性
2.9 花后渍水时长对小麦产量及其构成因素的影响
由表5可知,渍水对两品种有效穗数无显著影响;穗粒数均表现为W9处理显著低于其他处理,其他处理之间无显著差异;千粒重和产量均为W0>W3>W6>W9。随渍水时长的增加,产量损失率增加,渍水9 d时两品种的产量损失率均达到51%以上。这表明花后渍水主要通过影响籽粒灌浆,导致成熟期千粒重显著降低,进而引起产量下降,并且渍水时间越长,产量损失越大。
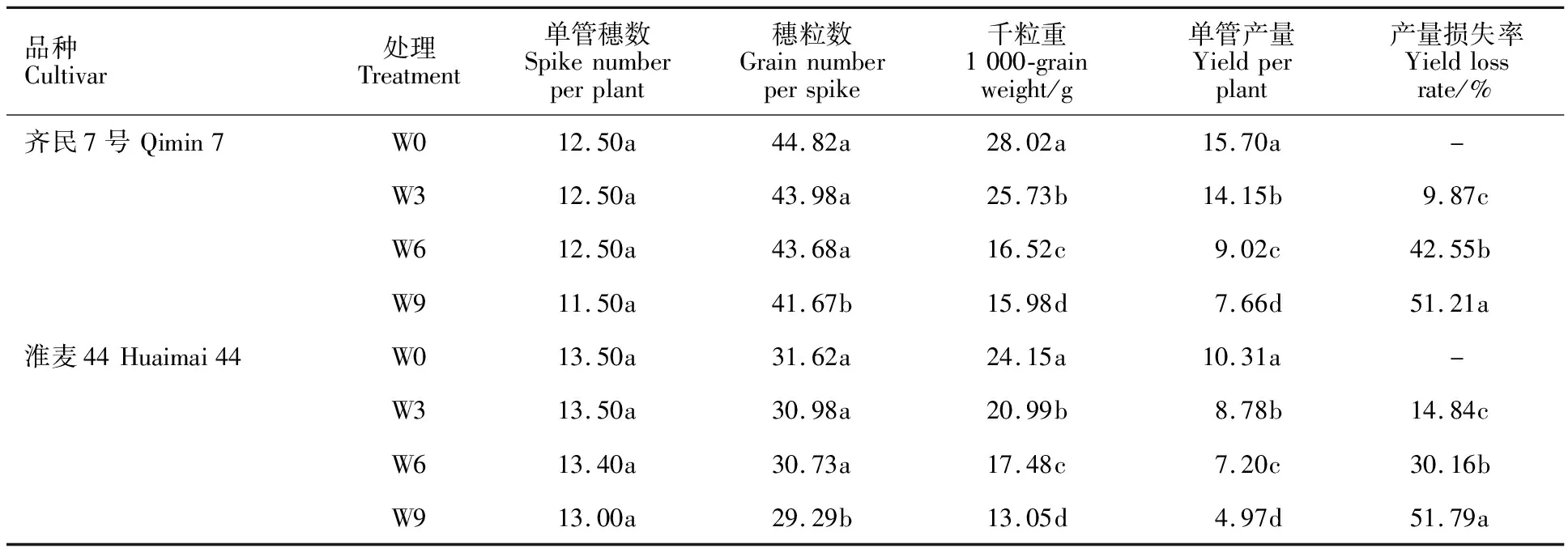
表5 不同渍水时长下小麦产量及其构成因素
3 讨 论
3.1 花后渍水时长对小麦根系形态的影响
研究表明,对出苗后30 d的小麦连续渍水 28 d后,初生根数显著增加,但初生根长度和次生根数显著下降,分蘖数减少56.25%[18];但Malik等对出苗后21 d的小麦连续渍水28 d后,发现初生根数减少50%以上,次生根数减少35%,分蘖数减少高达75%[19]。这可能与两者的试验条件及所用品种不同有关。盆栽试验条件下,小麦播种后18~28 d进行渍水处理后,苗期次生根数较不渍水处理减少了12.50%,根系干重较不渍水处理降低了27.45%[20]。也有研究指出,小麦生育前期遭受渍水胁迫后,不定根增多,总根长大、分蘖能力强的小麦品种产量高[9]。本研究选用齐民7号和淮麦44两个小麦品种,以柱栽方式种植,在开花后设置不同渍水时长,结果表明,花后渍水3 d对根系平均直径、总根体积、总根长和根干重等无显著影响,渍水6 d和9 d后灌浆中后期各指标均显著下降,导致最终千粒重和产量显著降低。
3.2 花后渍水时长对小麦根系抗氧化酶活性的影响
在植物受到渍水胁迫时无氧呼吸产生乳酸、乙醛、MDA等有毒物质,影响细胞的新陈代谢,导致电解质在细胞内的渗透和其吸收功能的丧失[21]。有研究表明,小麦拔节期渍水7 d后旗叶POD活性显著降低[22];孕穗期渍水10 d后,旗叶MDA含量较不渍水处理提高了10.42%,加剧了膜脂过氧化程度,加速了旗叶衰老进程[23]。也有研究结果显示,孕穗期渍水5 d后,小麦根系MDA含量增加22%,SOD活性降低5%[3]。有研究者认为,渍水过程中小麦根系SOD及POD活性的变化是先增强而后下降,但SOD活性在渍水3 d左右开始下降,POD活性在渍水10 d以后才由峰值下降[24]。本试验结果表明,花后短期渍水(渍水3 d)对小麦根系MDA含量、POD活性、SOD和CAT活性无显著影响,渍水时长增加到6 d以上时,根系SOD活性和CAT活性显著下降,而MDA含量和POD活性显著增加,说明本试验条件下,花后短期渍水不会对小麦根系造成伤害,延长渍水时间会导致根系膜脂过氧化水平提高,但小麦能通过提高POD活性缓解根系内过氧化物过多积累对生物膜结构的破坏。
3.3 花后渍水时长对小麦产量及其构成因素的影响
有研究认为,在小麦生长早期渍水会推迟小麦分蘖,但能显著提高分蘖能力,对穗数不会产生显著影响[25]。分蘖期渍水40 d和60 d后小麦产量分别减少19%和30%,其主要原因是渍水影响了小穗形成,最终导致穗粒数显著降低[26]。田间晚播试验条件下,小麦主茎4叶龄前渍水15 d后,产量降低40%;主茎10叶龄至开花期渍水15 d后,产量降低92%,其中穗粒数降低50%,千粒重降低83%;开花后渍水15 d后,产量降低60%,其中穗粒数无明显变化,千粒重降低55%[27]。也有研究发现,花前渍水24 d后小麦产量比不渍水处理低50.00%[28];而花后渍水25 d后产量比不渍水处理低73.90%[29]。本研究在田间柱栽试验条件下于小麦开花后设置不同渍水时长,结果表明,随渍水时长的增加,千粒重和最终产量显著下降,渍水9 d处理的穗粒数也出现明显下降,两品种渍水9 d处理的产量损失率均达到51%以上。
