儿茶素与壳寡糖的协同抑菌作用研究
2021-05-09陈紫婷唐诗淼谈江莹
陈紫婷,唐诗淼,谈江莹,吴 茜
(湖北工业大学生物工程与食品学院,武汉430068)
多酚是存在于植物中以苯酚为骨架,具有多羟基取代的一类天然植物次生代谢产物。目前多酚已被报道的生理功能有抗氧化、抗肿瘤、抗衰老等[1,2]。多糖是指多羟基醛、酮以及它们的缩聚物与衍生物。多糖在抗肿瘤、降血糖、抗衰老等方面都发挥着重要作用。研究表明,黄连多糖可能通过保护胰岛细胞以及促进胰岛素分泌达到降糖的目的[3];黄连多糖可以抑制蛋白质非酶糖化终产物的生成从而阻碍糖尿病并发症产生[4];灵芝多糖可以显著降低血糖及血浆胰岛素的水平[5]。有研究表明提升面包多糖含量能明显促进人体对黄酮的吸收[6];用多糖包埋白藜芦醇其水溶性和稳定性明显提高[7];多糖和儿茶素混合后具有协同抗氧化的效果[8]。
儿茶素是茶多酚的主要成分,具有显著的抗氧化、抗菌、抗病毒作用,能降低脂肪与胆固醇,降低心脑血管疾病的发病率[9]。壳寡糖也叫低聚壳聚糖,是壳聚糖经过特殊生物酶解技术得到的寡糖产品,具有抗菌、抗氧化、抗溃疡作用[10-12]。聚合度为2~20,相对分子质量在3 200 Da以下。相对于壳聚糖而言,壳寡糖具有较高的溶解度,更容易被生物体利用,而作用能达到壳聚糖的10倍以上。
近十年来,人们尝试用各种化学法和酶法将酚类化合物结合到多糖上,而相对于改性之前的多酚与多糖,合成的多酚-多糖复合物展现出更优越的物理化学特性及生物活性。另外,这些复合物在食品、制药和化工领域都有着广泛应用。然而复合物的制备及纯化过程较为复杂,且在此过程中,多酚与多糖也可能会发生一些未知的变化[13]。另外,目前很少研究简单水溶液体系中多酚与多糖的相互作用及其与生物活性的关系。
本研究的目的在于探究儿茶素和壳寡糖复配物对大肠埃希氏菌的抗菌活性,解析儿茶素与壳寡糖的相互作用特征及抑菌机理。
1 材料与方法
1.1 材料与试剂
大肠埃希氏菌(Escherichia coli)BNCC 185254购自北纳创联生物技术有限公司,采用营养肉汁琼脂培养基培养。供试菌经活化后,接入营养肉汁培养基,于37℃、150 r/min振荡培养48 h,备用。
儿茶素,上海克林生化科技有限公司;壳寡糖(相对分子质量小于3 000),山东优索化工科技有限公司,其他试剂均为分析纯。
营养肉汁琼脂培养基:蛋白胨5.0 g,牛肉浸出物3.0 g,NaCl 5.0 g,琼脂15.0 g,去离子水1.0 L。
1.2 仪器与设备
HCB-1300V海尔垂直层流洁净工作台,青岛海尔特种电器有限公司;ZXSR-1270真彩触摸屏生化培养箱,上海智城分析仪器制造有限公司;ZWYRD2403多功能智能组合摇床,南京先玺仪器设备有限公司;MLS-3781L-PC高压蒸汽灭菌器,上海五相仪器仪表有限公司;Tecan M200 PRO多功能酶标仪,北京世贸远东科学仪器有限公司;UV-1601北分瑞利双光束比例监控紫外/可见分光光度计,西安优普仪器设备有限公司;真空冷冻干燥机,德国CHRIST公司;Nexus 470型傅立叶红外光谱仪,美国Perkin Elmer公司;X-射线衍射仪,英国马尔文仪器有限公司;纳米粒度分析仪,英国马尔文仪器有限公司。
1.3 方法
1.3.1 儿茶素与壳寡糖对大肠埃希氏菌的作用抑制率的测定参考了Tang等[14]的方法,并做了一些修改。将大肠埃希氏菌菌悬液按体积分数1%接种于超高温灭菌的营养肉汁培养基,使初始菌落数在105~106cfu/mL。将儿茶素和壳寡糖分别溶解于营养肉汁培养基,并以1∶1、1∶2、1∶4(儿茶素∶壳寡糖,W/W)比例复配。将复配溶液与菌液按照4∶1的体积比加入无菌96孔板,在37℃下培养12 h,测定0 h和12 h的OD600,从而得到抑制率。抑制率计算公式如下。

1.3.2 紫外-可见光谱分析将儿茶素与壳寡糖水溶液以1∶1、1∶2、1∶4(儿茶素∶壳寡糖,W/W)的比例复配。样品于室温下静置20 min后,用紫外-可见分光光度计记录200~800 nm的紫外-可见光谱变化。
1.3.3 红外光谱分析将儿茶素与壳寡糖水溶液以1∶1、1∶2、1∶4(儿茶素∶壳寡糖,W/W)的比例复配。样品室温放置20 min后冻干用于红外光谱分析。2 mg样品和300 mg干KBr混合后研磨,将研磨好的粉末压入片剂。用Nexus 470型傅立叶红外光谱仪从4 000~400 cm-1测定不同样品的红外光谱。所有曲线用软件做平滑处理。
1.3.4 X射线衍射分析在电流为50 mA,工作电压为40 kV,扫描范围2θ为5°~40°,扫描速度为4°/min,步长为0.02°的条件下,用X射线衍射仪检测壳寡糖和复配物冻干粉(儿茶素和壳寡糖以1∶1、1∶2、1∶4的比例复配)的晶体结构。
1.3.5 粒径分析抗菌活性可能和粒径相关[15]。将儿茶素与壳寡糖溶液以1∶1、1∶2、1∶4(儿茶素∶壳寡糖,W/W)的比例复配。室温放置20 min后,用马尔文纳米粒度分析仪来检测复配物的粒径。
2 结果与分析
2.1 儿茶素与壳寡糖对大肠埃希氏菌生长的影响
如图1所示,单独的儿茶素在较低浓度(≤0.6 mg/mL)时,对大肠埃希氏菌BNCC 185254的生长有促进作用,主要是由于儿茶素在低浓度时有促氧化作用,随着儿茶素浓度升高,单独儿茶素作用时,也展现出较好的抑菌效果。单独的壳寡糖作用于大肠埃希氏菌时,抑菌效果较弱,而与儿茶素复配时,随着壳寡糖浓度增高,抑菌效果逐渐增强。当儿茶素与壳寡糖以1∶4的质量比复配时,抑制率达到最大,约为90%。说明低浓度的儿茶素与高浓度壳寡糖发生了较强的作用,抗菌活性方面得到显著提升。需要注意的是,不同比例复配可能会造成不同类型的相互作用,选取合适的比例有助于复配物发挥最佳抗菌能力。复配物中较高浓度的壳寡糖没有促进大肠埃希氏菌的生长,表明壳寡糖的结构可能发生改变,而儿茶素的结构也可能同时发生了变化,从而导致抗菌活性改变。
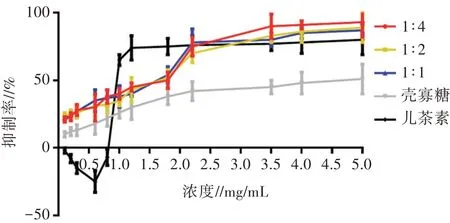
图1 壳寡糖、儿茶素及复配物对大肠埃希氏菌BNCC 185254生长的影响
2.2 紫外-可见光谱分析
从图2可以看出,在紫外-可见光谱280 nm波长处,复配物和儿茶素呈现相似的峰型。将儿茶素与不同比例的壳寡糖复配后,复配物的吸光度逐渐增大,而且峰对应的波长出现轻微红移的现象。表明儿茶素的发色团性质发生了改变,随着复配物中壳寡糖比例的增加,变化更为明显。儿茶素与壳寡糖在相互作用之后,其结构发生改变,但是在此过程中未发生化学变化[16]。
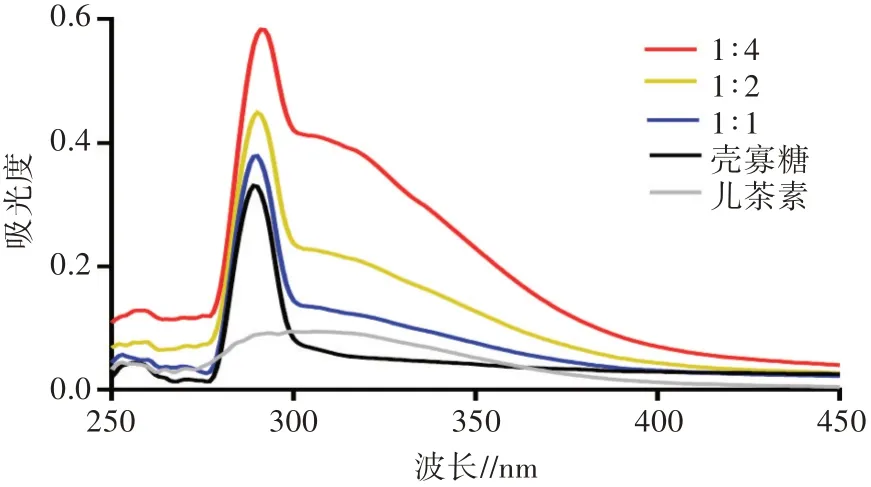
图2 壳寡糖、儿茶素与不同比例复配物的紫外-可见光谱
2.3 红外光谱分析
如图3所示,在红外光谱的2 930、3 420 cm-1波数处能看到壳寡糖的C-H的特征吸收带和O-H伸缩振动。羧甲基化后,1 380、1630 cm-1两条带的峰强度发生了显著变化,这是羧基的对称与不对称伸缩振动所引起的[17]。复配后,O-H伸缩振动峰平移到约3 390 cm-1处,吸收波数随着复配物中壳寡糖比例的增加而逐渐红移。发生这个现象的原因可能是壳寡糖和儿茶素之间形成的氢键增加[18],使得暴露的疏水基团增多。同时C-H伸缩振动强度(2 930 cm-1)随着复配物中壳寡糖比例的增加而逐渐减弱。复配物和壳寡糖的结构与生物活性会因为这些变化受到影响。
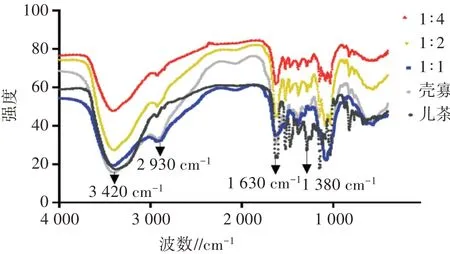
图3 壳寡糖、儿茶素与不同比例复配物的红外光谱
2.4 X射线衍射分析
由图4可以看出,随着复配物中壳寡糖浓度的增大,2θ在12.9°、20.7°时出现的两个特征衍射峰逐渐变为12.4°、23.6°,并且峰强度逐渐增大。表明复配物通过重新整合形成了一种新的聚合物结构,与此同时结晶度发生了改变。
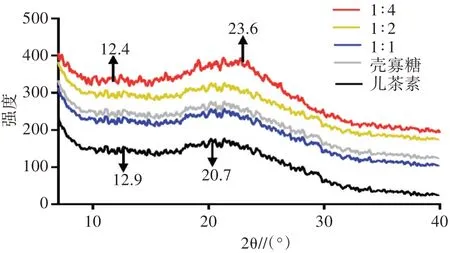
图4 壳寡糖、儿茶素与不同比例复配物的X射线衍射
2.5 粒径分析
由图5可知,随着复配物中壳寡糖浓度增大,其粒径逐渐减小。当儿茶素与壳寡糖的质量比为1∶4时,粒径减小至(179.8±15)nm。复配物粒径减小的原因可能是在复配后壳寡糖的构象发生了改变,而且由于量子尺寸效应,复配物与细胞膜或细胞壁有更高的亲和力,或复配物能进入细胞从而导致抗菌活性变强,这与Sarwar等[19]的结果一致。
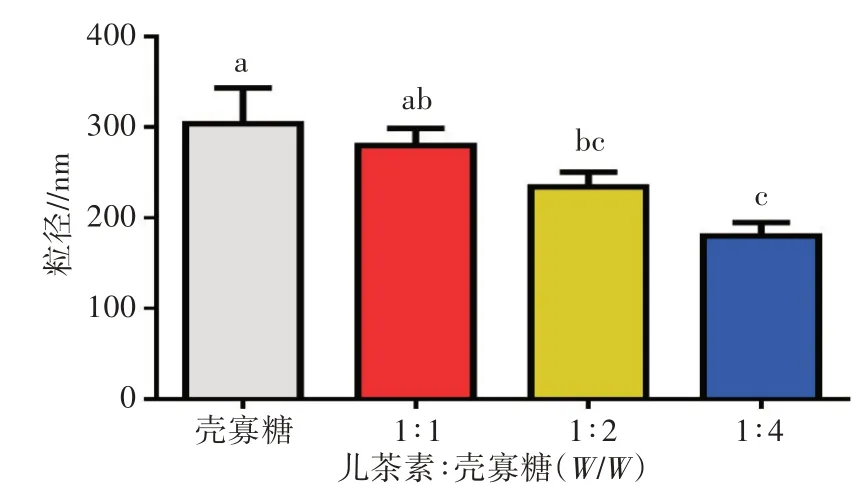
图5 壳寡糖与不同比例复配物的粒径分析
3 结论
试验分析了儿茶素与壳寡糖复配对大肠埃希氏菌BNCC 185254生长的影响,并结合紫外-可见光谱、红外光谱以及X射线衍射分析其相互作用以及可能的抑菌机理。结果表明,随着壳寡糖浓度增加,儿茶素与壳寡糖之间的相互作用增强,并且抑菌能力提高,在儿茶素与壳寡糖质量比为1∶4时,抑菌效果最佳。儿茶素和壳寡糖之间的相互作用导致二者结构发生改变,但并没有化学反应发生。粒径试验表明,儿茶素与壳寡糖复配物具有更小的粒径,有利于增强抗菌活性,研究对多酚与多糖的相互作用在食品领域的应用提供了新的思路。
