钙铝和铁铝水滑石的制备及其吸附水中六价铬的性能
2021-05-07王鹏瑞闫良国
王鹏瑞, 杨 丹, 张 雪, 李 静, 闫良国
(1. 济南大学 水利与环境学院, 山东 济南 250022; 2. 济南市市中区环境监测站, 山东 济南 250001)

1 实验
1.1 试剂、材料
硝酸钙(Ca(NO3)2·4H2O)和硝酸钠(NaNO3)(分析纯, 天津市大茂化学试剂厂); 硝酸铝(Al(NO3)3·9H2O分析纯,天津市红岩化学试剂厂);氢氧化钠(NaOH,分析纯,国药集团化学试剂有限公司);氯化亚铁(FeCl2·4H2O,分析纯,天津市广成化学试剂有限公司)。
1.2 CaAl-LDH和FeAl-LDH的制备
将3.78 g的Ca(NO3)2·4H2O和3.09 g的Al(NO3)3·9H2O加入到50 mL浓度为0.5 mol/L的NaNO3溶液中,超声1 h,然后不断搅拌的同时,用浓度为2 mol/L的NaOH溶液逐滴加入到上述溶液中,直至溶液pH值维持在12左右。将上述混合物转移到反应釜,置于鼓风干燥箱中,100 ℃反应36 h,冷却后取出,用蒸馏水洗涤3次,在80 ℃条件下干燥12 h,过0.150 mm筛,得到CaAl-LDH。
将8.0 g的FeCl2·4H2O和4.8 g的AlCl3·6H2O加入到150 mL的去离子水中,超声1 h,得到均匀的混合溶液,然后在不断搅拌的同时,用浓度为4 mol/L的NaOH溶液缓慢加入到上述溶液中,直到溶液pH值维持在10左右。将上述混合物转移到反应釜,置于鼓风干燥箱中,120 ℃反应24 h,冷却后取出,用蒸馏水洗涤3次,在80 ℃干燥12 h,过孔径0.150 mm筛,得到FeAl-LDH。
1.3 样品表征测试
采用D8 Advance型X-射线衍射仪(XRD, 德国Bruker公司)对CaAl-LDH和FeAl-LDH进行晶体结构分析,扫描范围为5 °~90 °,扫描速度为0.03 °/s;采用Vertex 70型红外光谱仪(FTIR, 德国Bruker公司)对样品的表面官能团进行分析,光谱范围为400~4 000 cm-1,步频为4 cm-1;使用S4800型扫描电镜(SEM, 日本Hitachi公司)观察材料的微观形貌和元素分布;使用ASAP2460比表面积分析仪(美国Micromeritics公司)测定样品的比表面积、孔容和孔径大小。
1.4 吸附作用
首先配制质量浓度为1 000 mg/L的Cr(VI)储备液, 然后将储备液稀释到不同质量浓度用于吸附实验。 在50 mL离心管中, 分别先加入0.03 g的CaAl-LDH或FeAl-LDH吸附剂,再加入20 mL Cr(VI)溶液,置于恒温振荡箱内进行吸附实验(T=298 K;v=200 r/min)。吸附反应结束后采用离心机进行固液分离。上清液中Cr(VI)的质量浓度采用二苯碳酰二肼分光光度法(GB 7467—1987)测定,显色后在波长540 nm测定吸光度。吸附率(R,%)和吸附量(qe,mg/g)采用下述公式进行计算:
(1)
(2)
式中:ρ0为Cr(VI)的初始质量浓度, mg/L;ρe为吸附后Cr(VI)的质量浓度, mg/L;m为吸附剂的质量, g;V为溶液体积,L。

2 结果与讨论
2.1 产物表征
图1、 2分别为CaAl-LDH和FeAl-LDH的SEM表征结果。水热法合成的CaAl-LDH和FeAl-LDH都呈现出不规则的正六边形片状结构,其中CaAl-LDH表面略粗糙,均是LDHs材料的典型结晶形态[21]。通过图1和图2的EDS元素分布图可以看到,O、 Al和Ca元素在CaAl-LDH的表面均匀分布,FeAl-LDH的表面均匀分布了O、 Al和Fe元素。

a)SEM图像

b)元素分布图图1 CaAl-LDH的SEM图像和元素分布图Fig.1 SEM images and element distribution diagram of CaAl-LDH

a)SEM图像

b)元素分布图图2 FeAl-LDH的SEM图像和元素分布图Fig.2 SEM images and element distribution diagram of FeAl-LDH
LDHs的(003)、 (006)、 (012)和(015)晶面衍射峰通常出现在2θ为10.37 °、 20.95 °、 31.77 °和36.75 °处左右的位置[22-23]。 如图3 a)所示,CaAl-LDH的(003)、 (006)、 (012)和(015)晶面衍射峰较强,分别出现在2θ=10.31 °、 20.66 °、 31.14 °和38.50 °处, 说明CaAl-LDH材料具有LDHs的特征衍射峰; FeAl-LDH的(003)和(006)晶面衍射峰出现在2θ的10.25 °和20.76 °处, 说明FeAl-LDH也为典型的LDHs层状结构。

图3 c)是CaAl-LDH、FeAl-LDH的N2吸附-解吸等温线,按照IUPAC的描述,CaAl-LDH和FeAl-LDH吸附-脱附曲线均属于IV型并伴有H3型迟滞回线[27]。 在较高的压力比范围(P/P0=0.8~1.0), 吸附容量快速增加, 说明合成的水滑石材料是介孔结构。 CaAl-LDH和FeAl-LDH的平均孔径分别为31.48、 8.20 nm,孔体积分别为0.050、 0.379 cm3/g,比表面积分别为8.746、 159.5 m2/g。FeAl-LDH的比表面积比CaAl-LDH的大,会提供更多的吸附位点,因此能够改善其吸附性能。

a)XRD谱图b)FTIR谱图c)N2吸附-解吸等温线图3 CaAl-LDH和FeAl-LDH的XRD、FTIR谱图和N2吸附-解吸等温线Fig.3 XRDpatterns,FTIRspectraandN2adsorption-desorptionisothermsofCaAl-LDHandFeAl-LDH
2.2 水滑石吸附Cr(VI)的实验条件优化
溶液的pH值会影响Cr(VI)在水中的存在状态,同时也是影响吸附剂表面酸碱性质的重要因素。图4 a)是初始溶液pH值对CaAl-LDH和FeAl-LDH去除Cr(VI)的影响, 可见溶液pH值的变化对CaAl-LDH和FeAl-LDH吸附Cr(VI)的影响很小, 去除率保持在90%以上。 考虑到实际废水的pH值为6~9, 在后续的实验中未调整溶液的pH值。

a)溶液初始pH值影响b)吸附时间影响c)共存离子影响图4 溶液初始pH值、吸附时间和共存离子对CaAl-LDH和FeAl-LDH吸附Cr(VI)的影响Fig.4 EffectsofinitialsolutionpHvalue,contacttimeandcoexistinganionsonadsorptionofCr(VI)byCaAl-LDHandFeAl-LDH
图4 b)为吸附时间与吸附量的关系曲线。在10 min时,CaAl-LDH和FeAl-LDH的吸附容量分别为26.48、 29.12 mg/g。随着时间地增加,CaAl-LDH和FeAl-LDH对Cr(VI)的吸附量缓慢增加,随后达到平衡状态,因此在后续实验中,选择30 min作为吸附振荡时间。

2.3 动力学研究
吸附动力学是对吸附过程分析的重要分析手段。采用拟一级和拟二级动力学方程对实验数据进行了动力学分析[28-30],所用公式如下:
(3)
(4)
式中:t为水滑石与Cr(VI)的反应时间, min;qe和qt分别为反应平衡时和t时对Cr(VI)的去除量, g/kg;k1为拟一级动力学方程速率常数, 1/min;k2为拟二级动力学方程速率常数,g/(mg·min)。
表1和图5分别为动力学模型的计算参数和拟合图。从表1中相关系数(R2)可知,CaAl-LDH和FeAl-LDH吸附剂对Cr(VI)的吸附去除与拟二级动力学方程(R2>0.999)拟合较好,拟二级方程计算的吸附量和实测值非常接近,也进一步表明该吸附过程符合拟二级动力学,主要是化学吸附控制,这与文献报道的一致[14,21]。
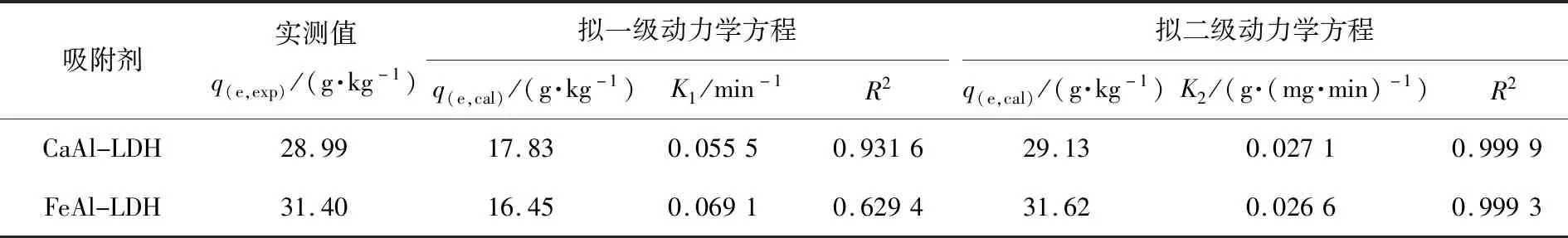
表1 CaAl-LDH和FeAl-LDH吸附Cr(VI)的动力学方程参数
2.4 等温线研究
在优化的实验条件下进行了CaAl-LDH和FeAl-LDH吸附去除水中Cr(VI)的吸附等温线实验,结果见图6,并用常见的Langmuir和Freundlich等温线吸附模型拟合了实验数据[31-33]。所用方程如下:

图5 CaAl-LDH和FeAl-LDH吸附Cr(VI)的拟二级动力学方程拟合Fig.5 PseudosecondorderkineticequationlinearfitforCr(VI)adsorptionbyCaAl-LDHandFeAl-LDH图6 CaAl-LDH和FeAl-LDH吸附Cr(VI)的等温线Fig.6 AdsorptionisothermsofCaAl-LDHandFeAl-LDHforaqueousCr(VI)
qe=qmKLρe/(1+KLρe),
(5)
(6)
式中:qe和qm分别表示2种水滑石的平衡吸附量和最大吸附量, g/kg;ρe为吸附平衡时Cr(VI)溶液的质量浓度, mg/L;KL为Langmuir方程的常数, L/mg;KF为Freundlich方程的常数,(g/kg) (L/mg)n。
表2是等温线数据拟合后得到的相关参数。从R2值可以看出,Langmuir方程较好地拟合了CaAl-LDH和FeAl-LDH吸附去除溶液中Cr(VI)的等温线数据,对Cr(VI)的理论最大吸附量分别为34.92、 51.31 mg/g,说明FeAl-LDH的吸附性能优于CaAl-LDH,与比表面积数据一致。

表2 CaAl-LDH和FeAl-LDH吸附Cr(VI)的等温线模型参数
2.5 吸附剂评价
表3是不同水滑石对Cr(VI)吸附性能的比较。与其他报道的LDHs吸附剂相比,CaAl-LDH和FeAl-LDH的最大吸附容量较高,且水溶液pH值对吸附过程的影响较小,因此,CaAl-LDH和FeAl-LDH可作为高效去除Cr(VI)的优良吸附剂,具有广阔的应用前景。

表3 不同LDH对Cr(VI)吸附性能比较

图7 FeAl-LDH和CaAl-LDH对实际水样中Cr(VI)的吸附量Fig.7 Adsorption capacities of FeAl-LDH and CaAl-LDH for Cr(VI) in real wastewater samples
图7为2种水滑石去除实际水样中Cr(VI)的效果。相比于去除蒸馏水中的Cr(VI), FeAl-LDH对实际水样中Cr(VI)的吸附量有所减小,而CaAl-LDH对实际水样中Cr(VI)的吸附量减少较大,这可能与实际水样中含有较多的离子,存在竞争吸附有关。FeAl-LDH在实际水样中对Cr(VI)的吸附量仍在25 g·kg-1左右,说明有较大的应用价值。
3 结论
1)以常见的Ca、 Fe、 Al盐为原材料,采用水热法制备了2种水滑石纳米材料CaAl-LDH和FeAl-LDH,XRD、 FTIR、 SEM和BET表征结果说明材料呈六边形片状结构,具有典型的水滑石特征衍射峰,FeAl-LDH的比表面积大于CaAl-LDH的。
2)通过静态吸附实验对CaAl-LDH和FeAl-LDH吸附Cr(VI)的实验条件进行了优化,最佳实验条件为:振荡时间30 min,不受溶液初始pH的影响,溶液中共存的阴离子对吸附影响较小。
3)CaAl-LDH和FeAl-LDH对Cr(VI)的吸附过程较快,在30 min达到平衡,动力学数据均符合拟二级动力学模型。
4)CaAl-LDH和FeAl-LDH吸附Cr(VI)的等温线符合Langmuir模型,理论最大吸附量分别为34.92、 51.31 g/kg。
