大豆与丛枝菌根真菌共生建立及菌根检测方法的探究
2021-04-21谢丽萍黄诗宸许张珂李友国林会
谢丽萍,黄诗宸,许张珂,李友国,林会
农业微生物学国家重点实验室/华中农业大学生命科学技术学院,武汉430070
丛枝菌根 (arbuscular mycorrhiza,AM) 真菌属于古老真菌门,可以与80%~90%的高等植物形成互惠共生的关系[1]。它不仅能改善宿主的营养状况,尤其是磷营养,同时也能赋予宿主植物对病原体和非生物胁迫的耐受性[2-3]。随着AM真菌研究的深入,AM真菌与宿主植物共生的分子机制已成为菌根研究的热点。与植物营养生理方面的研究相比,AM真菌与植物共生的分子机制研究对菌根试验材料的要求更高。一般来说,AM真菌侵染程度越高,共生结构形成越丰富,越有利于共生相关基因表达差异的检测,这就需要建立更适合菌根形成的共生培养体系。
AM真菌属于专性营养菌,无法纯培养,只能通过活体植物对其进行繁殖[4]。到目前为止,盆栽培养法仍然是最广泛和最可靠的菌剂扩繁以及菌根实验的方法[5]。盆栽培养法中,培养基质是繁殖菌种和培养宿主的唯一介质,是盆栽培养最关键的影响因素。尽管AM真菌可以在不同的培养基质中与宿主共生[6],但理想的培养基质可以为AM真菌的生长、侵染和共生提供理想的物理和化学条件,进而促进AM真菌的定殖[7]。陈宁等[8]以高粱为宿主,检测4种不同的培养基质对AM真菌(Glomusmosseae93)发育的影响,证明了沙土混合物(V沙∶V土=3∶1)对高粱的生长和AM真菌(G.mosseae)的生长发育最为理想。因此,针对不同的宿主植物,选择合适的盆栽培养基质,能更有利于AM真菌的侵染及共生结构的形成,为AM真菌和植物互作的分子机制研究提供更优良的实验材料。在众多与AM真菌共生的植物中,作为世界上最重要的粮食作物和蛋白质来源之一的大豆,一直受到学者的关注。AM真菌在促进大豆共生固氮以及提高大豆地上部分的氮磷积累方面具有显著的作用[9]。因此,筛选合适的培养基质,促进大豆与AM真菌共生体系的建立,是AM真菌与大豆共生机制研究成功的重要基础。
在AM共生的分子机制研究中,观察和测定AM真菌在侵染宿主植物的不同时期形成的一些特殊结构,如丛枝和泡囊等,能更好地了解AM真菌与植物的共生状态[10]。目前,菌根共生状态观察和测定的一般流程为:KOH菌根透明-菌根染色和脱色-菌根制片观察和统计。在这个过程中,不同植物类型及老幼程度不同根段KOH处理的时间、染色剂的选择及菌根统计方法的选择都会影响菌根的观察和统计结果。如覃晓娟等[11]探讨了5种真菌染色剂对香蕉根系 AM 真菌的染色效果,证明5%醋酸墨水染液更适用于香蕉根系真菌的染色和观察。此外,Füzy等[12]对150多篇涉及宿主根中AM真菌测定方法的论文进行了统计,发现其中37%、22%和17% 的科学著作分别采用了网格线相交法[13]、放大网格交叉法[14]和Trouvelot五级分级法[15],同时,探讨了这3种测定方法的适用范围,认为网格线相交法只适合快速检测真菌的存在与否,不适合对真菌特征结构进行观察和统计,而其他2种方法都能对这些特殊的结构进行估计。在现今的基因研究方法中,全基因组关联分析(GWAS)已成为重要的研究方法之一。因此,如何更便捷有效地观察统计大批量菌根样品成为需要解决的首要问题。本研究从培养基质和检测方法的角度入手,以AM真菌Rhizophagusirregularis作为菌剂,检测不同培养基质条件下的AM真菌的共生表型,以期为大豆与AM真菌共生的盆栽培养找到侵染周期短、侵染率高、有利于大豆生长的培养基质,同时探讨适合大批量菌根测定,且简单快速、容易操作及客观准确的菌根检测技术,为AM真菌与大豆共生互作的分子机制研究奠定基础。
1 材料与方法
1.1 供试材料
供试的3个大豆品种分别是天隆1号(原产地湖北)、冀豆17(原产地为河北)和威廉82(原产地美国),由华中农业大学作物遗传改良国家重点实验室提供。
供试AM真菌(R.irregularis)接种剂由农业微生物学国家重点实验室保存。该接种剂是以紫云英为宿主扩繁10个月后获得,接种剂包含AM真菌的孢子、根外菌丝、AM真菌侵染的根段以及根际土壤混合物。每10 g接种菌剂内约含(60±3)个健康有活力的孢子。
盆栽基质采用蛭石、土、沙等3种原材料通过不同比例混配获得,共4种处理:①蛭石;②蛭石-土(V蛭石∶V土=4∶1);③沙-蛭石(V沙∶V蛭石=1∶1);④沙-土(V沙∶V土=4∶1),其中蛭石和沙购自武汉友纳生物科技有限公司,土取自华中农业大学试验田。
1.2 大豆盆栽方法
试验采用双因素区组试验,以不同原产地的3个大豆品种作为宿主,分别种植于4种不同的基质中,共设计12个处理,每个处理重复5次。采用直径16 cm、高13 cm 的塑料花盆作为培养容器。
种植和接种AM真菌前,提前用巴氏消毒液对培养的温室、苗床进行消毒,所有用到的培养器皿都于121 ℃间歇高压蒸汽灭菌3次,每次1 h。种子灭菌前,挑选饱满、均一、健康的大豆种子,并用氯气灭菌12 h,播种前在超净台放置30 min,除掉残余氯气。将混合基质与AM真菌接种剂按10∶1的比例混合均匀后装到花盆中,播种。播种完成后,将大豆置于光照培养室(24~28 ℃,16 h光照/8 h暗期)生长。试验期间每周定量浇灌1次低磷Hoagland营养液(磷浓度为20 μmol/L),每次浇100 mL,其余时间水分补足,每个穴盘每次浇水量以穴盘水不向外渗漏为准。
1.3 样品收获及分析测定
取灭菌处理后的混配基质样品100 g,烘箱烘干后测定混合基质的理化性质。取混合基质20 g浸于100 mL去离子水中,3 h后取滤液,测定pH值。将烘干基质粉碎,并过孔径0.5 mm筛网,用H2SO4-H2O2消煮后,使用凯氏定氮法测定氮含量;HClO4-H2SO4消煮后,比色法测定全磷含量;原子吸收光谱法测定钾含量。
收获后,先测定植株地上部分和根系总鲜质量。再将根系分为两部分,第一部分样品用于测定真菌菌根共生指标;第二部分根样与地上部分一同置于60 ℃烘箱中烘干48 h,分别测定干质量。
菌根共生指标统计采用放大网格交叉法[14]和Trouvelot[15]五级分级法。
1.4 数据分析
采用SPSS(v25.0)统计软件对大豆植株的生物量以及真菌侵染率、丛枝、根菌丝和泡囊等共生指标进行双因子方差分析(Two-way ANOVA),采用LSD法进行显著性检验,使用Origin 9软件制图。
2 结果与分析
2.1 不同基质对大豆与丛枝菌根真菌共生的影响
1)培养基质的理化性状。蛭石、蛭石-土(V蛭石∶V土=4∶1)、沙-蛭石(V沙∶V蛭石=1∶1)、沙-土(V沙∶V土=4∶1)4种基质的理化性质如表1所示,不同基质在有机质、总磷、速效磷、速效钾含量上均有较大差异。其中,蛭石-土中有机质含量最高,其次是沙-土、蛭石,蛭石-沙中最低。总磷含量由高到低依次是蛭石-土、蛭石-沙、沙-土、蛭石。有效磷含量在蛭石-土中最高,其次是沙-土、蛭石,蛭石-沙中最低。速效钾含量在蛭石-土中最高,其次是蛭石、沙-土,蛭石-沙中最低。4种基质的酸碱度相差不大,pH值为6.46~9.29。结果显示,4种混合基质的营养成分都较贫乏,尤其是有效磷的含量无法满足大豆正常生长的需要,这可能有助于AM真菌的侵染和共生。
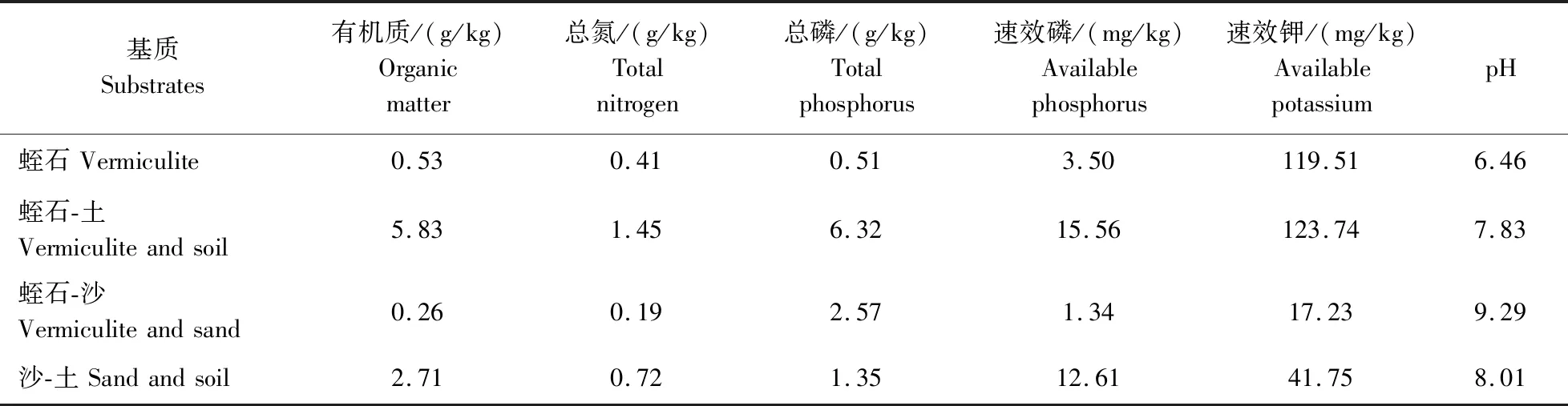
表1 4种基质的理化性状Table 1 Physical and chemical properties of 4 substrates
2)不同基质接种AM真菌后大豆生长状况。将天隆1号、冀豆17和威廉82等3个品种的大豆分别种植在接种AM真菌的4种基质中,观测其生长状况。结果显示,不同基质中大豆的地上部生物量随着接种时间的延长而增加(图1)。在前期(接菌后7、14 d),不同基质中大豆的地上部生物量增加趋势基本一致。从接菌后21 d开始,不同品种大豆在4种基质中地上部生物量开始出现差异。接菌28 d和35 d时,蛭石-土与沙-土中生长的大豆植株,其地上部生物量都显著高于其他2种基质,相对于沙-土而言,蛭石-土更有利于大豆的生长。大豆的地下部生物量的测定结果显示其与地上部分生物量具有相同的变化趋势。接菌28~35 d,蛭石-土中大豆的地下部生物量显著高于其他3种基质。接菌后35 d时,沙-土中大豆的地下部生物量也有所增加,并显著高于其他2种基质,但是仍然低于蛭石-土。这表明不同的基质处理对于大豆的生长均有显著的影响,其中,蛭石-土与沙-土这2种基质更适合大豆的生长,尤其在蛭石-土中,大豆的长势更好。此外,不同的大豆品种在不同基质中的生长趋势一致,表明不同处理之间生物量的差异主要是受到培养基质的影响。
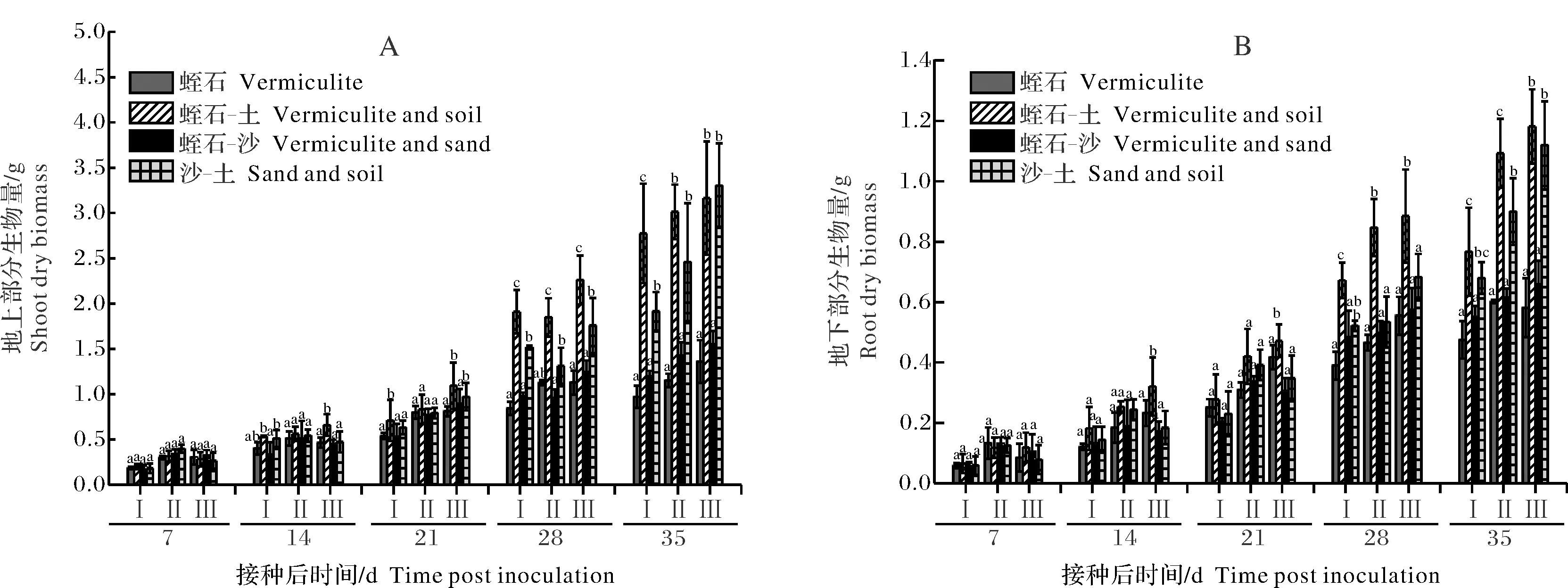
A:地上部分生物量; B:地下部分生物量; Ⅰ:天隆1号;Ⅱ:冀豆17; Ⅲ:威廉82;不同字母表示组间有差异(P<0.05),相同字母表示无差异(P>0.05),误差线代表5个独立样品的标准偏差。A:Shoot dry biomass; B:Root dry biomass. Ⅰ:Tianlong 1; Ⅱ:Jidou 17; Ⅲ:William 82; Different letters indicate that there is a difference between the two groups(P<0.05),and the same letter indicates that there is no significant difference between the two groups(P>0.05). The error bars represent the standard deviations of five independent samples.图1 不同基质中大豆生物量的变化Fig.1 Changes of soybean biomass in different substrates
3)不同基质中AM真菌的共生表型。AM真菌生长状态可以很好地指示共生关系。AM真菌在4种基质中的侵染率随着接种天数的延长而增加(图2)。接菌后7 d,不同基质之间的侵染率没有太大差异。14 d时,蛭石-土中大豆菌根的侵染率就已经显著高于其他3种基质,28 d时达到最大值。其他3种基质中,AM真菌的侵染率增长趋势由高到低依次是沙-土、沙-蛭石,在蛭石中侵染最缓慢。从接菌后21 d开始,蛭石-土中大豆菌根的侵染率缓慢增加到最大值,仅有轻微的波动,至35 d时,4种基质中AM真菌的侵染率都达到最大值(图2A)。表明培养基质能显著影响AM真菌对大豆的侵染,而蛭石-土更有利于AM真菌的侵染。相比其他3种基质,在蛭石-土中AM真菌的侵染周期更短,侵染率在21 d就已接近峰值。
丛枝是AM真菌与宿主植物进行营养交换的重要共生结构,它能够很好地表征宿主与真菌之间营养交换的状态。如图2B所示,随着接种时间的延长,蛭石-土中大豆根系皮层细胞内丛枝丰度先明显增加,并且在接种后 28 d时出现峰值,而后略有降低。表明在接菌28 d后,蛭石-土中菌根细胞内的丛枝已经开始降解。而其他3种基质中菌根细胞内的丛枝丰度与蛭石-土中具有一样的增长趋势,但在整个培养期间均显著低于蛭石-土。
基质也对AM真菌根内菌丝丰度有影响(图2C)。不同基质中菌根的菌丝量随着接种时间的延长而增加,在培养结束时基质中的菌丝量达最大值。从接菌后14 d开始,蛭石-土的菌根中菌丝丰度总是高于其他3种基质,沙-土的菌根中菌丝丰度仅次于蛭石-土,蛭石与沙-蛭石的菌丝丰度最低。
AM真菌的泡囊丰度也受到基质处理的影响(图2D)。不同基质中的泡囊丰度也随着接种时间的延长而增加。在AM真菌与宿主大豆刚开始建立共生时,无泡囊结构,接菌后 14 d时,开始发现有少量泡囊形成。与其他3种基质相比,蛭石-土中大豆根系的泡囊先于其他3种基质出现,而且显著高于其他3种基质,直到培养结束。其次是沙-土,蛭石与沙-蛭石最低。
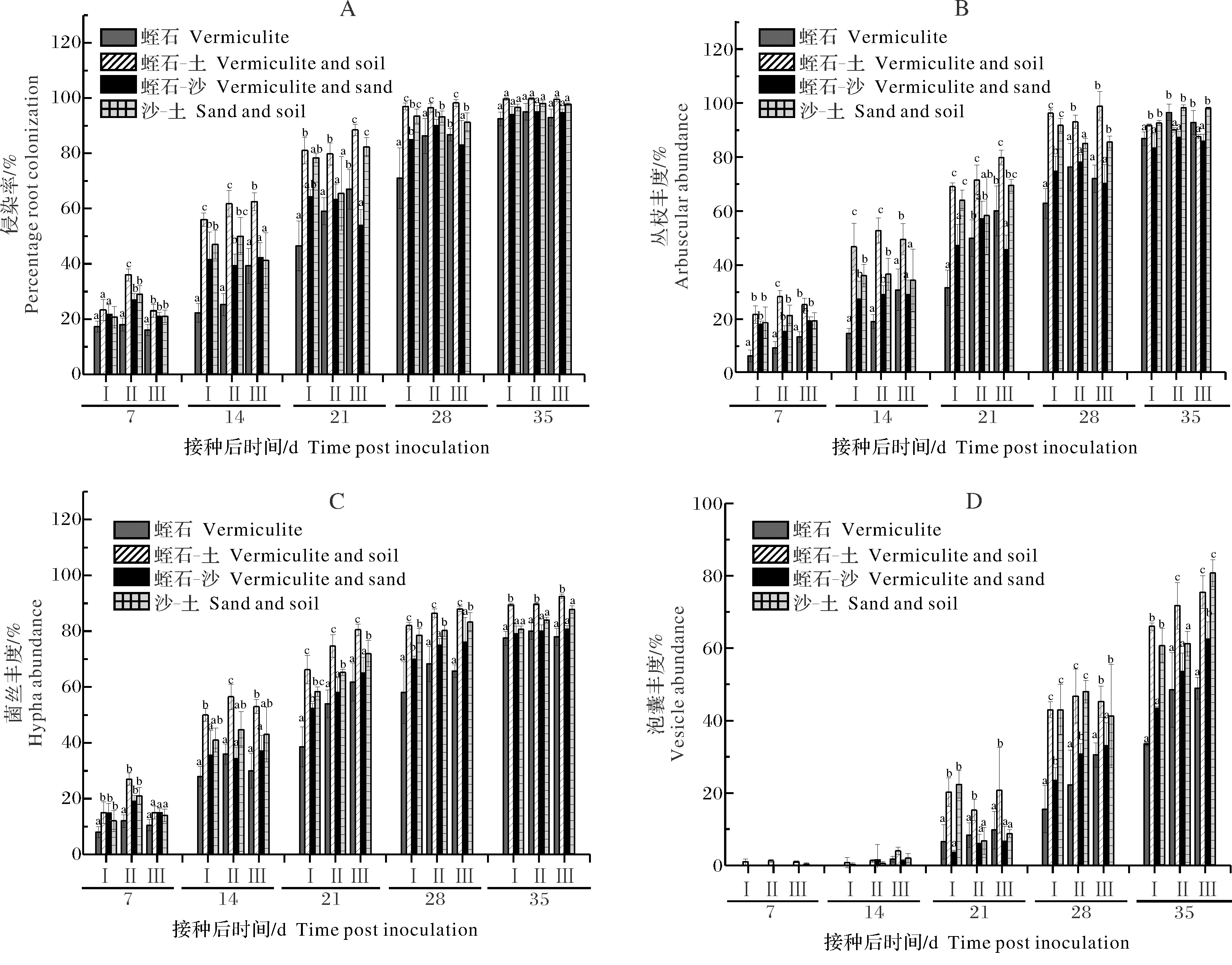
A:侵染率; B:丛枝丰度;C:菌丝丰度;D:泡囊丰度;Ⅰ:天隆1号;Ⅱ:冀豆17; Ⅲ:威廉82; 不同字母表示两组间有差异,相同字母表示无差异,差异在α=0.05的显著水平,误差线代表5个独立样品的标准偏差。A:Percentage root colonization. B:Arbuscule abundance. C:Hyphe abundance. D:Vesicle abundance.Ⅰ:Tianlong 1; Ⅱ:Jidou 17; Ⅲ:William 82; Different letters indicate that there is a difference between the two group,and the same letter indicates that there is no significant difference between the two group,and significant difference at α=0.05.The error bars represent the standard deviations of five independent samples.图2 不同基质对AM真菌共生的影响Fig.2 Effect of different substrates on the growth of AM fungi
综上,蛭石-土的混合基质有利于AM真菌菌丝的生长、延伸,使其更容易侵染大豆根部,形成丛枝和泡囊等共生结构。此外,AM真菌的共生表型在3个不同的大豆品种之间没有显著差异,说明共生表型的差异与大豆品种并无直接相关性。
2.2 大批量大豆菌根检测方法的探究
1)不同时期菌根样品KOH处理时间的探索。菌根样品的透明效果和染色效果是共生指标统计结果准确性的重要因素。菌根的透明效果不理想会导致共生指标的错误判断,尤其在共生后期,许多共生结构都重叠在一起,最终影响测定结果的准确性。因此,本研究分别对接种后7、14、21、28、35 d的大豆菌根进行了KOH处理时间的摸索,根据染色结果确定了样品透明效果最佳的处理时间分别为10、15、30、40、50 min。
2)大豆菌根染色方法的探究。菌根染色效果的好坏也会影响菌根共生指标统计结果的准确性。通过比较台盼蓝和Parker墨水染色方法(图3),发现经台盼蓝染色的真菌结构染色效果可靠稳定,染色样品不易掉色,可以长期保存,但经台盼蓝染色的根样,在脱色时经常会出现真菌结构和皮层细胞的同步脱色,导致根部皮层细胞被染上与真菌相同或者略浅的颜色,共生结构不明显,影响真菌结构的观察与检测(图3 A)。采用Parker墨水染色时,真菌结构着色十分牢固,不会出现同步脱色的现象,而且根中的菌丝、丛枝和泡囊等结构的形态特征明显,易于观察与统计(图3 B)。
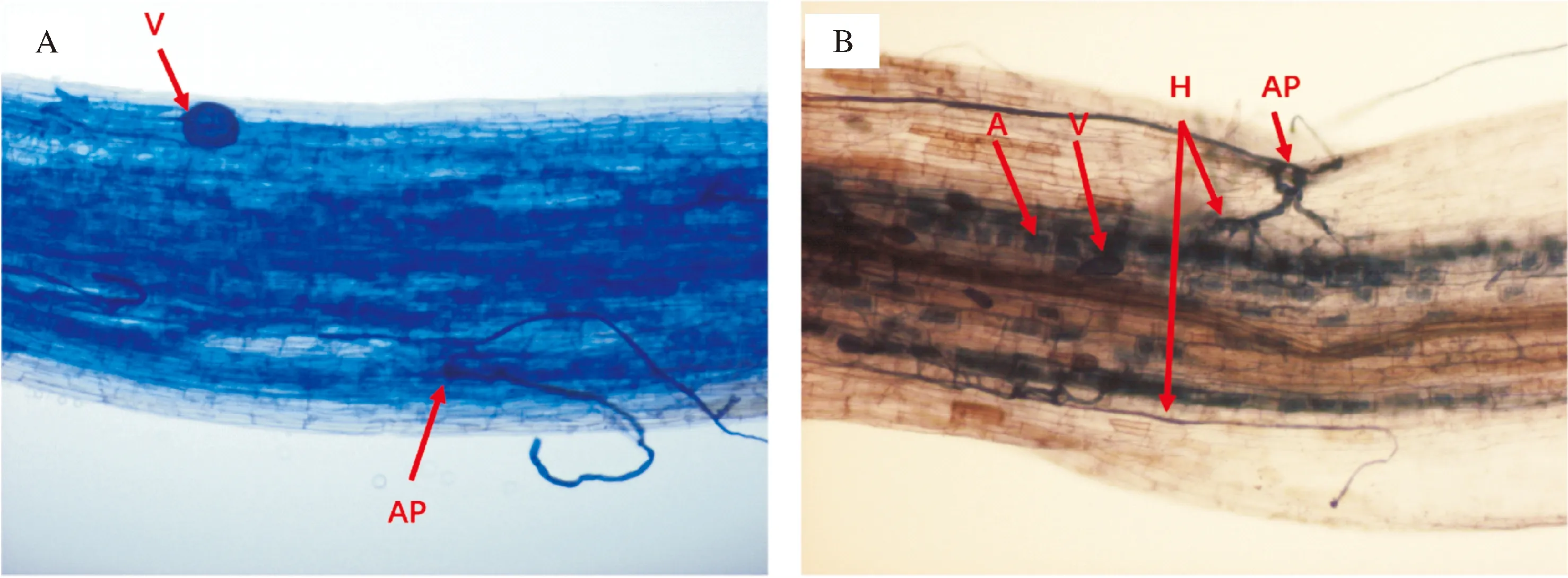
A:台盼兰染色; B:Parker墨水染色;图中红色箭头指向AM真菌在大豆根部的结构,其中A:丛枝;AP:附着胞;H:菌丝;V:泡囊。A:Trypan blue staining; B:Parker ink staining. The red arrow in the picture points to the structure of AM fungi at the root of soybean. A:Arbuscule; AP:Appressorium; H:Hypha; V:Vesicle.图3 菌根染色方法的比较Fig.3 Comparison of mycorrhizal staining methods
3)菌根共生指标检测方法的探究。通过2种不同的检测方法来测定AM真菌在大豆威廉82根中的侵染率、丛枝丰度以及泡囊丰度。如图4所示,放大网格交叉法与Trouvelot五级分级法统计的侵染率结果相似,但是Trouvelot五级分级法的平行样本之间的标准差在不同基质中普遍大于放大网格交叉法 (图4 B)。丛枝丰度的结果显示,Trouvelot五级分级法的统计结果比放大网格交叉法的统计结果小。同时,在不同基质中,丛枝丰度的标准差也普遍高于放大网格交叉法 (图4 D)。泡囊丰度的统计结果也相差不大,但平行样本之间的标准差在4种基质中的变化不同 (图4 F)。总体来看,这2种方法都能准确地测定真菌结构,但是由于放大网格交叉法测定过程所产生的标准差普遍低于Trouvelot五级分级法,说明放大网格交叉法的统计值更接近真实值。
3 讨 论
AM真菌与宿主植物共生的建立与培养基质的理化性质密切相关[8]。本研究结果显示,在蛭石-土中,大豆的生物量以及AM真菌的侵染率、丛枝丰度、菌丝丰度和泡囊丰度都是最高的。一般来说,基质养分含量过高或者过低都不利于宿主植物与AM真菌共生的建立,尤其是有机质的含量[16]。本研究用到的4种混合基质都属于营养贫乏的基质,与其他3种基质相比,蛭石-土中有机质、全氮、全磷的含量都相对较高。该基质中大豆的地上和地下部分生物量的显著增加,说明这种基质的养分条件适合大豆的生长。同时,该基质中AM真菌在不同时期的侵染率均显著高于其他基质,并且能较早地到达侵染高峰,表明该基质更有利于AM真菌的侵染以及丛枝、菌丝和泡囊等共生结构的形成,使得大豆与AM真菌能更早地进行营养交换,最终促进大豆生长。反之,其他3种基质中的养分含量较低,不利于共生体系的建立,尤其是蛭石与沙-蛭石基质。尽管蛭石中的营养成分比蛭石-沙中稍高,但是该基质中的AM真菌的生长发育并不好,可能是基质的其他因素造成的,比如基质的通气状况和水分状况等[17]。总体来看,蛭石-土中AM真菌的侵染速度和生长发育都高于其他3种基质,表明该基质有助于AM真菌菌丝延伸侵染以及丛枝形成。此外,蛭石和土这2种材料都容易获得,质地较轻,便于操作。因此,蛭石-土这种基质可以作为大豆与AM真菌共生分子机制研究的最佳盆栽培养基质。
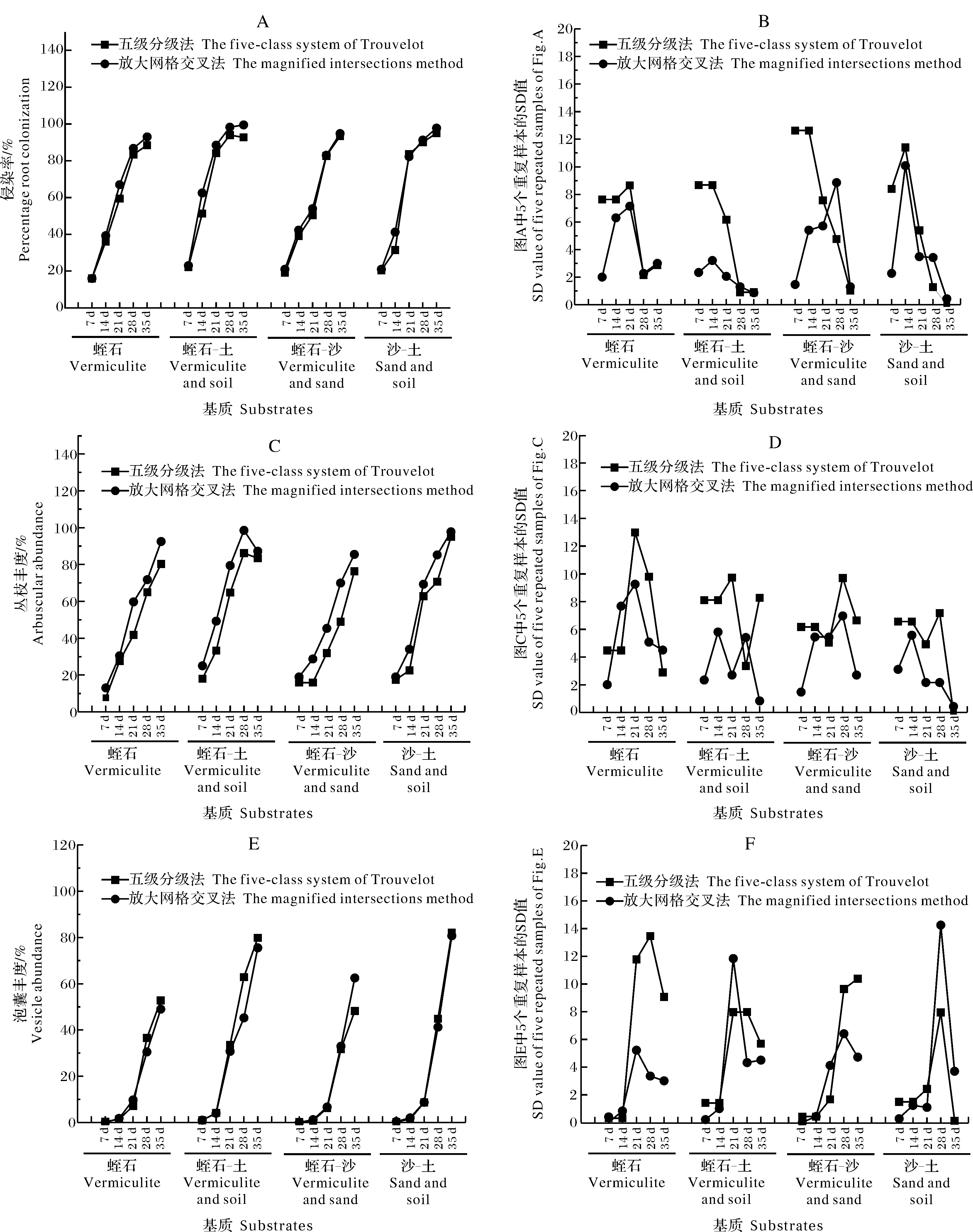
A:侵染率; B:A图中5个重复样本的SD值; C:丛枝丰度;D:C图中5个重复样本的SD值; E:囊泡丰度; F: E图中5个重复样本的SD值。A:Percentage root colonization; B:SD values of five repeated samples about A; C:Arbuscule abundance; D:SD values of five repeated samples about C; E:Vesicle abundance; F:SD values of five repeated samples about E.图4 放大网格交叉法和Trouvelot五级分级法的比较Fig.4 Comparison of the magnified intersections method and the five class of Trouvelot method
在AM共生的分子机制研究中,AM真菌在宿主根中的状态可以很好地指示AM真菌与宿主的共生状态和共生时期[12]。目前,确定共生状态最常用的方法是AM真菌与宿主共生的染色根样品的显微观察和统计[18]。在菌根的显微观察中,菌根染色效果对于共生指标准确性的统计尤为重要。目前菌根染色的染色剂除了墨水之外,其他的几种染料都被国际癌症研究机构列为可能或者可疑的致癌物[19]。本研究选择最常用的台盼兰染色剂和安全无毒的墨水染色剂进行了比较,结果发现,经台盼蓝染色的根系皮层组织经常会被染上相同而略浅的颜色,使得 AM 真菌的结构与皮层组织颜色反差不大,不利于结构的观察,这与Phillips等[20]的结果一致,而且台盼兰具有致癌作用,安全性不高。而经墨水染色的AM真菌结构着色很深,与背景反差大,染色效果极佳,很少会出现根皮层组织被染色的情况。同时它还具有操作简便、毒性小、成本低等特点。该结果与汪茜等[21]的结果相似。因此,对于大批量大豆菌根的测定,墨水染色法绝对是一种比较理想的染色方法。它不仅能提供很好的染色效果,而且也是一种比较经济、安全的染色方法。
在菌根的显微统计中,共生指标的统计方法也是影响统计结果准确性的一个重要因素。目前,常用的3种统计方法中,由于网格线相交法只能检测真菌的存在与否,不能检测真菌的特征结构,本研究只对放大网格交叉法和Trouvelot五级分级法进行了比较。结果表明,放大网格线交叉法和Trouvelot五级分级法对于AM真菌侵染率、丛枝丰度和泡囊丰度的最终统计结果相差不大,说明这2种方法都能对根中真菌结构进行准确的估计。同时我们也发现放大网格交叉法的标准差普遍低于Trouvelot五级分级法,推测原因可能是:(1)放大网格交叉法的评价方法比Trouvelot五级分级法更加客观,对人的主观依赖性小;(2)放大网格交叉法的统计样品比Trouvelot五级分级法多,可能会导致误差降低。此外,与放大网格交叉法相比,Trouvelot五级分级法对丛枝的测定结果偏小,这可能是因为丛枝结构的外观并不像孢子和泡囊那样容易辨别,很难在其他结构之间准确地区分出丛枝,所以在快速扫描整条根样时,Trouvelot五级分级法不能像放大网格交叉法估计固定点那样对所有的丛枝都能进行准确地估计,最终导致Trouvelot分级法对丛枝的统计结果被低估。尽管这2种方法都能对根中真菌结构进行准确地测量,而且花费的时间都相同,但是放大网格交叉法平行样本之间的标准差普遍低于Trouvelot五级分级法,可以认为放大网格交叉法的测定结果更接近真实值。因此,对于大批量大豆菌根检测,放大网格交叉法可以作为一种简单快速、容易操作且客观准确的菌根检测技术。
