固体脂质纳米粒理化性质对纳米粒吸附蛋白的影响
2021-04-19周文忠
孙 玥,周文忠
(中国农业大学动物医学院 北京 100193)
固体脂质纳米粒(Solid lipid nanopartcles,SLN)是从20世纪开始逐步发展起来的一种新型纳米粒子载体[1]。SLN 采用固态的合成的或者天然的类脂作为脂质材料,在乳化过程或乳化后可使蛋白以某种方式与脂质纳米相结合,其粒径范围一般在10~1000 nm。SLN拥有生理相容且耐受性好的特点,并且与传统的药物制剂相比具有较高的生物利用度[2-3]、增加药物在体内吸收和靶向性[4-5]、延缓药物释放度等优点。
制备SLN的脂质材料有许多种,由于饱和脂肪酸甘油酯、脂肪酸、混合脂质等材料如:三酰甘油类如单硬脂酸甘油酯、三棕榈酸甘油酯、二十二酸单、双、三甘油酯混合物、三硬脂酸甘油酯;脂肪酸类如棕榈酸、硬脂酸等;类固醇类如胆固醇等;蜡质类如鲸蜡醇棕榈酸酯、鲸蜡醇十六酸酯等。其中硬脂酸使用更频繁,硬脂酸属于长链饱和脂肪酸,是机体脂肪的重要组成成分和主要能量来源,理化性质稳定,在体内可以降解,是一种理想的脂质材料。此外在制备SLN时也可以混合加入几种不同的脂质材料,从而达到不同的制备目的如改变粒径、电位等。
与其它纳米载药系统相比,SLN具有易于制备、成本低、可大规模生产、拥有良好的物理稳定性、无有机溶剂的情况下SLN无脂质载体系统的毒性等[6-7]。SLN已成为国内外药剂学领域的研究热点,如今已有SLN作为疫苗佐剂的相关研究,如Himanshu Mishraa等利用SLN呈递乙肝病毒表面抗原[8]。
蛋白附着到纳米颗粒可以通过简单的物理吸附或更复杂的方法,例如:化学结合或包封实现。吸附通常是基于电荷或疏水作用[9]。包封,即在合成过程中蛋白与纳米粒子在纳米粒子制备过程中混合,蛋白进入纳米颗粒包封完成[10],只有当纳米颗粒在体内被分解时才被释放。对于化学结合,是将蛋白化学交联到纳米粒子颗粒的表面[11]。表面吸附简单易行、使用方便、成本低,更适合于兽医药的应用。
本文研究的固体脂质纳米拥有毒性低、制备简单、易工业化大规模生产等特点,满足兽医药领域的需求。实验用热熔乳化超声技术制备固体脂质纳米粒,研究纳米粒理化性状对吸附率影响因素,揭示影响固体脂质纳米粒吸附性的主要因素,为固体脂质纳米-蛋白载体的研究和应用奠定基础。
1 材料和方法
1.1 实验材料 单甘脂、十四酸、考马斯亮蓝(G-250)购于国药化学试剂有限,聚乙烯醇(Poly vinyl alcohol, PVA)和BSA购于 Sigma,双十八烷基二甲基氯化铵(Dimethyldioctadecyl ammonium chloride, DDAC)购于上海阿拉丁生化试剂有限公司。
1.2 固体脂质纳米粒制备 将1克脂质材料放入50 mL离心管中,置于沸水浴中加热使脂融化,再将融化的脂质混合物置于55 ℃ 的水浴锅中放置1~2 min。后加入10 mL在55 ℃ 水浴锅中预热的PVA溶液,使用细胞破碎仪(VC X 750 超声波细胞破碎仪)直径13 mm探头,功率35%,超声处理一定时间,分别加入10 mL冷却水后摇匀成纳米悬液。将各组固体脂质纳米悬液样品分别取2 mL,14000 r/min离心40 min,收集沉淀后再将沉淀悬浮至2 mL水中重复离心一次,收集底部沉淀后将其置于冻干机于-49 ℃、1 Pa的条件下将水分抽干制成冻干粉,于置-20 ℃储存备用,每组设置三个样品。
1.3 粒径、电位、多分散系数的检测 利用光子相关谱法(PCS)检测纳米粒子的粒径和分散度。分别取200 μL已制备好的固体脂质纳米悬液于4 mL离心管中,将检测样品稀释12.5倍,在样品池中加入1400 μL在25 ℃ 条件下用纳米激光粒度仪ZS90(Malvern Instruments, UK)检测纳米粒子平均粒径(mean diameter, MD)和多分散性系数(polydispersity index, PDI)。将上述检测样品继续稀释10倍,取800 μL加入到导电样品池中检测表面电位(zeta potential, ZP)。
1.4 Bradford法检测BSA标准曲线的制作 将10 mg/mL的BSA溶液用PBS稀释得到浓度分别为100、80、60、40、20 μg/mL的溶液,取500 μL溶液分别与2 mL考马斯亮蓝混合反应5 min后用分光光度计测定595 nm处吸光值。实验每组三个重复,然后以OD595的三次平均值做横坐标,BSA溶液的浓度做纵坐标,即得标准曲线。
1.5 吸附率检测 称取纳米粒冻干粉12.5 mg,加入500 μg/mL的BSA至体积为250 μL。再加入生理盐水至总体积为1 mL。将其置于离心机14000 r/min离心40 min,将上清液取出500 μL与2 mL配制好的考马斯亮蓝溶液反应,反应5 min后在记录595 nm处OD值,重复此操作直到上清液与考马斯亮蓝反应呈现阴性,将数值带入标准曲线计算未被吸附的蛋白量,通过公式计算得出吸附率。
BSA吸附率={(加入总的蛋白量-未吸附的蛋白量)/ 加入的总蛋白量}×100%
2 结果与分析
2.1 固体脂质纳米理化性状 固体脂质纳米悬液外观呈乳白色,无味;颗粒大小均匀,分散性良好,无沉淀。不同制备方案制备的固体脂质纳米粒平均粒径(mean diameter, MD)、多分散性系数(polydispersity index, PDI)、表面电位(zeta potential, ZP)如表1所示。

表1 不同条件制备的固体脂质纳米粒理化性状(mean±S.D.,n=3)
2.2 BSA标准曲线 Bradford法检测BSA标准曲线BSA在1-100 μg/ml范围内呈现良好的线性关系, R2为0.9921。
2.3 不同脂质材料纳米粒吸附率比较 如图1 所示,SLN1(单甘脂与十四酸)的吸附率显著高于SLN5(氢化蓖麻油)固体脂质纳米粒的吸附率(P=0.023)。
2.4 不同表面电位纳米粒吸附率的比较 由图2可知,正电位SLN3(25.7±1.15 mV)的吸附率明显高于负电位SLN1(-25.1±1.6 mV)(P=0.021)。
2.5 不同粒径纳米粒吸附率的比较 如图3所示,不同粒径的固体脂质纳米颗粒的吸附性比较结果为:SLN1(300±3 nm)分别与SLN2(100±5 nm)、SLN6(669±4 nm)相比差异性不显著,但SLN2(100±5 nm)与SLN6(669±4 nm)相比较差异显著(P=0.01)。
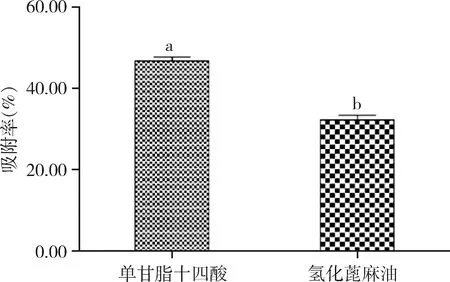
图1 不同材料固体脂质纳米粒吸附率的比较
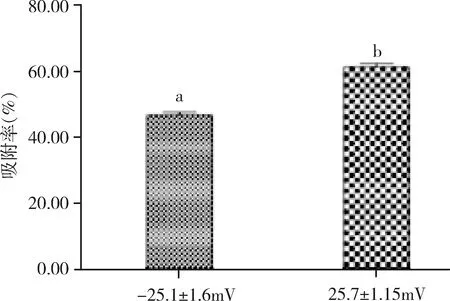
图2 不同电位固体脂质纳米粒吸附率的比较
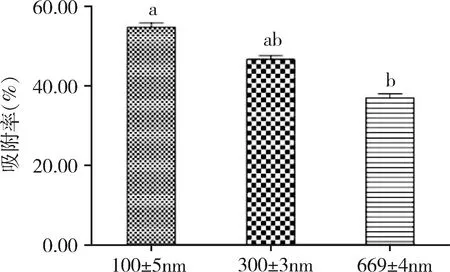
图3 不同粒径固体脂质纳米粒吸附率的比较
2.6 不同脂质含量固体脂质纳米粒吸附率的比较如图4所示,不同密度的纳米悬液中脂质含量不同吸附率也不同,浓缩组和正常组的吸附率无显著差异,但稀释组的吸附率与浓缩组和正常组有显著差异,P值分别为0.028、0.027。

图4 不同脂质含量固体脂质纳米粒吸附率的比较
2.7 不同PVA浓度固体脂质纳米粒吸附率的比较 如图5所示,不同PVA浓度乳化的固体脂质纳米粒吸附率比较结果为SLN2、SLN4无显著差异。
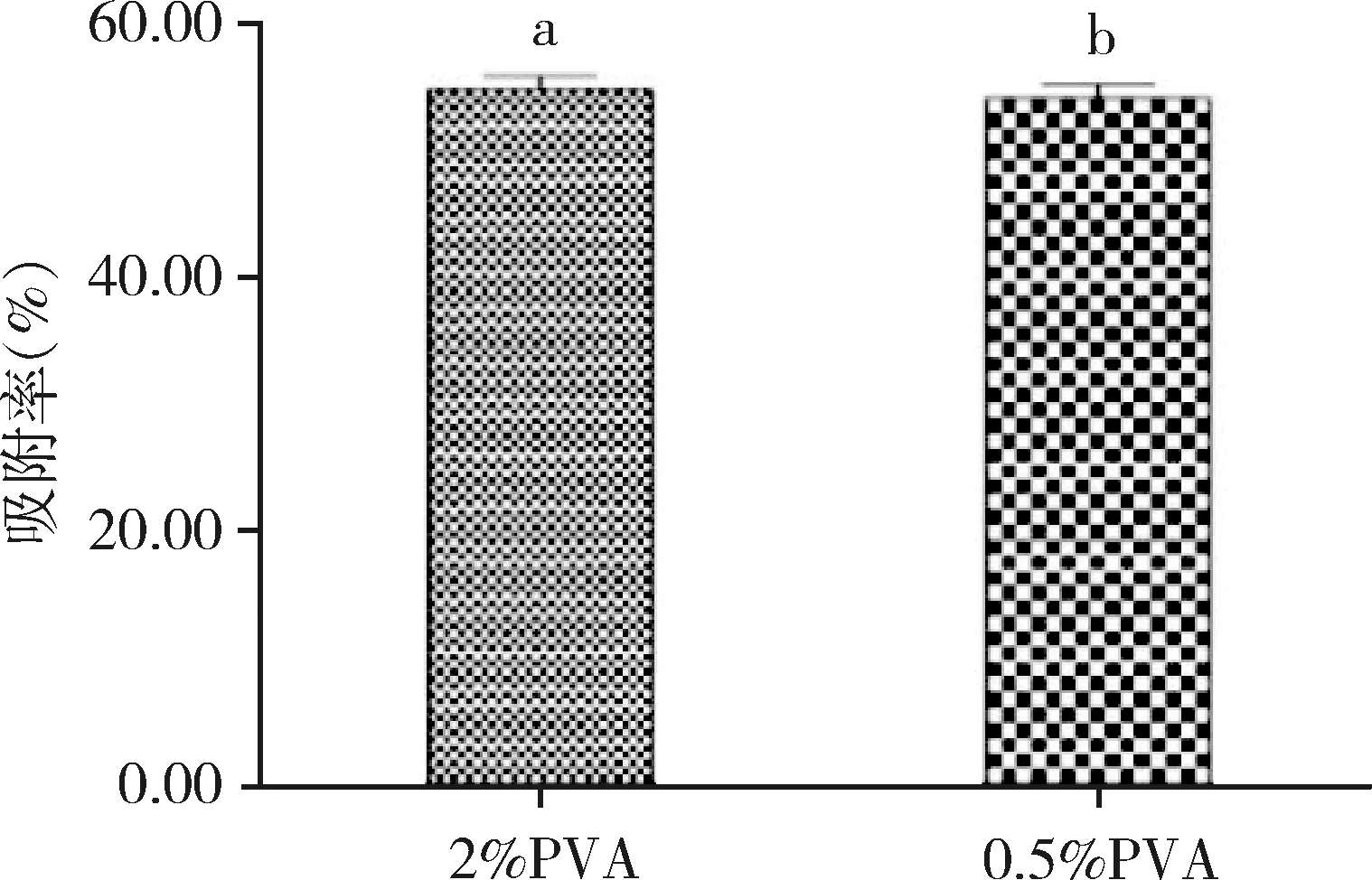
图5 不同PVA浓度固体脂质纳米粒吸附率的比较
3 讨论与结论
研究固体脂质纳米粒吸附性的影响因素的目的是为了增加蛋白的表面吸附、减少剂量、降低成本或提高安全性。无论是真核细胞还是原核细胞,纳米粒子第一步都是先吸附后再通过其他途径进入到细胞内发挥作用。通常正电位纳米粒子与负电位纳米粒子在静电作用下更容易吸附到表面负电位的细菌或细胞表面。细胞对于纳米粒子的粒径也有着严格的控制如:DCs会优先摄取病毒大小的颗粒粒径约为20~200 nm,巨噬细胞则优先摄取0.5~5 μm的颗粒[12]。
氢化蓖麻油的吸附性与单甘脂十四酸混合材料制备的固体脂质纳米粒有显著差异。其原因可能是由于在相同质量下十四酸的相对分子质量为228,单甘脂为358.57。而HCO为938,相同质量下十四酸和单甘脂的分子个数多于氢化蓖麻油,产生的氢键也多于氢化蓖麻油。因此,范德华力更强,且十四酸中含有的羧基与BSA产生的范德华力强于HCO中的羟基,十四酸和单甘脂与BSA的吸附更牢固,吸附率更高。
粒径对于细胞摄取纳米粒有着很重要的因素,其对于抗原的吸附率也会产生一定程度的影响。为了制备不同的固体脂质纳米粒,将乳化时间延长,制备了粒径更小的纳米粒。结果表明,将不同粒径纳米粒子的吸附性进行检测粒径越小吸附性越高,但持续减小并无显著差异。粒径小吸附率高可能是由于小粒径的比表面积(即单位质量物料所具有的总面积)更大,与蛋白接触机会多,使更易纳米粒子结合。
为了制备表面电位为正的固体脂质纳米粒,在脂质材料中加入了带有阳离子基团的双十八烷基二甲基氯化铵(DDAC)。DDAC的量要适当,过多提高固体脂质纳米粒的表面电位可能会引起溶血等不良反应[13]。将带有正、负不同表面电位的固体脂质纳米粒进行比较正电位的吸附率显著高于负电位。BSA等电点为4.8,在中性溶液中带负电,在静电作用下更易与正电位的固体脂质纳米粒结合。
适宜的脂质含量对制剂的使用也很重要,过多的脂质材料注入机体可能会对注射部位产生不良反应,对体内的代谢、抗原的缓释也有一定的影响[14]。本实验中,纳米粒密度低时增加密度可以提高对蛋白的吸附率,这可能是由于纳米粒对BSA的吸附达到饱和状态,增加纳米粒可以吸附游离的蛋白。而进一步提高纳米量却没有显著增加吸附率,这可能由于游离的于吸附的BSA量达到了动态平衡,吸附率相对稳定。
我们的前期研究显示PVA浓度与SLN的粒径、电位、分散系数、包封率等均有关系[15],但本研究显示PVA浓度对纳米粒吸附率没有明显影响,对乳化后固体脂质纳米粒的状态有一定影响。
固体脂质纳米粒对蛋白有普遍的吸附性,但影响吸附的因素很多,可针对不同蛋白通过改变材料、表面电位、粒径、脂质含量进行优化。
固体脂质纳米粒通过表面吸附作为蛋白载体在兽药如疫苗有一定的实用性,通过纳米粒制备组方优化能够更好地发挥纳米载体的功效。
