海洋生物固氮及其对全球变化的响应
2021-04-15史大林胡晓华温作柱洪海征
史大林,胡晓华,温作柱,洪海征
(厦门大学环境与生态学院,近海海洋环境科学国家重点实验室,福建 厦门 361102)
氮是组成地球生命体最重要的元素之一,在生命体中丰度仅次于碳.尽管单质N2占大气组成的78.1%,但绝大多数生物无法直接吸收利用N2,因而氮的生物可利用性往往会限制陆地和水生生态系统的生产力[1].生物固氮是指固氮生物在固氮复合酶的催化下将N2还原成结合态NH3的过程,其不仅为生态系统提供重要的氮来源,而且对平衡生态系统中由厌氧生物主导的脱氮过程(如反硝化和厌氧氨氧化)具有重要的意义[1].在海洋生态系统中,生物固氮、大气沉降、河流输入和深层硝酸盐混合扩散是真光层内“新氮”的主要来源[2-3].尽管如此,绝大部分海区真光层内无机态氮营养盐的存量往往不足以支撑浮游植物的生长;尤其是在热带和亚热带寡营养海区,大气沉降、河流输入和深层硝酸盐混合扩散通量的减少,使得氮成为限制初级生产力的主要营养盐[3].因此,在寡营养海区固氮生物因其固氮能力形成竞争优势,作为主要的“新氮”输入对支撑初级生产力和输出生产力具有重要意义[4].
近10多年来,就固氮作用发生的场所、固氮生物的种类及其重要性,以及在海盆和全球尺度上固氮和脱氮过程是否平衡等问题,海洋学家们进行了广泛的思考和探索[5-8].运用分子生物学、营养盐及其同位素地球化学方法和卫星遥感等手段,大量研究扩展了人们对固氮生物多样性及其栖息地等的认识[3,9-11];同时,生理、生态和生物地球化学模型的发展建立起了海洋固氮作用生态地理分布特征的知识框架,进一步量化了生物固氮在海洋生态系统中的重要性[7,10-12].这些研究进展加深了人类对海洋生物固氮重要性的认知,也引发了新的思考[13].未来,了解人类活动导致的海洋暖化和酸化等一系列海洋环境变化将如何影响海洋生物固氮作用,及其对海洋氮循环将产生怎样的效应,对于认识全球变化下的海洋生态系统和生物地球化学循环至关重要.
1 海洋固氮生物
固氮蓝藻是海洋中最主要的固氮生物.早期研究认为全球海洋生物固氮主要由非异形胞丝状蓝藻束毛藻(Trichodesmiumspp.)和含异形胞的丝状蓝藻贡献;随着分子生物学技术的发展和运用,越来越多固氮生物被发现,如单细胞固氮蓝藻(UCYN)[13];此外,一些含固氮复合酶基因的浮游异养变形菌在海洋中也有着较高丰度和较广分布[14],但其固氮能力以及对全球海洋生物固氮的贡献仍有待揭示.
1.1 束毛藻
在热带和亚热带寡营养海域,束毛藻是最常见的非异形胞丝状固氮蓝藻[15].基于对16SrRNA基因和异形胞分化基因(hetR)的分析,束毛藻被分为4支:分支Ⅰ包括T.hildebrandtii、T.thiebautii、Katagnymenepelagica和K.spiralis,分支Ⅱ包括T.aureum,分支Ⅲ包括T.erythraeum和T.havanum,分支Ⅳ包括T.contortum和T.tenue.虽然没有异形胞,但是束毛藻可将固氮作用和光合作用固碳进行时空上的隔离,以避免氧气对固氮酶以及参与固氮反应的其他蛋白的损伤:空间上,固氮作用仅在固氮胞中进行,固氮胞内不发生光合作用产氧;时间上,固氮酶的活性在光周期中间点达到最高,此时光合作用固碳和产氧量显著下降,耗氧量上升[15].根据估算,束毛藻可贡献高达50%的全球海洋总固氮量[16],一直被认为是海洋中最主要的固氮蓝藻[5].束毛藻通过固氮作用获得的氮(DDN)中10%~90%被释放到周围环境中[17-18],并且迅速转移到硅藻和细菌等其他浮游生物中[19],从而有效支撑初级生产力[20].

图1 束毛藻典型的梭状(a)和散射状(b)束状体Fig.1 Typical Trichodesmium tuft (a) and puff (b) colonies
束毛藻生长和固氮的最适温度为24~30 ℃,在风速低、温度适宜时常形成藻华[21],并且藻丝能够聚集形成梭状和散射状的束状体(图1).束状体的形成与束毛藻的进化分支无关[22],而且单个束状体能够由不同种束毛藻组成[23].目前,束状体形成、解离的原因和动力学过程尚不明确.早期研究推测形成束状体是束毛藻执行固氮作用的必要条件[24],然而Saino等[25]发现游离藻丝体和束状体都具备固氮能力.过去几十年里,大量研究证实束状体形态能为束毛藻带来多方面的生存优势,例如:束状体中心能够提供相对低氧的环境,有利于固氮作用进行[26];束状体形态下,束毛藻垂直迁移的效率提高,有利于获得最佳的光照和营养盐条件[27].近期,Tzubari等[28]通过实验室培养发现,铁和磷营养盐限制可促进T.erythraeumIMS101束状体的形成,而铁或磷营养盐的添加则引起束状体快速解散成游离藻丝,这暗示束状体可能是束毛藻应对铁、磷限制的生存策略.此外,束状体会主动捕获氧化铁或沙尘颗粒,并在中心打包储存,最终实现有效的溶解利用[29].
除了为束毛藻自身带来生存优势外,束状体能够为多种共生生物提供良好的生存环境,如提供具备漂浮能力的附生基底和充足的溶解态有机氮等[18,27].基于对16SrRNA基因和固氮酶还原酶基因nifH的测序分析,拟杆菌(Bacteriodes)和异养变形菌是北太平洋亚热带流涡区中束毛藻束状体内最主要的共生细菌.此外,束状体中还共生着一些单细胞蓝细菌和小型光合自养细菌[30].反之,共生生物也可影响束毛藻的固氮和固碳作用,例如:共生细菌的群体感应效应能提高束状体的碱性磷酸酶活性[31],进而促进磷限制下束毛藻对有机磷的吸收利用;一些共生细菌可分泌铁载体以促进沉降铁颗粒的溶解,从而增加束毛藻获取生物可利用铁的途径[32].
1.2 单细胞固氮生物
近20年来,海洋生物固氮研究最引人注目的发现之一是小粒径UCYN同样具有显著的固氮作用[33].此前UCYN并不是公认的重要海洋固氮生物,直到被发现广泛分布于全球各大海区[34-37],并在形成优势时固氮速率能等同于甚至超过束毛藻[38].UCYN主要分为UCYN-A、UCYN-B[34]和 UCYN-C[35-36,39]3类,其中UCYN-B和UCYN-C已经分离出可纯种培养的菌株,而UCYN-A至今仍未能实现分离培养.
1.2.1 UCYN-A
UCYN-A广泛分布在全球海洋,是近年来备受关注的固氮蓝藻[8].UCYN-A基因组高度简化,缺少光合系统中心Ⅱ(PSⅡ)的所有基因,仅保留了一些光合系统中心Ⅰ(PSⅠ)的关键基因[40].这表明UCYN-A在有光时并不会产生氧气,因此不会抑制固氮酶的活性[33].UCYN-A还缺少核酮糖1,5-二磷酸羧化加氧酶(RuBisCO)、整个三羧酸循环(TCA)以及其他代谢途径,显示UCYN-A很可能是一类异养共生生物[13].运用UCYN-A特异性的16SrRNA基因荧光原位杂交(FISH)探针,Krupke等[41]和Thompson等[42]证实了宿主定鞭藻类(Haptophyta)的存在,其基因序列与钙化藻Braarudosphaerabigelowii高度相似.运用15N2稳定同位素标记结合高分辨率纳米尺度二次离子质谱(NanoSIMS)技术,Thompson等[42]和Krupke等[43]揭示了UCYN-A与其宿主细胞之间碳和氮交换的过程,即UCYN-A固氮提供氮源,宿主细胞固碳提供碳源.相较于束毛藻喜好温暖且寡营养的环境,UCYN-A能在温度较低且富含溶解态无机氮的环境中生长[6,44],并仍然能够进行固氮作用[9],例如在高纬度丹麦海峡[45]和北极西部区[46-47].这些发现挑战了以往普遍认为全球海洋固氮作用仅发生在热带和亚热带寡营养海区的观点.
1.2.2 UCYN-B
UCYN-B的基因组较UCYN-A完整,含有PSⅡ和RuBisCO中的关键基因.为了避免光合作用所产生的氧气抑制固氮酶,UCYN-B在时间上将产氧过程和固氮过程分离,即白天进行光合作用,夜晚进行固氮作用[48].UCYN-B的适宜生长温度在22~36 ℃之间,且其nifH基因丰度与温度呈现正相关关系[38,44].迄今为止,已有多株UCYN-B被成功分离培养,且都属于瓦氏鳄球藻(Crocosphaerawatsonii),主要分为大细胞型(直径≥4 μm)和小细胞型(直径<4 μm)两个表型.大细胞型相比小细胞型具有更加丰富的基因组信息,适当的基因冗余可能会提高大细胞型在铁、磷限制环境中的适应能力[49];并且大细胞型能分泌更多的胞外多糖[50],有助于海雪的形成,实现有机碳输出[51].此外,两种表型在生长最适温度、单位细胞固氮速率以及光合作用效率方面都存在一定差异[52].
1.2.3 UCYN-C
UCYN-C可能是营游离生活的UCYN[36],在热带西北大西洋首次被鉴定并报道[39].Needoba等[53]证实过去在德克萨斯海湾分离出来的UCYNCyanothecespp.ATCC51142属于UCYN-C,Taniuchi等[54]则在黑潮上游分离培养了UCYN-CTW3.尽管如此,目前对UCYN-C的分布、多样性以及固氮过程等生理特征的认识还非常有限.与UCYN-B相似,UCYN-C也主要在夜晚进行固氮[53-54],且更加偏好温暖的水体[37].Bonnet等[19]通过中尺度围隔实验发现:UCYN-C形成藻华时引入的DDN有16%被释放到溶解态氮库中,21%转移到非固氮浮游生物中;此外,UCYN-C能够形成大小为100~500 μm的聚集体,水体中约10%的UCYN-C发生沉降,直接贡献约22.4%的总有机碳输出通量.
1.3 硅藻-固氮蓝藻共生体(DDAs)
内胞植生藻(Richeliaintracellularis)和眉藻(Calothrixrhizosoleniae)是一类含异形胞的丝状固氮蓝藻,与一些链状硅藻形成共生关系,被定义为DDAs.根据nifH基因进化分析,DDAs主要可分为3个进化分支:植生藻和根管藻(Rhizosoleniaclevei)共生、植生藻(Richelia)和半管藻(Hemiaulushauckii)共生以及眉藻(Calothrix)和角毛藻(Chaetocerosspp.)共生[55].其中,内胞植生藻附生在根管藻和半管藻的硅质外壳和细胞膜之间,而眉藻则主要附生在角毛藻的硅质壳外部.运用NanoSIMS技术,Foster 等[50]发现:植生藻会固定超过自身生长所需81%~744%的氮,其中的97.3%被快速转移到其宿主硅藻中,表明在DDAs的共生关系中,固氮蓝藻可为宿主硅藻提供可利用的氮源;此外,共生形态植生藻和眉藻的固氮速率比游离形态高171~420倍,显示了宿主硅藻对固氮蓝藻生长和固氮的显著影响.
早期,DDAs和束毛藻被认为是海洋中主要的固氮蓝藻.然而,十分有限的现场观测仅在北太平洋夏威夷岛屿附近的长时间序列站位ALOHA,以及一些大型河流的冲淡水区域,发现了较高丰度的DDAs或其藻华[57-59].与束毛藻不同,DDAs固定的氮不能迅速释放并传输到食物网中[19],但DDAs中共生硅藻硅质外壳的高保存度和高沉降速率特性使得DDAs能够快速沉降输出,表现出较高的生物泵效率[57].ALOHA站位的长时间观测结果显示,夏季有机颗粒物输出通量峰值的出现与DDAs藻华爆发高度相关[60],由此可见,在寡营养开阔大洋DDAs对大气CO2的埋藏可能起着重要作用.
1.4 非蓝藻异养变形菌
在ALOHA站位,除UCYN外,在nifH基因水平和转录水平上发现的还有非蓝藻固氮生物——异养变形菌[34].异养变形菌在陆地生态系统中是常见的固氮生物,栖息在富含有机物的土壤中或与固碳植物共生.在海洋生态系统中,异养变形菌同样广泛分布于全球各大海区并具有极高的生物多样性[33,37,46,61].在氮限制条件下,低浓度的溶解有机物和过饱和的溶解氧很可能会抑制异养变形菌的固氮酶活性.有研究认为固氮异养变形菌可能附着在有机质丰富的悬浮颗粒中,由于悬浮颗粒独特的物理结构能够有效限制物理扩散过程,颗粒周围O2浓度降低并形成区别于水体的微环境,从而有利于固氮作用发生[62].Gamma A(γ-24774A11)是目前研究最为广泛的固氮异养变形菌,主要生活在温暖、寡营养的表层海水,其nifH基因的丰度和活性随深度增加而下降,表现出与固氮蓝藻类似的生态位特征[63].尽管如此,目前异养变形菌的固氮能力尚存在争议.在热带东南太平洋,Turk-Kubo等[64]发现异养变形菌并不能贡献过去在该海区报道的固氮速率,其对全球海洋固氮通量的贡献仍然是有待解决的科学问题.
2 海洋生物固氮

图2 海洋固氮速率、固氮生物种类及营养盐限制特征的全球分布Fig.2 Global distribution of nitrogen fixation rates,diazotrophic species and nutrient limitation characteristics in the ocean
长久以来,海洋固氮作用和反硝化作用通量的平衡关系被认为是影响海洋氮储量和生物泵效率,并最终成为影响大气CO2和地球气候的决定因素[65-67].然而,直到便捷的固氮速率测量方法出现[68],在相当长的一段时间里海洋生物固氮很少受到关注.脱氮过程则一直是海洋学研究的热点,尤其是在近岸沉积物和主要的缺氧区(ODZs)[69].随着海洋固氮研究的发展,模型模拟和现场观测的全球海洋固氮通量从<100 Tg/a到>200 Tg/a不等,其中现场观测平均通量为(137.0±9.2) Tg/a[70],小于模型计算的反硝化通量120~240 Tg/a[71].该结果暗示全球海洋氮收支处于不平衡状态.然而,迄今为止海洋生物固氮的观测仍非常有限,测量方法不统一,且大部分集中在热带和亚热带寡营养海区,时空变异性大,覆盖不足,故外推到全球尺度存在较大的不确定性.
2.1 主要技术手段
固氮速率的测定以及固氮生物群落组成和活性的分析,是海洋生物固氮研究的主要技术手段.乙炔还原法和15N2气体稳定同位素示踪法是海洋固氮速率测定的常用方法.其中,乙炔还原法并不直接测定NH3的产生,而是间接测定乙烯的产生并将其换算成固氮量[72].20世纪末,同位素比值质谱技术突飞猛进,极大提升了15N2气体稳定同位素示踪法的灵敏度和可操作性,因而成为寡营养海区固氮速率测定的主要方法之一[73].需要关注的是,近期的研究表明15N2气体在短时间内无法充分溶解于海水达到水气平衡,这使得直接充入15N2气体的测定方法可能会低估实际的固氮速率,因此建议采用注射15N2气体饱和水的方法[74].此外,以往研究中所使用的15N2气体可能存在15NH4+或15NOx的污染,从而导致对固氮速率的高估[75].由此可见,实验方法和条件的差异给统一校正现场观测的固氮速率造成了相当大的困难与挑战[74,76],极大地影响了对全球海洋固氮通量的准确估算.因此,建立一套统一且准确的固氮速率测定和计算方法具有至关重要的意义[77].
固氮生物群落结构和活性的测定通常分别针对nifH基因的DNA和RNA进行定量PCR[78-79].此外,针对固氮生物16SrRNA基因的分析亦可以获得原位固氮生物的群落组成[80].近年来,随着质谱技术的迅猛发展,可通过NanoSIMS得到单细胞的固氮速率,进而研究DDN的释放和传输[81].
2.2 速率的时空分布特征
从空间分布上看(图2),大西洋是生物固氮研究最为集中的海区,水柱积分固氮速率从<0.1 μmol/(m2·d)到> 10 000 μmol/(m2·d)不等[82-83].如果忽略固氮速率测定方法的差异,那么整体上赤道大西洋是生物固氮的热点区域,固氮速率从赤道向两极方向显著下降.该分布特征与一些全球模型的分析结果相符[12,84-85].此外,模型和现场实测的结果均显示南、北大西洋的固氮速率相当[12,84-85],但两个海区固氮生物的类群可能截然不同:束毛藻通常主导北大西洋的固氮生物类群[37,82-83],而UCYN则是南大西洋的优势固氮生物[20].
相较于大西洋,太平洋的生物固氮观测相对有限,且多数集中在ALOHA站位,其平均固氮速率为183 μmol/(m2·d)[86].基于氮、磷营养盐浓度的模型结果表明,太平洋东边界的ODZs应该是固氮作用发生的热点区域[87-88].Deutsch等[88]认为ODZs脱氮过程导致的磷过剩能够刺激固氮作用,这为一定时空尺度内氮输入和输出的耦合提供了理论基础;然而,该模型忽略了铁在该区域的重要性,实际测量的固氮速率<23 μmol/(m2·d),与模型结果大不相符[89].相较于东太平洋,西太平洋可能是固氮作用发生的热点区域.例如,束毛藻是热带西南太平洋新喀里多尼亚海域最主要的固氮生物,平均固氮速率高达570 μmol/(m2·d)[85],该速率远高于模型预测的结果(150~200 μmol/(m2·d)[12]),落在全球海洋固氮速率数据库的高值范围内(100~1 000 μmol/(m2·d)[70]).此外,在北太平洋西边界流黑潮区域时常发生束毛藻藻华,水体平均固氮速率约为200 μmol/(m2·d)[12].
印度洋的固氮作用较少受到关注.多数模型研究表明整个印度洋海区表现出显著的固氮作用[12,70],然而为数不多的观测显示该海区的固氮速率并不高,为6.27~47.1 μmol/(m2·d),异养变形菌可能是该海区主要固氮贡献者[90].
从时间尺度上看,固氮速率从冬季到夏季总体上呈现升高的趋势[12,60,91].例如,在北太平洋的ALOHA站位,2005—2012年间深度小于125 m的水层中固氮速率为16~347 μmol/(m2·d),在5—10月当表层海水升温且分层时,固氮速率通常有明显升高的趋势,达(263±147) μmol/(m2·d)[92],同时nifH基因的丰度亦呈现相似的变化规律[38].除了温度外,固氮速率呈夏高冬低的特征,还可能与中尺度物理过程[93]、不同水团的转移和混合[94]以及冬季海水混合产生的磷残留[95]相关.固氮速率和nifH基因的变化反映出固氮生物的分布会随时间变化[79].Cheung等[96]报道北太平洋主要固氮生物UCYN-A1、束毛藻和Gamma A变形菌的丰度呈现明显的季节变化,丰度高值分别出现在春-秋、夏-秋和春季.
2.3 新栖息地
固氮作用往往被认为主要发生在温暖的热带-亚热带寡营养海区[84-85].近20年来,越来越多研究表明在低温、高营养盐的水体中也存在显著的固氮作用[6,44],例如:在亚马逊河和湄公河等河流冲淡水区域,DDAs常形成优势、主导固氮作用[57-58,83],从而对输出生产力有显著贡献[57].此外,一些研究发现近岸区域的固氮速率能够等同甚至超过同纬度寡营养海区[97-99].Tang等[10]结合现场实测数据计算得到全球近岸固氮通量为16.7 Tg/a,显示了近岸水体固氮作用对全球海洋氮通量的贡献.近期,Shiozaki等[46-47]在北冰洋测得水体固氮速率在4.11~69.6 μmol/(m2·d)之间,UCYN-A是该海区主要的固氮蓝藻.Harding等[9]运用NanoSIMS在单细胞水平上证实北冰洋中的UCYN-A能够发挥固氮作用,并且其固定的氮能够快速转移到宿主细胞中.此外,在无光区也存在固氮作用,但速率通常小于1 nmol/(L·d);倘若该速率是准确的,考虑到无光区庞大的体积,其固氮通量甚至有可能超过真光层[99-101].上述新发现拓展了对海洋生物固氮的传统认知,提升了对海洋氮收支平衡的理解,并且表明未来需要加强大洋尺度的固氮观测,尤其是对传统观点认为不适合固氮作用发生的近岸和极地海区的固氮速率进行测量.
3 影响固氮作用的环境因子
海洋生态系统中,物理、化学等诸多环境因子均会影响固氮生物的生长、活性和分布,其中大部分环境因子与能量和营养盐供给相关[2,88].
3.1 光照辐射
与硝酸盐和铵盐等无机氮的吸收利用相比,固氮作用需要额外的细胞能量还原N2分子.光照作为光合自养固氮生物的能量来源,是调控固氮作用的重要环境因子[102],因此光合自养固氮生物的固氮酶活性与光合作用息息相关[102-103].对全球海洋固氮速率数据库的统计分析结果显示,光照辐射作为一个环境因子,对全球海洋固氮速率分布特征的解析度最高[103],体现了其在调控全球海洋固氮作用分布中的重要性.
野外现场和实验室的研究结果表明,束毛藻的生长和固氮酶活性均受到光照辐射的调控[104].在一定光照强度范围内(光量子通量密度<160 μmol/(m2·s)),实验室的束毛藻固氮速率随着光照强度的增加而升高[105],其生长的饱和光强在80~100 μmol/(m2·s)之间[26].相比之下,天然水体中束毛藻适应于相对高光的环境,其饱和光强在300~400 μmol/(m2·s)之间[104].然而,过高的光强可能会对束毛藻的生长产生光抑制[106],因此细胞需要通过提高光呼吸和米勒反应使固氮酶免受光合产氧的损害[107].在这种情况下,束毛藻可能会选择向下迁移到相对适宜的水层,这也可能是天然水体中束毛藻的丰度和固氮速率最大值出现在15~40 m水深处的原因之一[21].
3.2 温 度
以往普遍认为固氮作用主要发生在温暖的热带和亚热带海区,且固氮速率和海表温度呈显著正相关[108].然而,温度并非固氮酶活性的内在控制因素,在极限温度下(例如温度降至0 ℃)固氮生物仍然具有固氮能力[109].每一种固氮生物都有各自最适生长的温度,因此温度会显著影响不同固氮类群的全球分布特征,例如:在马尾藻海,当温度低于20 ℃时,束毛藻丰度显著减少;而当温度高于25 ℃时,束毛藻则能形成藻华[21].在束毛藻的最适生长温度范围内,其丰度与水温呈现正相关关系[91].与束毛藻相似,马尾藻海和ALOHA站位附近UCYN-BnifH基因的丰度也与温度显著正相关,当温度为29 ℃时其丰度达到最高[38,44].相比之下,UCYN-A则偏好温度更低的环境,在马尾藻海其nifH基因丰度在24 ℃时达到最高[44].近期,模型结果显示温度是调控高纬度海区固氮作用的主要环境因子[12],在温度低于20 ℃的海区,固氮作用鲜有发生[70].然而,该结果与北冰洋实测结果不符,UCYN-A被发现能在极地环境(温度低于5 ℃)中生存,且存在显著的固氮速率[9,46].该发现表明UCYN-A具有更加广泛的全球分布特征,其对全球海洋固氮作用的贡献不可忽视[8].
3.3 营养盐
固氮生物光合系统中心和固氮酶的合成都需要大量铁,其对铁的需求是单纯以NH3为氮源时需铁量的5倍[110];磷则是细胞中能量物质(三磷酸腺苷和还原型辅酶Ⅱ)、遗传物质(DNA和RNA)以及细胞膜成分(磷脂)等生物大分子的重要组成元素.因此,铁和磷是调控热带和亚热带海区固氮作用分布的重要营养盐[20],而寡营养海区上层水体中低浓度的溶解态铁(dFe)和无机磷(DIP)通常会限制固氮生物的生长和活性[111-112].不同的固氮生物采用不同的策略应对铁、磷营养盐限制[113-115],例如:束毛藻可通过调整光合电子传递、利用多种形态的铁和储铁蛋白以应对铁限制[116];鳄球藻在光周期将有限的铁投入到PSⅠ中,在暗周期则重新利用这部分铁进行固氮,从而提高在铁限制下细胞的铁利用效率[114].在磷限制条件下,束毛藻能够用非磷脂取代磷脂作为膜脂结构以减少对磷的需求,并可利用磷酸脂[115];鳄球藻则通过表达更多高亲和力的磷转运体以应对磷的缺乏[113].
开阔大洋中,铁主要通过陆源沙尘沉降和深层水混合扩散进入真光层[20],磷则主要通过物理混合扩散作用和侧向传输过程进入真光层[117].铁、磷的供给和生物可利用性以及固氮生物对铁和磷营养盐的竞争能力,决定了全球海洋固氮生物的生物地理分布特征、活性、群落组成以及生态地位.
普遍认为磷是中纬度北大西洋固氮作用的主要限制性营养盐.来自萨赫勒和撒哈拉的沙尘沉降使得表层海水中dFe浓度达到0.2~1.2 nmol/L[111-112,118],刺激该海区束毛藻主导的固氮作用(速率高达100~1 000 μmol/(m2·d)[70,111,116]),从而消耗DIP使得其在表层海水中的浓度低至1 nmol/L[119].与有机磷吸收利用相关的碱性磷酸酶基因phoX和phoA的表达上调,表明该海区束毛藻的生长受到磷限制[120].相比之下,南大西洋固氮作用营养盐限制特征仍然存在争议.沙尘沉降的减少导致表层dFe浓度显著下降(仅为0.1~0.4 nmol/L),固氮速率降至20 μmol/(m2·d)以下,束毛藻丰度显著减少而单细胞固氮生物形成优势[111,116];与此同时,表层DIP浓度却比北大西洋高1~2个数量级[111,116,119].这些特征均暗示南大西洋的固氮作用可能受到铁限制.
北太平洋的固氮研究多集中在ALOHA站位[60].Grabowski等[121]通过营养盐受控培养实验发现,铁的加入能够刺激ALOHA站位的固氮作用.Rouco等[122]通过对比发现ALOHA站位的束毛藻较北大西洋的束毛藻表达更多响应铁限制的基因,表明铁是ALOHA站位固氮作用的主要限制因子[112].相比之下,北太平洋其他区域关于固氮作用营养盐限制特征的研究并不多.从营养盐分布上看,表层dFe和DIP浓度分布均表现出自西向东的变化趋势:dFe浓度自西向东递减,DIP浓度则自西向东递增[119,123].这暗示着北太平洋的固氮作用及其营养盐限制特征可能存在自西向东的差异.例如,西北太平洋亚热带流涡区的沙尘沉降通量显著高于其以东和以南的区域,由此带来的铁输入可能刺激该海区固氮生物的固氮作用[124-125].Shiozaki等[124]运用15N2气体法测得该海区的积分固氮速率为184~349 μmol/(m2·d),该数值落在全球固氮速率数据库的高值范围内(100~1 000 μmol/(m2·d)[70]),且UCYN可能是该海区生物固氮的主要贡献者[125].北太平洋西北部的固氮速率为0.3~13.6 nmol/(L·d),显著高于北太平洋西部和中部(0.17~3.62 nmol/(L·d)),且固氮生物群落中UCYN-A的丰度较高[126].沙尘带来的铁使得该海区表层DIP浓度低至3 nmol/L,最终形成生物固氮的磷限制[127].
南太平洋的沙尘沉降通量进一步下降[112],使得该海区固氮生物更有可能受到铁限制.然而,近年来在西南太平洋一些岛屿附近时常发现束毛藻主导的高固氮作用[85],由此推测“岛屿效应”引入的陆源营养盐(尤其是铁)可能替代沙尘沉降,成为调控该区域固氮作用的重要因素[128].在中心南太平洋和东南太平洋,尽管表层海水中DIP浓度可高达300 nmol/L以上[119],但是dFe浓度仅为0.1~0.3 nmol/L[128],因此固氮速率较低[128].与东北太平洋相似,铁可能是该海区以UCYN-A和异养变形菌为主的固氮生物的限制营养盐[85].
印度洋的固氮观测并不多,其北部的阿拉伯海海区大气沙尘沉降高(表层dFe浓度高达1 nmol/L[112,129]),再加上磷相对充足(约250 nmol/L[90]),时常发生大范围束毛藻藻华[130].而在印度洋中南部海区,表层dFe浓度仅为0.05~0.13 nmol/L[90],显著限制了该海区的固氮作用(速率小于20 μmol/(m2·d)).
此外,在一些海区固氮作用会受到铁和磷的共同限制[131-132].该现象可能反映出水体中铁和磷营养盐浓度同时下降到限制水平,或者一种固氮生物受到其中一种营养盐的限制,而另一种固氮生物则受到不同营养盐的限制[133].例如在北赤道大西洋,尽管整体上沙尘沉降比较充足[20],但是现场铁和磷营养盐添加培养结果表明,在特定时间和空间尺度上固氮作用仍然有可能受到铁和磷的共同限制[134-135].
全球大洋的固氮速率及主要限制性营养盐见表1.
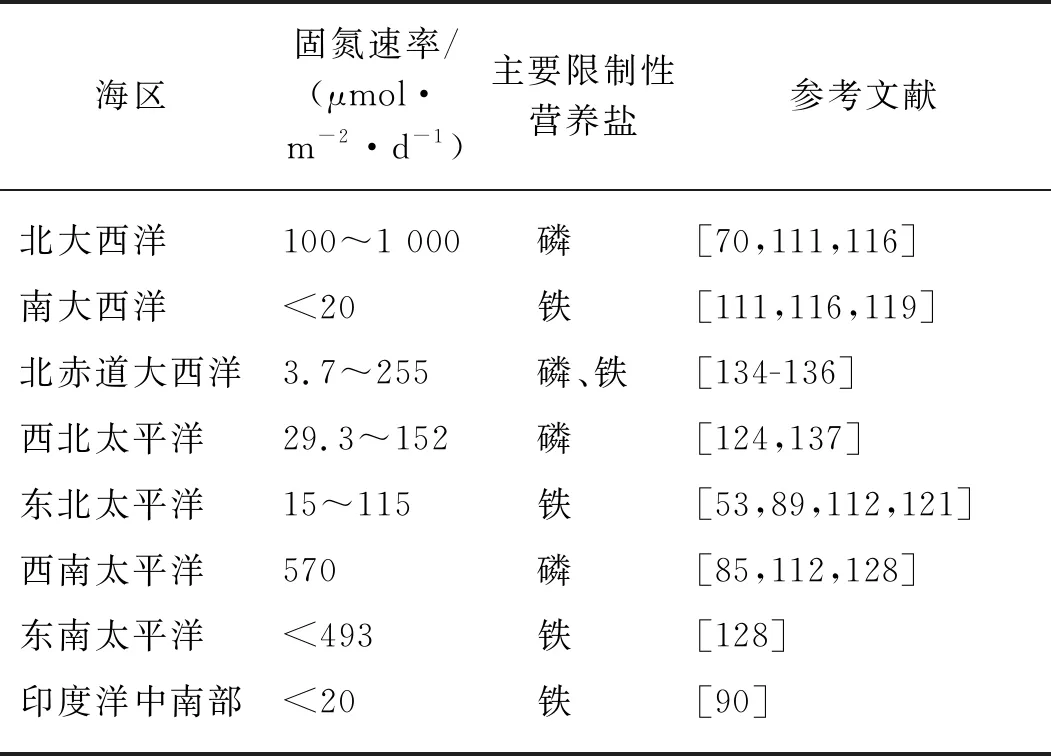
表1 全球大洋固氮速率及主要限制性营养盐Tab.1 The nitrogen fixation rate of the global oceans and the main limiting nutrient
3.4 其他因子
除了受到光照、温度和营养盐等上行调控外,浮游动物摄食等下行调控同样会显著影响海洋生物固氮的分布[138].尽管固氮生物在浮游植物群落中的占比较小(<10%),但近期在西南太平洋开展的围隔实验发现,桡足类会捕食所有种类的固氮生物,且28%的浮游动物氮生物量来源于固氮生物[139].通用地球系统模型(CESM)结果显示,高固氮速率多发生在低摄食压力的氮限制区域;而在印度洋海盆、西太平洋和近岸上升流等区域,下行摄食压力使得固氮生物量保持在较低水平[139].
海洋物理过程也是影响全球海洋固氮作用分布的重要因子,然而直到近年来物理过程对固氮作用的影响才开始受到关注.例如:有研究发现束毛藻的丰度与反气旋涡有关[140].在ALOHA站位,超过3年的定点观测结果显示高固氮速率多伴随着反气旋涡的发生[38].此外,束毛藻由于极具漂浮性的特征,很容易被海流带向其他海区[141].在南海东北部的研究结果显示,西边界流黑潮入侵会显著影响南海北部固氮作用的空间格局,且受黑潮影响区域的固氮速率可能与黑潮入侵南海的强度有关[142],然而其背后的机制仍有待揭示.
4 全球变化对海洋生物固氮的影响
人类活动引起的环境变化正在给海洋生态系统带来诸多挑战,包括大气CO2浓度上升引起的海洋酸化和暖化[143]、光照强度和紫外(UV)辐射的增强[144]、大气沙尘沉降的增加[20]以及缺氧脱氮区域的扩张[145].这些海洋物理、化学性质的改变,最终可能显著影响海洋生物固氮及其相关的生物地球化学循环过程.迄今为止,全球变化对海洋生物固氮影响的研究大多聚焦于海洋酸化效应,而关于海洋暖化和光照条件改变等其他环境因子影响的研究则相对较少[105].将来的研究需要在进一步提升对固氮生物响应海洋酸化的认知基础上,系统深入地开展全球变化中单环境因子以及多因子耦合对海洋生物固氮影响的研究.
4.1 海洋暖化的影响
海洋暖化除了表现为海水温度上升外,往往会进一步引起混合层变浅和水体层化加剧,阻碍深层氮、磷等营养盐向真光层的输送,并同时增加混合层中浮游生物暴露在强光和强UV辐射的风险[145-146].单独的升温可能会使束毛藻和鳄球藻等固氮生物获益[147],再加上水体层化加剧以及深层营养盐输入通量的减弱[145],海洋暖化可能更有利于海洋生物固氮作用.据预测,海表温度上升将使束毛藻和鳄球藻的生境向极地区域扩张,而低纬度海区的增温可能超出束毛藻的耐受范围[148];加之光强和UV辐射增加,有可能对束毛藻产生不利影响[146].Cai等[149]发现无论是长期还是短期的UV辐射暴露均会对束毛藻的生长和固氮产生抑制作用.有模型预测到21世纪末,由束毛藻贡献的全球海洋固氮通量将减少[148].结合ODZs的扩大、水体脱氮作用的增强以及固氮作用的滞后性,海洋暖化将导致海洋中固定氮的净流失[7].上述研究结果表明,目前海洋暖化及其派生的其他环境效应将影响固氮生物的生理特征和生态分布,但相关机制仍有待进一步的实验室和现场研究予以系统阐明.
4.2 海洋酸化的影响
海洋酸化对束毛藻等固氮生物的影响是近10年来海洋生物固氮研究的热点和焦点之一.围绕这一前沿问题,国际上开展了大量的室内酸化受控培养研究.尽管固氮生物对海洋酸化的响应存在种间差异,但大多数实验结果显示CO2浓度上升可促进束毛藻和鳄球藻的生长和固氮[150-152].究其原因,海水CO2浓度上升导致固氮生物的CO2浓缩机制(CCM)下调,由此节省的能量可被用于固氮作用等其他细胞过程[153].然而,少有研究定量评估因CCM下调所能节省的细胞能量及其对生长和固氮的影响[154].此外,Hong等[155]近期的研究发现,以往培养实验所使用的人工海水培养基(YBCⅡ)可能存在NH4+和铜等金属的污染,从而影响束毛藻的生理状态及其对酸化的响应;通过使用天然海水培养基(Aquil-tricho)发现,海水pH降低导致束毛藻需要投入额外的物质和能量以维持细胞内的pH稳态,并且海水pH降低的负效应超过CO2浓度升高的正效应,因此海洋酸化总体上抑制束毛藻的生长和固氮.在此基础上,Luo等[154]通过建立细胞模型揭示了海洋酸化下束毛藻CCM下调所能节省的能量非常有限,并进一步预测到21世纪末,海洋酸化将导致全球海洋束毛藻的固氮潜能下降约27%.迄今为止,已报道的室内酸化培养实验都是以丝状的束毛藻作为研究对象[151,155-156],而酸化对形成不同形态束状体的束毛藻的影响尚有待揭示.相较于室内酸化受控培养实验,目前海洋酸化对海洋生物固氮的现场研究非常有限,并且尚无一致的结论[157-158].固氮生物群落结构的差异可能是造成不同海区海洋酸化效应不一致的原因之一.
在全球变化背景下,海洋固氮生物不仅受到单一环境因子改变的影响,而是受到多环境因子改变的综合作用.因此,固氮生物在面临海洋酸化威胁的同时,也将经历升温、光照胁迫增强以及营养盐条件变化等的影响.这些环境因子的改变可能影响固氮生物对海洋酸化的响应.实验室纯种培养结果显示,铁限制会加剧海洋酸化对束毛藻生长和固氮的负效应[159],而磷限制如何调控海洋酸化对束毛藻生长和固氮的影响目前尚无定论[151,156].相比之下,其他环境因子例如光照胁迫增强、升温与海洋酸化的耦合研究相对较少[105,151],相关的现场研究几乎空白.未来需要加强海洋现场实际场景下的机制研究,以系统解析海洋环境变化对生物固氮的生态效应.
5 展 望
过去数十年的研究工作极大地加深了对海洋生物固氮的认识,使人们更加了解海洋固氮生物的多样性以及不同固氮生物在海洋氮循环中的重要性.与此同时,研究者们也发展出更准确的测量方法和数值模型以评估海洋固氮速率、固氮生物的生长以及分布特征等.然而,海洋生物固氮研究依旧存在一些亟待阐释的重大科学问题:1) 全球海洋氮收支是否平衡;2) 哪种固氮生物对海洋结合态氮的贡献最大;3) 全球变化背景下全球海洋固氮格局会发生怎样的变化.未来,结合新的微生物学、组学、同位素化学方法以及数值模型等研究手段,人们对海洋生物固氮及其重要性的认知将迎来新的提升.
