滴定法快速测定发酵液中植酸酶活性
2021-04-14公维丽韩庆晔马耀宏王丙莲孟庆军杨俊慧刘庆艾史建国
公维丽,韩庆晔,马耀宏,王丙莲,杨 艳,孟庆军,杨俊慧,刘庆艾,蔡 雷,史建国
(1.齐鲁工业大学(山东省科学院) 山东省科学院生物研究所,山东 济南 250103;2.山东省生物传感器重点实验室,山东 济南 250103)
植酸酶(EC 3.1.3.8,EC 3.1.3.26,EC 3.1.3.72)是一类磷酸酶,它可以特异性降解植酸中的磷酸基团。目前植酸酶已应用于多个领域,如动物饲料、环境和医药领域[1-2]。随着植酸酶需求的日益增加,准确测定植酸酶的活性对植酸酶生产过程优化控制具有重要意义,这也是保证植酸酶酶制剂质量和功能的关键[3-5]。
发酵液中植酸酶活性测定的传统方法为比色法,通过植酸酶降解植酸产生的无机磷与钼酸铵反应,生成黄色复合物,在波长415 nm下进行比色测定[6-7]。然而在微生物发酵培养基中,通常添加大量的KH2PO4和K2HPO4以提供微生物生长所需的磷元素,使得植酸酶发酵样品中含有高含量的背景无机磷[8]。因此,在植酸酶活性测定中,高含量的背景无机磷(约1.48 ~1.98 mg/mL )会掩盖短时间内植酸酶作用于植酸产生的无机磷,导致植酸酶活性测定波动较大、可重现性低[3]。为排除植酸酶发酵样品中背景无机磷的干扰,以前的研究多采用透析的方法去除背景无机磷,但是笔者的研究结果显示,植酸酶发酵样品至少需要透析6 h才可以将背景无机磷去除彻底[9],而长时间的透析无法满足大规模植酸酶发酵行业中植酸酶活性的准确、快速测定。
近些年来,随着新型技术的发展和检测手段的提高,除传统的比色法外,许多新的方法也应用到植酸酶活性分析检测方面,如琼脂平板法、高效液相色谱法、酶联免疫吸附法等[10-12]。Bae等[10]建立的琼脂平板法主要通过在培养混合菌的琼脂平板(添加植酸钠)上加入氯化钴、钼酸铵-钒酸铵等染色剂,在产植酸酶的微生物周围可出现明显的染色条带,此方法在产植酸酶菌的简便、快速筛选中具有明显优势,但其缺点是无法对植酸酶活性进行定量测定。高效液相色谱法是以人工合成底物植酸的类似物(TInsP5)为探针建立的,该方法可以对植酸酶活性进行快速、准确、高灵敏的检测,但是测定所需的设备昂贵,操作繁琐、要求高,因此不适合普通实验室和工业规模发酵样品的测定[11]。酶联免疫吸附法具有高特异性、高灵敏性的特点,但要求样品纯度高、抗原性强,且需酶标记抗原或抗体等繁琐操作才可实现检测,大大增加检测的成本[12]。
因此,为了进一步开发可应用于工业规模植酸酶活性测定的方法,本研究基于单位酶活可用单位时间、单位体积中底物的减少量来表征的原理,拟建立一种简单的滴定方法和装置,以实现植酸酶活性的准确、快速测定。
1 材料与方法
1.1 仪器与试剂
TECAN酶标仪,瑞士TECAN公司;植酸酶活性测定仪,笔者课题组自主研发。
钼酸铵((NH4)2MoO4)、钒酸铵(NH4VO3)、硝酸(HNO3)、醋酸、醋酸钠、三氯化铁(FeCl3)、磺基水杨酸、三氯乙酸,生工生物工程(上海)有限公司;植酸钠,美国Sigma公司;标准植酸酶(44 000 U/g),潍坊康地恩生物科技有限公司;植酸酶发酵样品由毕赤酵母GS115植酸酶工程菌产生。
1.2 实验条件
1.2.1 国标法测定植酸酶发酵样品的酶活性
国标法测定植酸酶发酵样品中酶活性的操作步骤和反应体系:实验组先加入90 mL醋酸/醋酸钠缓冲液(pH 5.5),10 mL待检测植酸酶发酵样品,充分混匀,于37 ℃预热5 min,加入200 mL植酸钠底物(7.5 mmol/L),充分混匀后于37 ℃反应30 min,加入200 mL终止显色液((NH4)2MoO4、NH4VO3和HNO3的体积比为1∶ 1∶ 2)终止反应,在波长415 nm下进行比色测定;对照组先加入90 mL醋酸/醋酸钠缓冲液(pH 5.5),10 mL待检测植酸酶发酵样品,200 mL终止显色液,充分混匀,于37 ℃预热5 min,200 mL植酸钠底物(7.5 mmol/L),充分混匀后于37 ℃反应30 min,在波长415 nm下进行比色测定。
植酸酶国际酶活单位定义:植酸酶在1 min内作用于植酸钠底物(5 mmol/L)释放1 μmol/L无机磷等同于一个酶活单位的植酸酶活性。
1.2.2 自主研发植酸酶活性测定仪
植酸能与Fe3+在酸性条件下生成稳定的化合物,用标定的FeCl3滴定植酸,用磺基水杨酸做指示剂,当Fe3+稍过量时即与磺基水杨酸生成紫红色的化合物,从而显示终点,根据这一原理[13],笔者自主研发了一种利用滴定方式进行植酸酶发酵液中植酸酶活性的测定装置,其构造如图1所示。在工作过程中,计算机控制系统调控⑧吸取5 mL工作液(磺基水杨酸-乙酸缓冲液(由2 mL质量分数为10%的磺基水杨酸钠与100 mL乙酸缓冲液配制))加入滴定池,吸取5 mL待测样品液从①加入滴定池,开启⑥,采用0.03 mol/L FeCl3溶液对所述待测样品液进行滴定,至工作液指示反应终点时结束滴定。

①—进样口;②—滴定池;③—光电检测装置;④—液体泵;⑤—清洗液瓶;⑥—滴定泵;⑦—滴定液瓶;⑧—液体泵;⑨—工作液瓶;⑩—搅拌子;—液体泵;—废液瓶图1 植酸酶发酵液中植酸酶活性的测定装置Fig.1 Schematic diagram of detection device for determination of phytase activity in fermentation broth
1.2.3 植酸钠浓度-滴定时间线性标准曲线制备
配制3、6、9、12、15和18 mmol/L的植酸钠溶液,分别吸取5 mL不同浓度的植酸钠溶液加入滴定池,采用0.03 mol/L FeCl3溶液对所述待测样品液进行滴定,至工作液指示反应终点时结束滴定,记录滴定时间,每个植酸钠浓度测定4次,以T1、T2、T3和T4表示。
1.2.4 待测样品液制备及酶活计算
分别称取1.36、2.8、4.1、5.5和6.8 g标准植酸酶(44 000 U/g),溶于10 mL超纯水中,配制系列酶活单位(200、400、600、800和1 000 U/mL)的植酸酶溶液。分别取4 mL不同酶活单位的植酸酶溶液与36 mL乙酸缓冲液(pH 5.5)和80 mL植酸钠溶液(18 mmol/L)混合,反应30 min,向所得体系中加入三氯乙酸-乙酸缓冲液终止酶解反应,得到标准植酸酶待测样品液。同时,分别取4 mL不同发酵时期的植酸酶发酵稀释液与36 mL乙酸缓冲液(pH 5.5)和80 mL植酸钠溶液(18 mmol/L)混合,反应30 min,向所得体系中加入三氯乙酸-乙酸缓冲液终止酶解反应,得到发酵样品待测液。
根据预定的植酸钠消耗的物质的量与滴定时间的线性标准曲线,得到植酸钠消耗的物质的量为Sx。发酵液中植酸酶活性E计算见式(1)。
E=(S0-Sx)d/t
(1)
式中:S0为酶解反应前体系中植酸钠的物质的量,Sx为滴定完成后植酸钠消耗的物质的量,t为酶解反应的时间,d为植酸酶发酵液的稀释倍数。
2 结果
2.1 植酸钠浓度与滴定时间关系探究
在利用FeCl3(0.03 mol/L)滴定不同浓度植酸钠底物(3、6、9、12、15和18 mmol/L)过程中,通过光电检测装置记录光电信号强度随滴定时间变化,结果见图2。由图2(a)~(f)可知:FeCl3与反应池中的植酸钠反应生成白色络合物过程中光电信号强度保持不变,当植酸钠消耗完,稍过量的Fe3+与磺基水杨酸生成紫红色络合物,此时光电信号强度出现明显的拐点,以此显示终点。将植酸钠浓度与突变拐点对应的时间值(17.397 5±0.012 58、28.007 5±0.017 08、38.04±0.036 51、48.992 5±0.022 17、58.007 5±0.030 96和69.015±0.031 09 s)做相关性分析,结果见图2(g),相关数据分析见表1。由图2(g)和表1可知:两者的相关性系数R2=0.999 41,说明植酸钠浓度在3~18 mmol/L范围内滴定突变拐点对应的时间值可以准确反映植酸钠底物浓度,并且为保证后续酶活测定实验中底物过量,所以确定以18 mmol/L植酸钠用于以下酶活测定实验。
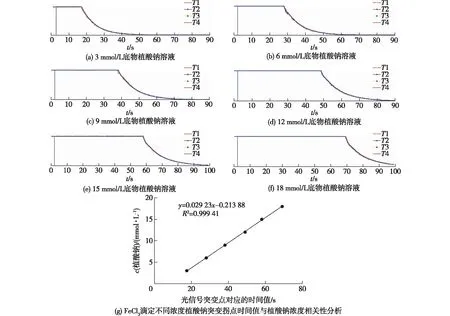
图2 FeCl3滴定不同浓度植酸钠底物过程中光电信号强度随滴定时间变化Fig.2 Changes of photoelectric signal intensity with titration time before and after reaction in the process of FeCl3 titration of sodium phytate with different concentrations
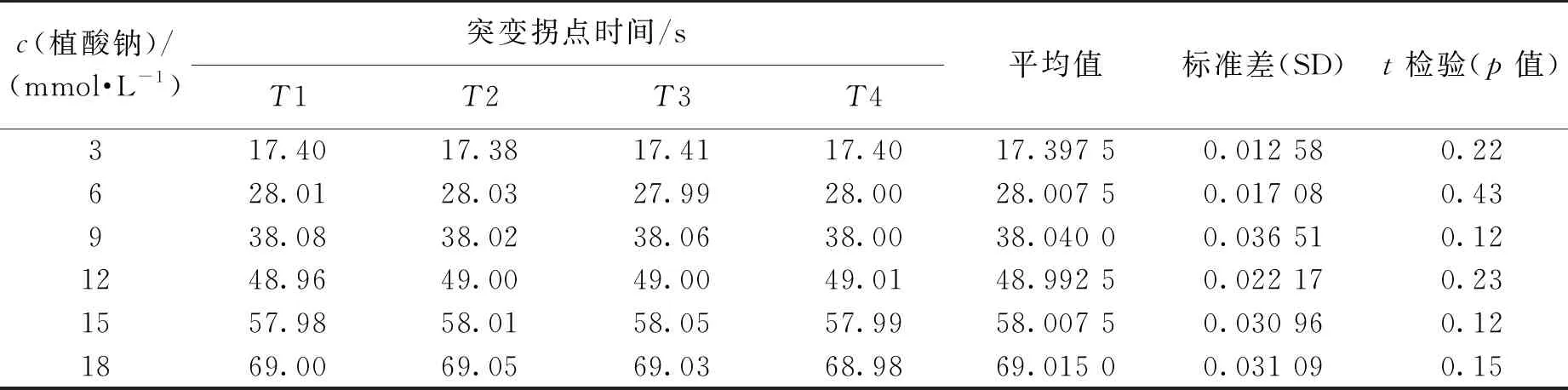
表1 FeCl3滴定不同浓度植酸钠底物过程中光电信号强度突变拐点对应的时间值
2.2 植酸酶酶活与滴定时间关系探究
进一步利用FeCl3滴定不同酶活单位植酸酶标准酶(200、400、600、800和1 000 U/mL)与相同浓度植酸钠底物(18 mmol/L)反应前后光电信号强度随滴定时间的变化结果见图3。由图3可知:FeCl3滴定不同酶活单位的植酸酶标准酶与植酸钠底物反应30 min后的溶液,其光电信号突变拐点时间(33.665±0.456 76、24.72±0.665、22.45±1.095 72、17.987±0.793 7和11.485±0.214 4 s)明显少于FeCl3滴定相对应的灭活不同酶活单位的植酸酶标准酶与植酸钠底物反应30 min后溶液出现的突变拐点时间值(43.305±0.503 09、42.36±0.273 62、43.787 5±0.752 57、43.997 5±0.556 62和42.075±1.087 89 s)(表2),并且随着酶活增加,两者相应突变拐点差值也逐渐增大(9.64、18.188、21.34、26.010和30.59 s)。将FeCl3滴定不同酶活单位标准植酸酶酶解底物前后突变拐点时间差值与酶活单位做相关性分析,两者的相关性系数R2=0.972 8(图3(f)),说明植酸酶酶活在200~1 000 U/mL范围内,滴定突变拐点时间差值可以准确反映植酸酶酶活大小。

图3 FeCl3滴定不同酶活单位植酸酶标准酶与相同浓度植酸钠底物(18 mmol/L)反应前后光电信号强度随滴定时间的变化Fig.3 Changes of photoelectric signal intensity with titration time before and after the reaction of phytase standard enzyme with the same concentration of sodium phytate(18 mmol/L) by FeCl3 titration

表2 FeCl3滴定不同酶活单位植酸酶标准酶与相同浓度植酸钠底物(18 mmol/L)反应前后光电信号强度突变拐点对应的时间值
2.3 国标法和滴定法分别测定发酵液中植酸酶酶活性相关性分析
基于植酸钠浓度与突变拐点时间值标准曲线以及植酸酶酶活大小与突变拐点时间差值标准曲线,笔者利用滴定法测定发酵前期、中期和后期的植酸酶酶活(图4(a0)~4(c1)),结果表明:具有酶活性的植酸酶发酵液与植酸钠的反应液滴定时间(31.78±0.15、29.22±0.30和24.15±0.25 s)明显少于相应的灭活植酸酶发酵液与植酸钠的反应液滴定时间(45.28±0.089、45.52±0.33和44.14±0.23 s)(表3),并且随着植酸酶发酵液发酵时间的延长,两者的滴定时间差值越大(13.5、16.3和19.99 s),由此说明随着发酵时间延长,植酸酶逐渐积累。
同时,我们也利用国标法对发酵前期、中期和后期的植酸酶酶活性进行了测定,将滴定法计算所得的植酸酶酶活与国标法测得的酶活做准确性对比(图4(d)),结果显示:两者呈线性相关,并且相关性系数R2=0.997 3,说明滴定法测得的酶活大小与国标法测定结果相一致。而且利用凝胶电泳对发酵前期、中期和后期的植酸酶发酵液检测结果(图4(e))也同样验证了植酸酶随着发酵时间的延长逐渐积累。
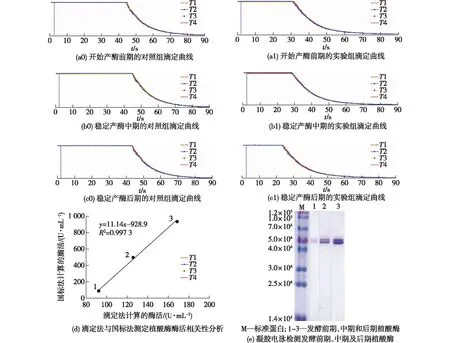
图4 FeCl3滴定不同发酵时期产生的植酸酶与相同浓度植酸钠底物(18 mmol/L)反应前后光电信号强度随滴定时间的变化Fig.4 Changes of photoelectric signal intensity with titration time before and after the reaction of phytase produced in different fermentation periods with the same concentration of sodium phytate substrate(18 mmol/L) by FeCl3 titration
3 讨论
植酸酶是一类酶的总称,其酶活一直很难进行准确测定[14],本研究中,笔者建立的滴定法是对植酸酶活性测定方法的进一步开发和应用。此方法与其他方法相比,对设备要求不高、操作简单,实验所用的滴定液(FeCl3和磺基水杨酸)配制简单、成本低,而且植酸酶发酵样品无需经过透析除背景无机磷操作,酶活测定更加省时、省力(表4)。
赵凯等[15]通过对工业规模产植酸酶的毕赤酵母发酵条件优化,可以使植酸酶酶活在发酵初期(甲醇诱导12 h)达到963 U/mL,发酵末期最高可达21 666 U/mL,本研究建立的滴定法在200~1 000 U/mL酶活范围内可以实现植酸酶活性的准确测定,因此发酵液最高仅需稀释二十几倍即可达到准确测定范围,避免引入过大的测量误差,在大规模植酸酶工业发酵样品的简便、快速测定中具有重要的应用价值。
4 结论
基于滴定法原理,通过光电信号变化计算植酸酶底物变化量,进而推算出植酸酶酶活大小,滴定法与国标法测得的植酸酶酶活具有很好的相关性,且滴定法可以避免发酵液中磷的干扰,无需长时间的样品透析预处理,减少发酵液样品颜色及浑浊造成的终点判断误差,可以更加准确地测定植酸酶酶活。由此可见,笔者研制的植酸酶酶活测定仪在大规模植酸酶生产企业中将为植酸酶酶活测定节省大量人力、物力和财力。

表3 FeCl3滴定不同发酵时期产生的植酸酶与相同浓度植酸钠底物(18 mmol/L)反应前后光电信号强度突变拐点对应的时间值

表4 滴定法与其他植酸酶测定方法的比较
