3种雌雄异熟樟科植物开花动态的比较研究
2021-04-02金晓芳肖昌龙张杰赵姣肖祖飞张海燕金志农
金晓芳,肖昌龙,张杰,赵姣,肖祖飞,张海燕,金志农
3种雌雄异熟樟科植物开花动态的比较研究
金晓芳,肖昌龙,张杰,赵姣,肖祖飞,张海燕,金志农*
(南昌工程学院水利与生态工程学院, 江西省樟树繁育与开发利用工程研究中心,南昌 330099)
为了解樟科植物雌雄异熟的繁育系统特点,对3种樟科植物阴香()、紫楠()和浙江楠()雌雄异熟花的开花动态进行了比较研究。结果表明,3种植物雌性功能期的开始时间、雌性功能期和雄性功能期的时间分配有差异。3种植物的主要传粉者均为中华蜜蜂,在雌性功能期和雄性功能期均有访花;在雌性功能期第四轮退化雄蕊蜜腺和雄性功能期第三轮花丝基部的蜜腺分泌花蜜,不同开花阶段的花蜜蜜量和含糖量没有显著差异;柱头可授性和花粉活力在雌性和雄性功能期均较高;雌性功能期和雄性功能期均有自然花粉落置;座果率均是异交补粉>自然>套袋,表明都存在一定的传粉限制。因此,樟科植物雌、雄性阶段时间分配的不同,可能与退化雄蕊蜜腺和第三轮雄蕊附属蜜腺的分泌节律有关。
阴香; 紫楠; 浙江楠; 雌雄异熟; 开花; 蜜腺; 退化雄蕊
樟科(Lauraceae)植物主要分布于热带及亚热带地区[1–2],具有重要的生态和经济价值[3–4],如制药、木材、香料、水果和香水等[5]。由于大量资源的掠夺式开发,我国分布的445种樟科植物中有109种被中国物种红色名录收录[5–7]。自然条件下樟科植物主要靠种子繁殖[5],因此研究樟科植物的繁殖生态学,对樟科资源的可持续开发利用有重要意义。
开花方式是影响植物繁殖成功的重要因素[8],雌雄异熟中雌性先熟的开花方式广泛存在于樟科植物中[9–13]。樟科植物在雌性功能期和雄性功能期的持续时间、同株开花同步性、异株开花同步性等都有很大差异[9,11,14]。本文选取3种樟科植物, 樟属的阴香()和楠属的紫楠()与浙江楠()为试验材料,观察3种植物在同一移栽环境下的开花和传粉动态,并检测不同开花阶段的柱头可授性、花粉活力、柱头花粉落置、花蜜量和含糖量,统计自交、异交、自然和套袋的座果情况,以探究3种樟科植物的雌雄异熟开花过程的传粉、柱头花粉活性和花蜜的动态变化对其繁殖成功的影响。
1 材料和方法
1.1 材料
试验材料来源于中国科学院武汉植物园,3种樟科植物作为行道树和景观树分散栽种于植物园内,植株数量均超过20株。阴香()、紫楠()和浙江楠()均具有典型的樟科花部结构[5](图1),即花基数为3,花被片共6枚分两轮,每轮3枚,两轮花被片交替排列(图1: A, B);花药12枚,能育雄蕊9枚(图1: C~E),四药室,外面2轮雄蕊花药朝内交替排列(第1轮花药靠近第1轮花被片,第2轮花药靠近第2轮花被片),第3轮雄蕊药室开口朝外对准第1轮花药并且花丝基部有2个蜜腺(图1: E), 蜜腺分泌面也向外(图2: F),第4轮雄蕊与第2轮雄蕊平行并退化成蜜腺(图1: F)且分泌面朝内(图2: E),雌蕊柱头可授面朝向一边(图1: G), 胚珠1枚。
1.2 方法
开花动态观察 于2019年4月中下旬于3种樟科植物的盛花期开展试验,每种植物选取健康良好,枝条较矮的植株,标记1个大枝条进行开花动态跟踪调查。由于阴雨天会推迟花期,选择连续3个晴天进行观察,阴香为4月15-17日,紫楠为4月18-20日,浙江楠为4月23-25日。用数码相机Canon EOS 6D Mark II对典型花部拍照。每天从8:00- 18:00 (阴香和浙江楠)或8:00-19:00(紫楠),每0.5 h统计1次。根据花瓣打开角度(0°~30°为闭合、30°~ 100°为半开、大于100°为全开)和花药散粉情况(散粉和未散粉)划分不同阶段:雄性功能期初开(简写成M1, 下同)、雄性功能期全开(M2)、雄性功能期半闭(M3)、雌性功能期半开(F1)、雌性功能期全开(F2)和雌性功能期半闭(F3),统计花朵数,由于雄性功能期全闭和雌性功能期全闭的花无法区分不进行统计。浙江楠的雌性功能期有2次,且均经历3个阶段,因此将第1、2次雌性功能期分别记为F1、F2、F3和F4、F5、F6。由于花数量较多,用计数器辅助计数。
访花频率统计 开花状态统计后进行10 min的传粉观察。试验过程中3种植物的主要传粉者均为中华蜜蜂(图2: C, G, K),因此只关注中华蜜蜂的访花情况,记录被访花类型和访花量。传粉频率为单花在1 h内被访次数,即花序内被访花朵总数×6/花序总花朵数。
本研究中的3种樟科植物均是雌性先熟,这在樟科植物中是普遍现象[11–13,17],但雌性功能期开始的时间不同,阴香为12:00-13:00,紫楠为15:00-16:00,浙江楠则比较特殊,单花期的第1天12:00-13:00经历短暂的雌性功能期之后花瓣马上闭合, 第二天8:00-9:00花再次打开呈雌性功能状态。
3种樟科植物的花序开花数量呈逐渐下降的趋势(图4),阴香和紫楠前1天开的雌性花稍少于第2天开的雄性花,而浙江楠正好相反。
在长径比不变(λ=8)的条件下,泊松比从0.1到0.5;摩擦系数从0.1到0.5;计算得到相对压强随泊松比和摩擦系数的变化曲面如图5所示。
采用SPSS 22.0统计软件对数据进行统计和分析,自交和异交座果率用卡方检验(Chi-square test),其他数据采用单因素方差分析(One-Way ANOVA),数据采用平均值±标准误表示。

图1 阴香的花部结构。A: 第1轮花被片; B: 第2轮花被片; C: 第1轮雄蕊; D: 第2轮雄蕊; E: 第3轮雄蕊, 花丝基部有1对腺体; F: 第4轮退化雄蕊; G: 雌蕊。
目前长江上游还有大批控制性水库正在建设或者将要建设,如果不科学地安排统一蓄水方案,必然会对长江中下游地区甚至全流域的用水、发电和航运等兴利目标产生严重的影响,也将影响流域防洪、抗旱、应急水污染事故处理和生态等公益性调度能力的提高。
1.3 统计分析
自然花粉落置和自花授粉试验 在阴香和紫楠M1、M2、M3、F1、F2、F3及浙江楠M1、M2、M3、F2、F4、F5、F6阶段随机选取6朵花,用FAA固定,检测柱头自然花粉落置。预先套袋若干花序,待其进入雄性阶段后,进行自花授粉(=5)。授粉过程中,将散粉花药轻轻触碰柱头,使花粉充分落置到柱头上[16]。授粉完成后,立即将套袋重新套上,直至18:00点,将整朵花取下并用FAA固定,用于检测花粉管萌发情况。花粉管萌发实验具体操作步骤:蒸馏水漂洗8 min,置于2% NaOH溶液中60℃水浴加热8 min,将雌蕊剥出置于滴有少量醋酸的蒸馏水中漂洗5 min,用3%过氧化氢透明10 min,蒸馏水漂洗5 min后,将雌蕊置于载玻片上,吸去多余水分,滴入1~2滴0.01%苯胺蓝溶液, 染色8 min,压片,荧光显微镜(E-600; Nikon)下统计柱头花粉落置及花粉管萌发情况。

图2 樟科植物的雌性功能期(A, E, I)、雄性功能期(B, F, J)、中华蜜蜂访花(C, G, K)和自交花粉管萌发(D, H, L)。A~D: 阴香; E~H: 紫楠; I~L: 浙江楠; *: 第4轮退化雄蕊蜜腺; ☆: 第3轮雄蕊花丝基部的3对蜜腺。
2 结果和分析
2.1 开花动态变化
3种樟科植物雌性功能期开始的时间有差异(图3)。雌(雄)性功能期均为从雌(雄)性花瓣打开到雌(雄)性花瓣闭合,阴香第1天下午12:00-18:00为雌性功能期,第2天上午8:00-12:30为雄性功能期;紫楠第1天下午14:30-19:00为雌性功能期, 第二天上午8:00-15:00为雄性功能期;而浙江楠雌性功能期有2次:第1次为第1天上午12:00-13:00, 第2次为第2天上午8:00-12:15,雄性功能期在第2天下午12:00-18:00。
花蜜蜜量和含糖量测量 阴香和紫楠在M1、M2、M3、F1、F2、F3,浙江楠在M1、M2、M3、F2、F4、F5、F6阶段,用0.1 mm内径毛细管吸取花蜜,游标卡尺测量长度,计算花蜜量;用手持式折光仪检测花蜜糖度(Eclipse 45-81)。用于检测的花提前1 d套袋,蜜量检测6朵花,含糖量测定是取10~20朵花的混合花蜜。
2.2 传粉昆虫观察
中华蜜蜂对阴香、紫楠和浙江楠的平均访花频率分别为2.204±0.289、2.700±0.266和2.195±0.300 (=60)(图5), 3种植物间没有显著差异(2, 59=1.063,=0.352)。中华蜜蜂对每种植物在3 d内的平均访花频率均无显著差异(阴香2, 57=0.198,=0.821;紫楠2, 57=0.309,=0.735; 浙江楠2, 59=0.315,= 0.731)。中华蜜蜂对阴香雄性功能期的平均访花频率为1.620±0.221 (=24)、雌雄交换期为1.422±0.643 (=6)、雌性功能期为2.828±0.258 (=30), 3个时期的差异显著(2, 57=6.888,=0.002);紫楠雌性功能期为2.933±0.249 (=39)、雌雄交换期为1.730±0.106 (=3)、雄性功能期为2.443±0.206 (=24), 3个时期的差异不显著(2, 63=1.780,=0.177);浙江楠雄性功能期为1.379±0.214 (=24)、雌雄交换期为2.336± 0.176 (=6)、雌性功能期为2.821±0.251 (=30), 3个时期的差异显著(2, 57=9.767,<0.001)。
2.3 柱头可授性和花粉活力
例1:“I hope that he will be a successful president for all Americans.”(Hillary Clinton,2016)
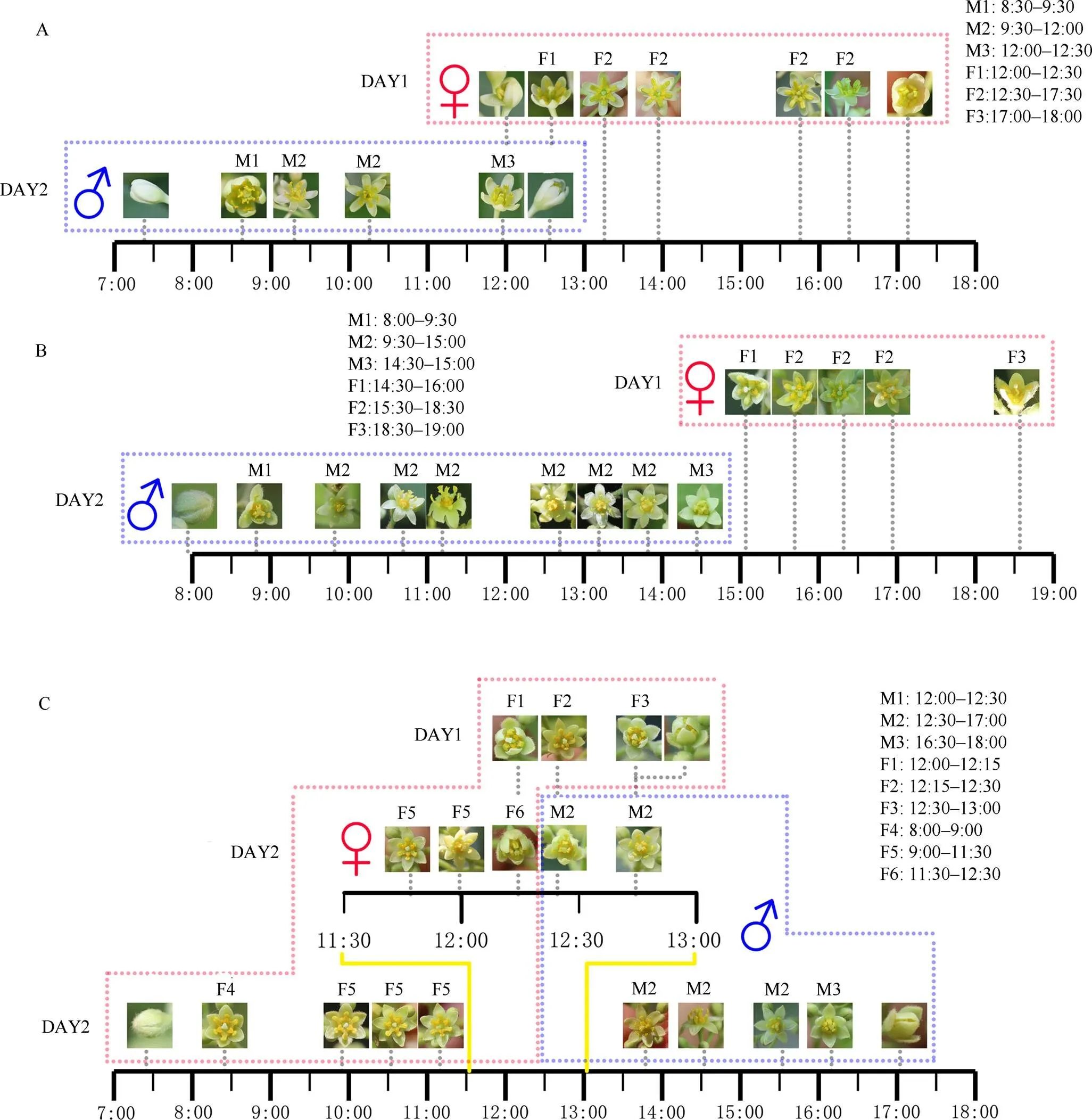
图3 阴香(A)、紫楠(B)和浙江楠(C)的开花动态变化
2.4 蜜量和含糖量
3种樟科植物雌性功能期退化雄蕊蜜腺分泌花蜜时,雄蕊蜜腺的表面是干燥的;雄性功能期雄蕊蜜腺分泌花蜜时,退化雄蕊蜜腺变干。单因素方差分析表明,3种植物不同开花期分泌的蜜量无显著差异,分别是阴香(5, 30=0.743,=0.597)、紫楠(5, 30= 0.942,=0.468)、浙江楠(6, 36=0.783,=0.589)。但3种植物间分泌的蜜量差异显著(2, 16=14.019,=0.001), 3种樟科植物花蜜的含糖量间差异不显著(2, 16=0.036,=0.965)。
2.5 自然花粉落置和自花授粉花粉管萌发
单因素方差分析表明,紫楠和浙江楠不同开花期的自然花粉落置差异显著(5, 30=8.040,<0.001;6, 36=3.765,=0.005);而阴香的差异不显著(5, 30= 2.06,=0.098)。3种植物间的自然花粉落置差异显著(2, 111=5.708,=0.004)。3种樟科植物自花授粉后花粉均可以萌发(图2: D, H, L)。

图4 阴香(A)、紫楠(B)和浙江楠(C)的开花数

图5 中华蜜蜂的访花频率
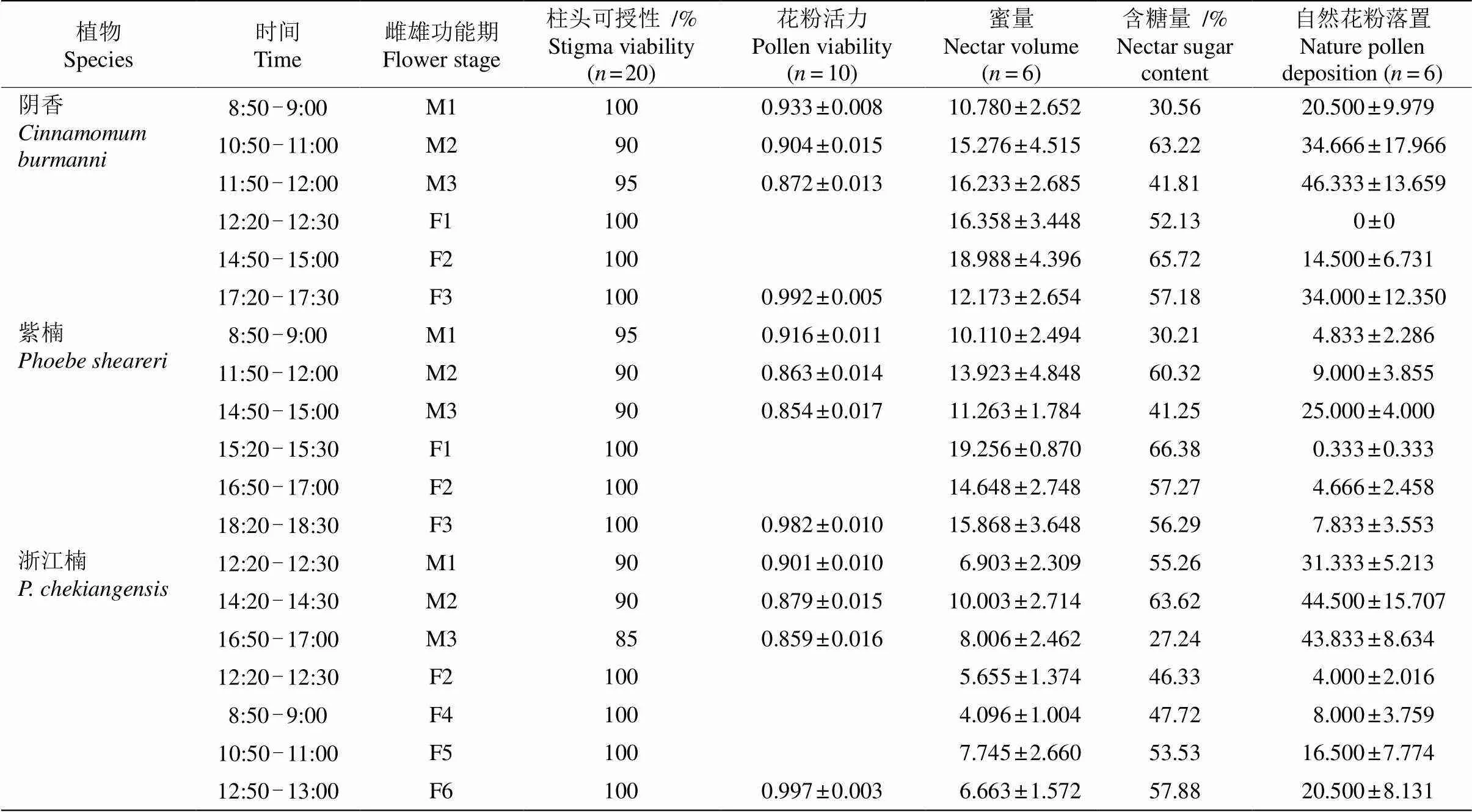
表1 樟科植物的柱头可授性、花粉活力、蜜量和含糖量、自然花粉落置
2.6 座果率
阴香的自然坐果率和套袋坐果率分别为(53.9± 6.5)%和(9.4±3.2)% (=9),差异显著(1,16=37.492,<0.001),自交座果率(23.5%,=17)与异交座果率(69.6%,=23)差异显著(=0.004);紫楠的自然坐果率(6.8±8)% (=0.8)与套袋坐果率(2.1±0.7)% (= 6)的差异显著(1, 12=15.851,=0.002),自交座果率(0%,=21)与异交座果率(20%,=20)的差异显著(=0.031);浙江楠的自然坐果率[(13.6±1.9)%,= 10]与套袋坐果率[(2.8±0.6)%,=10]的差异显著(1,18=29.224,<0.001),自交座果率(4.5%,=22)与异交座果率(16.7%,=18)的差异不显著(= 0.204)。
3 结论和讨论
阴香、紫楠和浙江楠开花时雌雄异熟的时间呈现多样性,但是在花蜜分泌、柱头可授性、花粉活力、花粉落置和座果率上又呈现出相似性。
座果率 设置4种处理,自然对照(自然状态下的10个花序)、套袋不授粉(10个花序套袋)、自交补粉(用红色细线标记20朵套袋后新开的花,M2期进行自花授粉,继续套袋)、异交补粉(用红色细线标记20朵套袋后新开的花,M1期进行异株异花授粉,继续套袋)。授粉过程未去雄,因为去雄很容易破坏花结构,造成花部褐化,提前凋谢。
3种樟科植物的柱头可授性在整个雌性功能期都有活性,甚至雄性功能期也具有较高活性(表1)。花粉活力在整个花期均高于85%。单因素方差分析表明,3种植物不同开花期的花粉活力有显著差异, 分别为阴香(3, 36=21.61,<0.001)、紫楠(3, 36= 19.394,<0.001)、浙江楠(3, 36=25.998,<0.001)。
3.1 开花动态的比较
柱头可授性和花粉活力测定 采集阴香和紫楠的M1、M2、M3、F3及浙江楠的M1、M2、M3、F6阶段10朵花的花粉,阴香和紫楠M1、M2、M3、F1、F2、F3及浙江楠M1、M2、M3、F2、F4、F5、F6阶段20朵花的柱头,采用MTT法检测柱头可授性和花粉活力[15]。用于检测的花提前1 d套袋。
郑馨被蒋大伟押着来到一家楼道口。郑馨还想转身,蒋大伟拦住她:别走,难道你想让我绑着你不成?郑馨无奈,悻悻地上了楼,走到一家门前,蒋大伟刚想要敲门,门里突然传来一声猛烈的撞击声!只听房间里一个女人的声音:有本事她永远别回来!接着是一个男人低低的声音:你冷静点!蒋大伟清了清嗓子,开始敲门,门开了,郑母探出头:敲什么敲?家里人还没死光!她看到蒋大伟和郑馨,愣住了!郑父紧随着走到门口:馨馨,你回来了?郑馨胆怯地藏到蒋大伟身后,低声地:爸。郑母发火地:你瞧瞧!你瞧瞧!我到你们郑家八年了,还讨不出她叫一声妈!养条狗还摇摇尾巴呢!没等郑母说完,郑馨突然转身朝楼下跑去。
除去花瓣闭合时间,阴香的雄性功能期(包括花瓣半开、全开和半闭的时间,下同)约3.5 h,雌性功能期约6 h;紫楠的雄性功能期约6.5 h,雌性功能期约4.5 h;浙江楠的雄性功能期约6 h,雌性功能期约5 h。说明3种樟科植物在雌性功能时间和雄性功能时间的分配上差别很大,阴香侧重于雌性功能,紫楠侧重于雄性功能,浙江楠则相对比较均衡。这种雌雄功能期时间的差异明显在樟科是非常普遍的现象,Alcaraz等[16]报道具有2种类型的雌雄异熟,上午雌性功能型的雌性功能期为4 h,雄性功能期也大约4 h;上午雄性功能型的雌性功能期约为3 h,雄性功能期约6 h。
本研究中阴香、紫楠和浙江楠植株开花同步,居群内个体间开花时间也表现一致。而黄向荣报道[14]黄绒润楠()全株开花不同步,不同植株的开花方式无差异;而柳叶润楠()有2种开花类型,即上午雌性功能型和下午雌性功能型,但同株开花同步。柳叶润楠的这种异型雌雄异熟的开花方式在[16]和鳄梨()[10,18]中也有报道。
3.2 开花动态与蜜腺分泌花蜜间的关系
阴香、紫楠和浙江楠在雌性功能期和雄性功能期均有花蜜分泌,花蜜分泌规律同其他樟科植物一样[11]:雌性功能阶段,雄蕊向外弯曲,基本上平躺在花被片上,药室还未打开,这个阶段退化雄蕊蜜腺分泌花蜜(图2: A, E, I);雌性阶段过后花瓣暂时闭合,当花瓣再次打开,花药已开始散粉进入雄性功能期,第三轮雄蕊已呈直立状态,花丝紧贴胚珠,花药稍微向外弯曲,药室裂瓣开始打开,裂瓣外卷,通常所有花粉都附在药室裂瓣上;雄性阶段雄蕊蜜腺分泌花蜜(图2: B, F, J),而退化雄蕊蜜腺变干, 藏在花柱和第三轮雄蕊之间。
Rohwer报道樟科植物雄蕊和退化雄蕊蜜腺都只分泌1次花蜜[11],这与[19]的花蜜分泌机制一致,表现为腺体表面没有任何撕裂的口子,而是上表皮细胞破裂排出粘稠的蜜液到腺体表面。Rohwer认为这种单次使用的蜜腺可能是大多数樟科两性花为什么一定要有第四轮雄蕊退化并且变成蜜腺的原因[11]。对两性花而言,初始的雌性阶段需要退化雄蕊蜜腺分泌花蜜,随后雄性功能阶段需要第三轮雄蕊基部的蜜腺分泌花蜜。而对于单性花,只需执行单一的雌性功能或者雄性功能,所以仅由第三轮雄蕊基部的蜜腺分泌花蜜就可满足花蜜作为报酬来源的功能。因此樟科雌雄异株植物大部分雄花第三轮雄蕊有蜜腺, 雌花退化雄蕊没有变成蜜腺[5]。樟科最有可能的姐妹群莲叶桐科(Hernandiaceae)的雌雄异株植物雄花虽然有雄蕊附属结构, 但是不分泌花蜜;雌花有蜜腺,可能是退化雄蕊形成的[20]。因此推测莲叶桐科和樟科雌雄异株的祖先已经具备雌性先熟的开花机制,并且分别选择了不同的花蜜产生机制,莲叶桐科丢失花药附属物的花蜜分泌功能,而樟科则是最内层退化雄蕊丢失分泌功能[11]。
按照实验方法测定4个V-4Cr-4Ti合金样品中Al、As、Co、Cu、Fe、Mg、Mn、Ni、P、K、Na,进行精密度试验,结果见表3。
本实验确定了超声波辅助提取红枸杞多糖的最佳工艺条件为:料液比为1∶50、超声温度:60℃、萃取时间3min、超声次数:1,在此条件下红枸杞多糖的提取率为5.12%。
3.3 开花动态与传粉频率间的关系
樟科植物中涉及传粉观察的研究主要集中在热带水果鳄梨上[21–22],其传粉者种类较多[23],但主要的传粉昆虫是意大利蜂[24–25]。本研究中阴香、紫楠和浙江楠的主要传粉者是中华蜜蜂,3种植物的传粉频率没有显著差异。但是在一天中,3种植物的传粉频率都有明显的变化,阴香在12:00出现无传粉者现象,因为这个时间点雄性功能期花基本闭合而雌性功能期花还未打开。浙江楠在17:50后所有花就全部闭合,没有访花者;而此时阴香和紫楠的花才开始部分闭合,尤其是紫楠花闭合的时间最晚。还观察到即使花瓣已经半闭,中华蜜蜂还在用嘴巴撬开花瓣吸取花蜜,因为此时花蜜量和含糖量仍较高。
3种樟科植物均为中华蜜蜂传粉,因此若要培养种子,需要种植地有一定规模的中华蜜蜂或意大利蜂,而且当地同时开花的植物不会因为竞争影响访樟科植物的蜜蜂数量。
生态功能下的农村土地规划是在农村基本分类及生态网络的基础上进行的,对其土地生态现状进行评价,最终制定出生态敏感区分类,按照不同的分类制定相应的土地规划模式。有学者将生态压力指数(ETI)作为划分标准,并将ETI>1.0的区域归为生态低敏感区,将0.5
3.4 开花动态与座果率间的关系
自然条件下,座果率会受到很多因素的影响,一个很重要的影响因素是花粉落置,特别是异交花粉[26]。Davenport报道上午雌性功能型鳄梨在雌性功能期小于2%的花有花粉落置,而雄性功能期的花粉落置约为雌性功能期的15倍,且主要是同花自交花粉[27]。Borrone用微卫星标记方法检测上午雌性功能型鳄梨植株的异交率为74%,而雄性功能型植株达到96%[18]。这可能与樟科植物的胚珠数只有1个有关,仅需要一个花粉粒就能使胚珠受精。但是到达胚珠的花粉管的比例与落置到柱头的花粉总数呈正相关关系,这种现象被称为群体效应,广泛存在于被子植物中[28–29]。本研究中,阴香、紫楠和浙江楠柱头可授性和花粉活力在整个开花期都比较高,自交均可萌发花粉管,但是存在一定的自交衰退。总体而言,樟科植物的坐果率普遍较低,可能和落花和落果现象比较严重有关。
[1] ROHWER J G. Lauraceae [M]// KUBITZKI K, ROHWER J G, BITTRICH V. The Families and Genera of Vascular Plants. Berlin: Springer, 1993: 366–391.
[2] CHANDERBALI A S, VAN DER WERFF H, RENNER S S. Phylo- geny and historical biogeography of Lauraceae: Evidence from the chloroplast and nuclear genomes [J]. Ann Mo Bot Gard, 2001, 88(1): 104–134. doi: 10.2307/2666133.
[3] VAN DER WERFF H, RICHTER H G. Toward an improved classifi- cation of Lauraceae [J]. Ann Mo Bot Gard, 1996, 83(3): 409–418. doi: 10.2307/2399870.
[4] HUANG X D, LIU J Q. Chemical composition and antibacterial activities of the essential oil from the leaves of[J]. J Trop Subtrop Bot, 2004, 12(3):233–236. doi: 10.3969/j.issn.1005-3395. 2004.03.007.黄晓冬, 刘剑秋. 赤楠叶精油的化学成分及其抗菌活性 [J]. 热带亚热带植物学报, 2004, 12(3):233–236. doi: 10.3969/j.issn.1005-3395. 2004.03.007.
[5] LI H W, LI J, HUANG P H, et al. Lauraceae, Calycanthaceae- Schisandraceae [M]// Flora of China, Vol. 7. Beijing: Science Press & St. Louis: Missouri Botanical Garden Press, 2008: 102–254.
[6] YANG Y, LIU B. Species catalogue of Lauraceae in China: Problems and perspectives [J]. Biodiv Sci, 2015, 23(2): 232–236. doi: 10.17520/biods.2015027.杨永, 刘冰. 中国樟科物种编目: 问题和展望 [J]. 生物多样性, 2015, 23(2): 232–236. doi: 10.17520/biods.2015027.
[7] WANG S, XIE Y. China Species Red List [M]. Beijing: Higher Education Press, 2004: 1–405. 汪松, 解焱. 中国物种红色名录 [M]. 北京: 高等教育出版社, 2004: 1–405.
[8] O’NEIL P. Selection on flowering time: An adaptive fitness surface for nonexistent character combinations [J]. Ecology, 1999, 80(3): 806–820. doi: 10.1890/0012-9658(1999)080[0806:SOFTAA]2.0.CO;2.
[9] KUBITZKI K, KURZ H. Synchronized dichogamy and dioecy in Neotropical[J]. Plant Syst Evol, 1984, 147(3/4): 253–266.
[10] STOUT A. A study in cross-pollination of avocados in southern California [J]. Calif Avocado Assoc Ann Rep, 1923, 7: 29–45.
[11] ROHWER J G. The timing of nectar secretion in staminal and staminodial glands in Lauraceae [J]. Plant Biol, 2009, 11(3): 490–492. doi:10.1111/j.1438-8677.2008.00184.x.
[12] WATANABE S, NOMA N, NISHIDA T. Flowering phenology and mating success of the heterodichogamous treeSieb. et Zucc (Lauraceae) [J]. Plant Spec Biol, 2016, 31(1): 29–37. doi:10.1111/1442-1984.12078.
[13] DE SOUZA L A, MOSCHETA I S. Morphology, anatomy and floral biology of(Spreng.) Mez (Lauraceae) [J]. Acta Bot Bras, 2000, 14(1): 15–25.
[14] HUANG X R. Pollination biology of two species in(Laura- ceae) [D]. Guangzhou: South China Normal University, 2010: 1–63. 黄向荣. 润楠属两种植物的传粉生物学研究[D]. 广州: 华南师范大学, 2010: 1–63.
[15] DAFNI A. Pollination Ecology: A Practical Approach [M]. Oxford: Oxford University Press, 1992: 1–57.
[16] ALCARAZ M L, HORMAZA J I. Optimization of controlled polli- nation in avocado (Mill., Lauraceae) [J]. Sci Hort, 2014, 180: 79–85. doi:10.1016/j.scienta.2014.10.022.
[17] LIU S J, YANG A H, ZHOU H, et al. Floral traits and pollination biology of(Lauraceae) [J]. J Anhui Agric Sci, 2019, 47(1): 111–114. doi:10.3969/j.issn.0517-6611.2019.01.034.刘淑娟, 杨爱红, 周华, 等. 樟树的开花特性及传粉生物学研究 [J]. 安徽农业科学, 2019, 47(1): 111–114. doi:10.3969/j.issn.0517-6611.2019.01.034.
[18] BORRONE J W, OLANO C T, KUHN D N, et al. Outcrossing in Florida avocados as measured using microsatellite markers [J]. J Amer Soc Hortic Sci, 2008, 133(2): 255–261. doi: 10.21273/JASHS.133.2. 255.
[19] KASAPLIGIL B. Morphological and ontogenetic studies ofNutt. andL. [J]. Univ Calif Publs Bot, 1951, 25: 115–240.
[20] ENDRESS P K, LORENCE D H. Heterodichogamy of a novel type in(Hernandiaceae) and its structural basis [J]. Int J Plant Sci, 2004, 165(5): 753–763. doi:10.1086/422049.
[21] ISH-AM G, LAHAV E. Evidence for a major role of honeybees () rather than wind during avocado (Mill.) pollination [J]. J Hort Sci Biotechnol, 2011, 86(6): 589–594. doi: 10. 1080/14620316.2011.11512808.
[22] DAG A, FETSCHER A E, AFIK O, et al. Honey bee () strains differ in avocado () nectar foraging preference [J]. Apidologie, 2003, 34(3): 299–309. doi:10.1051/apido:2003022.
[23] PÉREZ-BALAM J, QUEZADA-EUÁN J J G, ALFARO-BATES R, et al. The contribution of honey bees, flies and wasps to avocado () pollination in southern Mexico [J]. J Pollinat Ecol, 2012, 8(6): 42–47. doi:10.26786/1920-7603(2012)6.
[24] PEÑA J F, CARABALI A. Effect of honey bee (L.) density on pollination and fruit set of avocado (Mill.) cv. Hass [J]. J Apic Sci, 2018, 62(1): 5–14. doi:10.2478/jas-2018-0001.
[25] READ S F J, HOWLETT B G, JESSON L K, et al. Insect visitors to avocado flowers in the Bay of Plenty, New Zealand [J]. New Zeal Plant Prot, 2017, 70: 38–44. doi:10.30843/nzpp.2017.70.25.
[26] ARMSTRONG J E, IRVINE A K. Flowering, sex ratios, pollen-ovule ratios, fruit set, and reproductive effort of a dioecious tree,(Myristicaceae), in two different rain forest communities [J]. Amer J Bot, 1989, 76(1): 74–85. doi:10.1002/j.1537-2197.1989.tb11287.x.
[27] DAVENPORT T L. Pollen deposition on avocado stigmas in southern florida [J]. Hortscience, 1989, 24(5): 844–845.
[28] SHOVAL S. Pollination rate and pollen tube growth of avocado in relation toyield [D]. Rehovot, Israel: The Hebrew University of Jerusalem, 1987: 1–161.
[29] CRUDEN R W. Pollen grains: Why so many? [J]. Plant Syst Evol, 2000, 222(1/2/3/4): 143–165. doi: 10.1007/BF00984100.
Comparison Study of Flowering Process in Three Dichogamous Lauraceae Species
JIN Xiao-fang, XIAO Chang-long, ZHANG Jie, ZHAO Jiao, XIAO Zu-fei, ZHANG Hai-yan, JIN Zhi-nong*
(Jiangxi Province Camphor Tree Breeding and Development and Utilization Engineering Research Center, College of Water Conservancy and Ecological Engineering, Nanchang Institute of Technology, Nanchang 330099, China)
In order to understand the characteristics of breeding system of dichogamous Lauraceae plants, the flowering dynamics of hermaphrodite of,andwere compared. The phases of floral phenology and insect pollinators were observed. Stigma and pollen viability, nectar volume, nectar sugar concentration and natural pollen deposition were measured. Fruit setting were checked with different methods. The results showed that the start time and duration of female and male functional stages were different among three species.was the main pollinator at both of female and male functional stages. The nectary in the 4thround staminodia at female functional stage secreted nectar, while that in the 3rdround of filament base secreted nectar in male functional stage. Nectar volume and nectar sugar concentration had no significant difference at different flowering stages. Stigma receptivity and pollen viability were higher in both male and female functional stages, there was natural pollen deposition during the whole flowering stages. Fruit setting of three species was in the order of outcrossing and pollination>natural pollination>bagging, indicating that there were certain pollination restrictions. Therefore, it was suggested that the difference of time distribution between male and female stages in Lauraceae might be related to the secretion rhythm of nectary in staminodia and the third round stamen.
;;; Dichogamy; Flowering; Nectary; Staminode
10.11926/jtsb.4266
2020–06–15
2020–07–27
江西省教育厅科学技术研究项目(GJJ151104); 江西省科技厅重点研发计划(20181ACF60002)资助
This work was supported by Project for Science and Technology of Education Department of Jiangxi Province (Grant No.GJJ151104), and the Planning Project for Key Research and Development of Jiangxi Science and Technology Department (Grant No. 20181ACF60002).
. E-mail: camphor.tree@qq.com
