磺胺二甲基嘧啶与环丙沙星对小麦种子萌发和幼苗生长的影响
2021-03-23张天莹余彬彬林文轩戴博安钱晓晴
张天莹,余彬彬,2,3*,林文轩,戴博安,钱晓晴
(1.扬州大学环境科学与工程学院,扬州 225127;2.南开大学环境污染过程与基准教育部重点实验室,天津 300071;3.农业农村部产地环境污染防控重点实验室/天津市农业环境与农产品安全重点实验室,天津 300071)
我国每年抗生素使用量约为16.2 万t,约占全世界用量的一半,其中52%为兽用[1],进入动物体内的抗生素有60%~90%以原药或初级代谢产物的形式通过排泄物释放到环境中[2]。据报道,2018 年我国仅作为饲料添加的抗生素高达10万t以上,每年输入土壤中的抗生素数量不亚于农药[3]。抗生素长期添加到动物饲料中,最后随动物粪便排出[4],这些畜禽粪便直接施入或者转化为有机肥施入土壤,有报道显示上海地区黄浦江上游土壤中磺胺类抗生素含量为5.85~33.37 mg·kg-1[5]。
喹诺酮类和磺胺类抗生素因广谱性和高效抗菌性被广泛应用,目前在国内地表水以及土壤中已有检出[6]。农田土壤中检测出抗生素含量为µg·kg-1~g·kg-1水平[7]。邰义萍等[8]发现广东某养殖场猪粪中磺胺类药物总含量在1.93~13.40 mg·kg-1之间,平均含量为4.40 mg·kg-1。环丙沙星(CIP)是喹诺酮类抗生素中使用量最大的一种,有研究表明施用沼肥后土壤中CIP 残留量高达9.66 mg·kg-1[9]。这些抗生素进入环境后容易造成地表水以及土壤污染,甚至蓄积在植物体内影响植物的生长。
小麦在我国是重要的粮食作物,为促进其生长发育在生产过程中常常施入有机肥,已有研究表明沼液替代化肥能够提高小麦生物量[10]。但是沼液中所含的抗生素会在一定程度上影响小麦的生长和生产安全。鲍艳宇等[11]研究表明,四环素类抗生素会影响小麦种子萌发。郑曦等[12]发现盐酸左氧氟沙星在低浓度时促进小麦种子萌发,但抑制幼苗根的生长和叶绿素的合成并降低其过氧化物酶活性。王磊等[13]研究表明小麦比其他粮食作物对抗生素更为敏感。
抗生素在环境中的残留情况以及四环素类抗生素对蔬菜生态毒性的研究已有许多报道,但对磺胺类以及喹诺酮类抗生素对小麦生态毒性机制的研究较少。本研究选用磺胺二甲基嘧啶(SM2)和CIP 两种使用量较高的抗生素,以水培方法,研究两种抗生素对小麦种子萌发以及幼苗生长的影响,通过评价和分析两种抗生素生态毒性效应,明确其对小麦的抑制浓度,为不同种类抗生素风险评价以及畜禽粪便的处理和沼液的合理使用提供理论支持。
1 材料与方法
1.1 试验材料
供试小麦(Triticum aestivum)品种为徐麦33,购于江苏省连云港市种子站,SM2 和CIP 均购于上海麦克林公司,纯度分别为99%和98%。
1.2 试验方法
1.2.1 两种抗生素对小麦种子芽长、根长抑制率的影响
选取颗粒饱满、大小均匀的小麦种子,以3%的双氧水浸泡种子20 min进行消毒,用去离子水反复冲洗数次后,将种子均匀放在铺满滤纸的铝盘中,加入去离子水使之浸没小麦种子底部,盖上润湿的滤纸,放入(25±1)℃的恒温培养箱中催芽。在9 cm 直径的玻璃培养皿中放入三层滤纸,用消毒完的镊子将10粒已露白的小麦种子均匀放于培养皿中,保持种子胚根末端和生长方向呈直线,加入不同浓度的抗生素溶液6 mL,盖上培养皿盖,置于(25±1)℃恒温培养箱中暗处培养,间隔24 h待溶液蒸发后重新加入溶液。培养72 h 用测量尺测定小麦种子根长、芽长,确定种子根长最高抑制率达到20%~40%时,开始正式试验。
根据预试验结果,设置SM2 浓度梯度为0、0.1、1.0、2.0、5.0、10.0、50.0 mg·L-1,CIP 浓度梯度为0、0.1、0.5、1.0、5.0、10.0、50.0 mg·L-1,对照处理为等量的去离子水,每个处理设置4个重复。
小麦种子培养72 h 后用测量尺测定小麦种子根长、芽长,并计算抗生素对根长、芽长的抑制率。
根长抑制率=(对照组根长-处理组根长)/对照组根长×100%
芽长抑制率=(对照组芽长-处理组芽长)/对照组芽长×100%
目前,常采用植物的IC50(50% inhibitory concen⁃tration,半数抑制浓度)来评价污染物的生态毒性强弱[14],IC50的值越小说明植物对该物质越敏感。通过各浓度抗生素对小麦种子的根长、芽长抑制率可求得IC50值。
1.2.2 两种抗生素对小麦幼苗的影响
种子完全露白后移入含有上述不同浓度抗生素的1/4 霍格兰氏营养液中培养至两叶一心。1/4 霍格兰氏营养液:Ca(NO3)2·4H2O 1 mmol·L-1,KNO31.25 mmol·L-1,NH4NO30.25 mmol·L-1,KH2PO40.25 mmol·L-1,MgSO4·7H2O 0.5 mmol·L-1,Fe-EDTA 0.125 mmol·L-1,KI 6.25×10-6mmol·L-1,HBO31.25×10-4mmol·L-1,MnSO41.85×10-4mmol·L-1,ZnSO41.25×10-5mmol·L-1,Na2MoO42.5×10-7mmol·L-1,CuSO44×10-8mmol·L-1,CoCl2·6H2O 2.5×10-8mmol·L-1。将营养液倒入黑色避光容量为1 L 的96孔植物水培盒中,将发芽出根的小麦根系插进水培盒顶部的黑色孔板中保证根系正常生长,孔板上未插入小麦根系的部分用锡纸包裹防止透光。将水培盒放入光照培养箱中连续培养8 d,培养期间每日更换处理液,光照培养箱中培养条件:(25±1)℃、6 000 lx 光照强度下培养13 h,(20±1)℃、无光照下培养11 h。每个处理设置4个重复。
生物量:用四位天平分别称量小麦幼苗地上部与地下部鲜质量,并将称量后的小麦幼苗地上部与地下部放入105 ℃烘箱中杀青30 min,再将温度调至75 ℃烘至恒质量后称量其干质量。
小麦幼苗根系形态的测定:用根系扫描仪扫描小麦根系,通过WinRHIZO 根系扫描系统(Win RH220 STO1600 Systems)得出总根长、平均直径和小麦根系形态扫描图。
小麦根系氧化还原力:用α-萘胺法测定小麦苗期根系的氧化还原力[15]。根系氧化还原力是根系活力的重要表现,当根系的氧化还原力越大时,根系活力就越强,吸收养分的能力也增强[16]。
小麦幼苗根系细胞活力:取各处理的小麦幼苗根部组织置于2 mL 20µmol·L-1二乙酸荧光素(Fluores⁃cein diacetate,FDA)中,37 ℃条件下浸染20 min后,用0.05 mmol·L-1PBS(pH=7.0)清洗3~5 次,将样品放在生物荧光倒置显微镜下拍照[17]。FDA 能够使活细胞着色,荧光随着染料从死细胞中流失而降低,因而显微镜下观察到的细胞荧光强度能够判定小麦根系细胞活力的强弱。当植物受到外界胁迫时,细胞活力会发生变化,根系细胞活力可以作为评价有毒物质诱导植物细胞死亡的重要指标[18]。
1.2.3 统计分析
采用SPSS 软件对数据进行方差分析,运用ANOVA 方法分析处理组与空白对照组之间的差异性,用Origin 9.0 软件绘图。
2 结果与分析
2.1 SM2、CIP对小麦种子根长、芽长的影响
SM2 对小麦种子根长、芽长的影响见图1A、1C,结果表明:与对照组相比,0.1~2.0 mg·L-1SM2 处理组能够促进小麦种子根和芽的生长,10.0~50.0 mg·L-1SM2抑制小麦种子根的生长,且浓度越高抑制作用越强,而SM2浓度达到50.0 mg·L-1时显著抑制小麦芽长(P<0.05),芽长由对照的5.23 cm减小至4.31 cm。
CIP对小麦种子根长、芽长的影响见图1B、1D,结果表明:与对照组相比,0.1~1.0 mg·L-1CIP 均能够促进小麦种子根的生长,而0.1~5.0 mg·L-1CIP 均能够促进小麦种子芽的生长。5.0~50.0 mg·L-1CIP均抑制小麦种子根的生长,且浓度越高抑制作用越大,而在实验浓度范围内CIP 对小麦种子芽的生长均无显著抑制作用。
从图1可以看出SM2与CIP对小麦种子萌发均表现为低浓度促进高浓度抑制的作用,但是0.1~1.0 mg·L-1低浓度处理下SM2 对小麦种子抑制率高于CIP,50.0 mg·L-1SM2 明显抑制小麦芽长而CIP 对小麦芽长无明显抑制作用。两种抗生素对小麦种子根长的抑制率明显高于对芽长的抑制率,因此采用小麦种子根长的IC50来表征抗生素的生态毒性。SM2 对小麦种子根长IC50为101.65 mg·L-1,CIP 对应的IC50为176.10 mg·L-1,SM2对小麦种子根长的IC50值略小,说明在早期萌发阶段小麦种子的根对SM2更为敏感,比如1.0 mg·L-1处理下SM2 与CIP 对小麦种子根的抑制率分别为-13.66%和-38.75%。
2.2 SM2、CIP对小麦幼苗生物量的影响
SM2对小麦幼苗生物量的影响见图2,结果表明:与对照组相比,0.1 mg·L-1SM2 处理组在一定程度上促进了小麦根和叶的生长以及小麦干物质的积累,从1.0 mg·L-1SM2 开始明显抑制小麦地下部生物量,并且浓度越高抑制作用越大。1.0~5.0 mg·L-1的SM2 处理组小麦地上部生物量变化不明显,之后随着SM2浓度的增加呈现逐渐减小的趋势。

图1 SM2(A、C)与CIP(B、D)对小麦种子根长、芽长的影响Figure 1 Effects of SM2(A,C)and CIP(B,D)on root and shoot length of wheat seeds
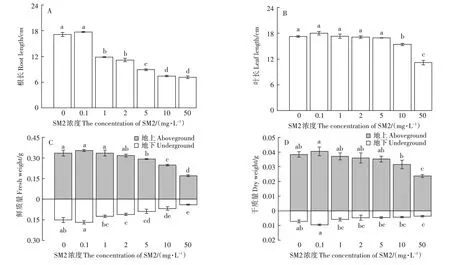
图2 SM2对小麦幼苗生物量的影响Figure 2 Effects of SM2 on biomass of wheat seedlings
CIP 对小麦幼苗生物量的影响见图3,结果表明:与对照组相比,除0.1mg·L-1CIP对小麦幼苗叶片的生长无明显作用外,各浓度CIP 处理组对小麦幼苗根长、叶长以及地上部与地下部的鲜质量、干质量均有不同程度的抑制。对于小麦幼苗地上部来说,随着CIP 浓度的增大其生物量呈现逐渐减小的趋势。而对于小麦幼苗地下部,0.1~1.0 mg·L-1CIP对其生物量具有明显的抑制作用,但当CIP 浓度达到10.0 mg·L-1后小麦幼苗地下部生物量变化趋于平缓。
上述结果表明,SM2、CIP两种抗生素对小麦幼苗地下部的影响均大于地上部,但CIP 对小麦幼苗抑制临界浓度低于SM2。
2.3 SM2、CIP对小麦幼苗根系形态的影响
SM2 对小麦幼苗根系形态影响见图4A 和图5A、图5B,结果表明:0.1 mg·L-1SM2 能够促进小麦根系生长,小麦幼苗根系总根长与平均直径均有所增大,但是随着SM2浓度的增大,小麦幼苗根系生长受到抑制,侧根逐渐减少,总根长与平均直径均呈现减小的趋势,这与小麦幼苗干物质积累的结果一致。
CIP 对小麦幼苗根系形态影响见图4B 和图5C、图5D,结果表明:在各浓度CIP 处理下小麦幼苗根系生长均会受到抑制,随着CIP 浓度的增大,小麦幼苗根系侧根数和须根数也逐渐减少,总根长与平均直径均呈现减小的趋势,当CIP 浓度达到10.0 mg·L-1后随着CIP浓度的增大,小麦幼苗根系变化较小,CIP对小麦根系的抑制作用达到较高水平,这与小麦幼苗干物质积累的结果也一致。
由此可见,低浓度处理下SM2对小麦幼苗根系形态起促进作用,而低浓度CIP 已经抑制小麦根系发育,但是随着处理浓度的增大两种抗生素抑制根系发育作用均逐渐增强。
2.4 SM2、CIP对小麦幼苗根系氧化还原力的影响
SM2 对小麦幼苗根系氧化还原力的影响见图6A,结果表明:SM2 与小麦幼苗根系氧化还原力呈明显负相关,当SM2浓度达到10.0 mg·L-1时显著抑制小麦根系氧化还原力(P<0.05),此时小麦根系对α-萘胺的生物氧化量由对照的103.15 µg·g-1·h-1减小到86.25µg·g-1·h-1,并且SM2浓度越大根系对α-萘胺的生物氧化量越小。

图3 CIP对小麦幼苗生物量的影响Figure 3 Effects of CIP on biomass of wheat seedlings

图4 不同浓度的SM2(A)和CIP(B)对小麦幼苗根系形态的影响Figure 4 Effects of SM2(A)and CIP(B)on root morphology of wheat seedlings

图5 SM2(A、B)和CIP(C、D)对小麦幼苗总根长、平均直径的影响Figure 5 Effects of SM2(A,B)and CIP(C,D)on total root length and average diameter of wheat seedlings
CIP 对小麦幼苗根系氧化还原力的影响见图6B,结果表明:CIP 与小麦幼苗根系氧化还原力呈明显负相关,1.0 mg·L-1CIP 即显著抑制小麦根系氧化还原力(P<0.05),此时小麦根系对α-萘胺的生物氧化量由对照的103.15 µg·g-1·h-1减小到86.77 µg·g-1·h-1,并且随着CIP 浓度的增大根系对α-萘胺的生物氧化量呈逐渐减小的趋势。
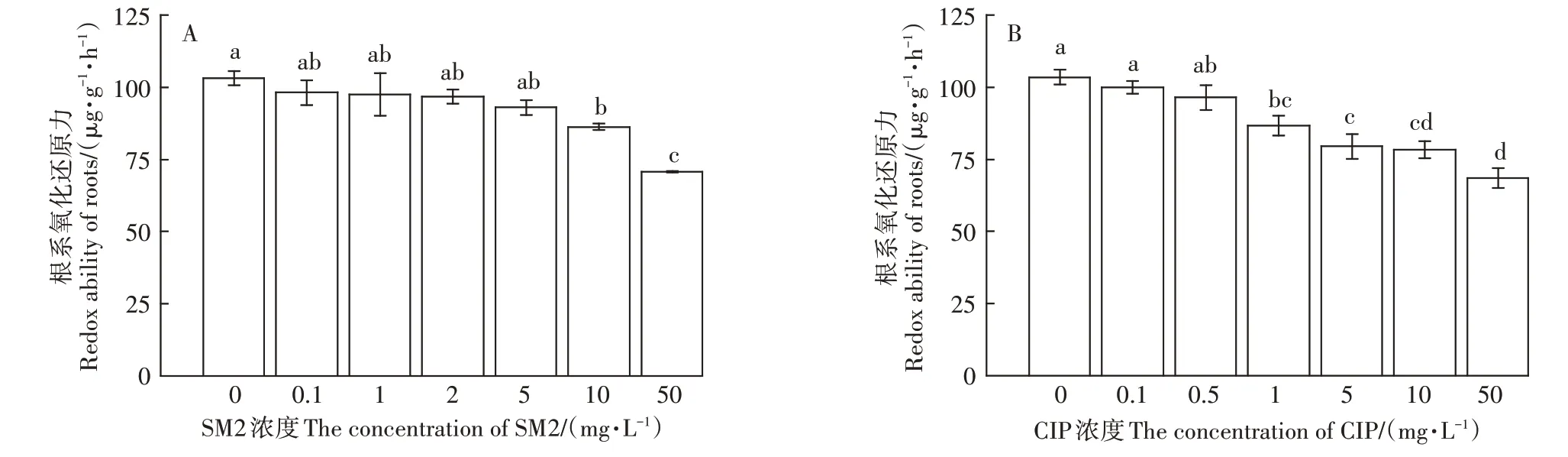
图6 SM2(A)和CIP(B)对小麦根系氧化还原力的影响Figure 6 Effects of SM2(A)and CIP(B)on redox ability of wheat roots
可以看出SM2 和CIP 对小麦幼苗根系氧化还原力的影响均表现为随着抗生素浓度的增大根系氧化还原力逐渐降低,且CIP 产生抑制作用的临界浓度更低。
2.5 SM2、CIP对小麦幼苗根系细胞活力的影响
SM2 对小麦幼苗根系细胞活力的影响见图7A,结果表明:与对照相比,0.1 mg·L-1SM2对小麦根系细胞活力影响较小,但当SM2 浓度达到1.0 mg·L-1时小麦根系荧光亮度有所减弱,之后随着SM2 浓度的增大,小麦根系荧光区域逐渐减小并且亮度逐渐减弱,根系细胞活力逐渐减弱。
CIP 对小麦幼苗根系细胞活力的影响见图7B,结果表明:与对照相比,各浓度CIP 处理下的小麦根系细胞均一定程度受损,在试验浓度范围内随着CIP 浓度增大,小麦根系荧光区域逐渐减小并且亮度逐渐减弱,小麦根系细胞活力呈逐渐减弱的趋势。
随着SM2 和CIP 浓度的增大,小麦根系细胞活力均呈现逐渐减弱的趋势,但低浓度SM2处理下小麦根系细胞活力变化较小,而低浓度CIP 处理下小麦根系细胞活力已有所降低。

图7 SM2(A)与CIP(B)对小麦幼苗根系细胞活力的影响Figure 7 Effects of SM2(A)and CIP(B)on root cell viability of wheat seedlings
3 讨论
3.1 两种抗生素对小麦种子毒性效应
低浓度SM2、CIP能够促进小麦种子萌发,原因可能是在较低浓度抗生素胁迫下种子产生应激反应,刺激体内生长物质的合成,王盼亮等[19]研究表明,低剂量的抗生素刺激植物体内蛋白质的合成来抵御抗生素的胁迫。但随着抗生素浓度的升高种子萌发开始受抑制,并且随着浓度的增大抑制作用不断增强,说明当抗生素浓度较高时抗生素的毒害作用会逐渐显现,这与李萌等[20]的研究结果相似。而抗生素对小麦种子根的抑制作用更强可能是由于小麦种子的根与污染物直接接触,而芽可以通过从胚中吸收养分维持自身生长,但是随着抗生素浓度的升高,根吸收抗生素并运输到种胚内,芽的生长也会逐渐受到抑制[21]。
对比两种抗生素对小麦种子根长的IC50可以发现,小麦种子对SM2 的敏感程度略大于CIP,说明小麦对不同种类抗生素耐受程度不同,实际生产中要注意沼液等畜禽粪便有机肥中所含抗生素的浓度。魏子艳[22]研究表明磺胺对甲氧嘧啶比金霉素对油菜的生态毒性更强。
3.2 两种抗生素对小麦幼苗生长的影响
两种抗生素对小麦幼苗生长的毒性作用机制有明显区别,但与种子萌发不同的是CIP 对小麦幼苗生长的抑制作用更强。其原因是抗生素在植物体内的累积能力不同,衰减系数也不同,因此产生的生态毒性程度也不同,CIP属于亲水性较强的抗生素,而SM2则亲水性较弱,因此CIP 更易从地下部运输到地上部,从而对小麦幼苗地上部与地下部产生毒害[23]。其毒性可能是由于小麦体内生长所需的叶酸与从环境中吸收的抗生素相互竞争使得小麦对叶酸吸收减小,进而影响小麦幼苗的生长[24]。与小麦种子相比,两种抗生素对幼苗的抑制临界浓度更低,说明随着幼苗的生长其累积抗生素的能力有所提高,其根系只能被迫吸收环境中的抗生素。同样抗生素对小麦幼苗地下部的影响大于地上部,原因可能是根系直接暴露在抗生素溶液中受到毒害作用,并且根作为吸收养分的主要器官对抗生素的累积能力强于叶片,这与鲍陈燕等[25]的研究结果类似。
3.3 两种抗生素对小麦幼苗根系的影响
植物根系是直接吸收和利用环境中水分和养分的器官,地下部根系的生长状况和形态会影响整株植物生长发育[26]。小麦根系形态的结果与其生物量相一致,随着抗生素浓度的增大,根长和平均直径逐渐减小,侧根明显减少,说明根系吸收养分的能力不断减弱,根系的固持能力也不断减弱。这与王效瑾等[27]的研究结果相反,其研究表明在高浓度污染物胁迫下,小麦幼苗的根长减小,但是根系的平均直径逐渐增加,原因可能是不同的污染物对小麦的胁迫效应不同。
根系氧化还原力和细胞活力均能够反映根系活力,在较高浓度SM2 和CIP 胁迫下小麦根系活力明显减弱,说明抗生素一旦超过临界浓度就会抑制小麦根系活力,影响小麦根系养分的吸收。一般而言植株通过体内抗氧化酶活性以及渗透调节物质来抵御外界胁迫,因此在较高浓度抗生素胁迫下小麦体内抗氧化酶系统可能受到损伤,影响幼苗正常生长发育。这与廖德润等[28]的研究结果类似,其研究表明低浓度的抗生素对空心菜植株的生长具有刺激效应,而高浓度条件下则表现出抑制效应,植株中可溶性蛋白含量以及抗氧化酶活性均受到抑制。
4 结论
(1)低浓度的SM2、CIP能够促进小麦种子根和芽的生长,但达到抑制临界浓度后开始对小麦种子根长起抑制作用,并且随着浓度的增大抑制作用不断增强,抗生素对小麦种子根的毒性效应强于芽。小麦种子对SM2 的耐受程度略低于CIP,低浓度的SM2 对小麦种子根的生态毒性更为明显。
(2)两种抗生素对小麦幼苗生长的毒性作用机制有明显区别,CIP 对小麦幼苗的生态毒性更强。抗生素对小麦幼苗的抑制临界浓度低于小麦种子,并且对小麦幼苗地下部的毒害作用大于地上部。
(3)在试验浓度范围内两种抗生素与小麦幼苗根系活力呈负相关,在较低浓度下SM2、CIP对小麦幼苗根系活力影响较小,随着抗生素浓度的升高小麦幼苗根系活力逐渐减弱。因此在施用粪肥时要严格监控其中抗生素的量,保证粮食生产安全。
