赊店老酒酒醅中高产纤维素酶菌种的分离鉴定及产酶条件优化
2021-03-11刘延波刘洋洋赵志军吴俊仪潘春梅孙西玉
刘延波,刘洋洋,赵志军,吴俊仪,王 贤,潘春梅,孙西玉*
(1.河南牧业经济学院 食品与生物工程学院(酒业学院),河南 郑州 450046;2.河南仰韶酒业有限公司博士后创新实践基地,河南 渑池 472400;3.河南牧业经济学院 河南省白酒风格工程技术研究中心,河南 郑州 450046;4.河南牧业经济学院 郑州市白酒酿造微生物技术重点实验室,河南 郑州 450046;5.赊店老酒股份有限公司,河南 社旗 473300;6.河南张弓老酒酒业有限公司,河南 宁陵 476733)
浓香型白酒是中国白酒销售市场的主力,具有窖香浓郁、绵柔醇厚、香味和谐、尾净余长的特征[1]。浓香型白酒的制作主要是以酒醅和窖池为基础,依靠大曲、窖泥和空气中的一些微生物在白酒酿造的窖池中进行极其庞大的物质与能量代谢的流程。酒醅是酿制白酒的原料经过微生物融合后发酵的物质,也是酒精发酵过程中物质能量代谢最活跃的反应中心[2]。在白酒的窖池环境中,酒醅充当着信息传导、物质循环和能量流动的“三流运行”定律的介质[3]。酒醅之中的挥发性成分则直接影响着白酒酒体的口感与风味[4]。
纤维素是由β-葡聚糖苷键将葡萄糖相连接而成的多聚糖,其降解需内切β-1,4-葡聚糖酶、外切β-1,4-葡聚糖酶和β-葡萄糖苷酶三种酶的协作作用,才能够将其分解为葡萄糖,这一原理广泛应用于工业制造中[5-6]。白酒发酵的酒醅中含有许多种类的产生纤维素酶的菌株,它们所形成的纤维素酶对于白酒的生产品质起着十分关键的作用,其不仅能够影响到白酒中的有机酸、酯、醇、醛等风味成分的产量,而且能够提高白酒的出酒效率[7]。
迄今为止也有较多关于高产纤维素酶菌株的报道,但大部分是从土壤和腐烂的植物叶片中筛选出来的[8-12],而从酒醅中进行筛选高产纤维素酶菌株的研究较少[13]。本试验拟从赊店老酒浓香型白酒酒醅中筛选出一株高产纤维素酶的菌株,对该菌株进行分离鉴定和产酶条件的优化,以便将其应用于酒糟中纤维素的降解,从而提高白酒的出酒率。
1 材料与方法
1.1 材料与试剂
酒醅样品:取自赊店老酒股份有限公司。
羧甲基纤维素钠(carboxymethylcellulose-Na,CMC-Na):天津市致远化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:天根生化科技有限公司。
CMC-Na培养基:CMC-Na 1.5%,KH2PO40.1%,NH4NO30.1%,琼脂2%,酵母膏0.1%,MgSO4·7H2O 0.05%,pH为自然条件(CMC-Na液体培养基不加琼脂)。
刚果红纤维素固体培养基:CMC-Na 1.5%,琼脂2%,KH2PO40.1%,NH4NO30.1%,MgSO4·7H2O 0.05%。
液体产酶培养基:CMC-Na l%,酵母膏0.02%,蛋白胨0.3%,(NH4)2SO40.2%,CaC12·2H2O0.03%,MgSO4·7H2O0.03%,KH2PO40.4%。以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
DNP-9272BS-Ⅲ电热恒温培养箱:上海新苗医疗器械制造有限公司;Z-211恒温培养摇床:上海知楚仪器有限公司;LDZX-50KBS立式高压灭菌器:上海申安医疗机械厂;HH-6数显恒温水浴锅:常州方科仪器(常州)有限公司;SW-CJ-2F型双人双面净化工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 纤维素酶生产菌株的分离与初筛
将酒醅样品溶入无菌水中,稀释为一系列不同的稀释度,取10-3、10-4、10-5这3个稀释梯度,将其分别涂布于CMC-Na培养基上,每个稀释度取100 μL涂布于3个平板,在37 ℃恒温培养箱中培养[14],反复分离划线至单个菌落。
在刚果红纤维素固体培养基上接种通过分离和筛选获得的单个菌落,在37 ℃恒温培养箱中培养2 d之后用刚果红溶液(1 mg/mL)染色30 min,再采用蒸馏水清洗,最后用NaCl溶液(1 mol/L)进行30 min脱色。观察菌落的周围是否存在透明圈,记录透明圈的直径和菌落的直径的比值,并将产纤维素酶活较佳的菌种进行保存[15-16]。
1.3.2 高产纤维素酶菌株复筛
将初步筛选得来的菌株接种到CMC-Na液体培养基中,并于摇床(37 ℃、150 r/min)中培养2 d获得均匀的种子溶液,然后按5%的比例分别接种于产酶培养基中于摇床(37 ℃、150 r/min)中培养3 d,将发酵液以8 000 r/min离心10 min,所取上清液作为粗酶液[17]。以3,5-二硝基水杨酸(DNS)法测定羧甲基纤维素酶(CMC)活力和滤纸酶(filter paper activity,FPA)活力,最后根据所测酶活性值选择高产纤维素酶菌株。
羧甲基纤维素酶酶活力的定义:在50 ℃条件下,1 mL酶液在1 min内水解底物所生成1 μg的葡萄糖所消耗的酶量为1个酶活力单位,U/mL。
葡萄糖标准曲线的绘制:取25 mL试管分别添加葡萄糖标准溶液(2 mg/mL)0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL,添加蒸馏水至2 mL,然后加入DNS试剂3 mL,于沸水中煮沸5 min,待其冷却,再添加蒸馏水,定容至15 mL,充分摇匀,用分光光度计在波长540 nm处测量并记录吸光度值,以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标绘制葡萄糖标准曲线。葡萄糖标准曲线回归方程为y=0.864x+0.030 8,相关系数R2=0.997 9。
CMC酶活测定:分别向4支试管中(1支空白试管,3支样品试管),加入用醋酸-醋酸钠缓冲液(pH4.8)所配制的1%CMC-Na溶液1.5 mL,再加入0.50 mL一定稀释比例的粗酶液(空白管中加入蒸馏水),混匀。将4支试管于(50±0.1)℃水浴中反应30 min,然后将3 mL DNS试剂快速添加到每个试管中并充分摇匀。将4支试管同时进行5 min沸水浴加热后取出冷却至室温,再添加蒸馏水至15 mL并摇动,以空白管作为对照液进行调零,检测其波长540 nm处的OD540nm值[18]。
FPA酶活测定:分别向4支试管中(1支空白管,3支样品管),加入1.5 mL醋酸-醋酸钠缓冲溶液(pH4.8)和(50±0.5)mg滤纸,然后加入稀释一定比例的粗酶液0.50 mL(空白管加蒸馏水),使滤纸完全浸没试管内溶液。将4支试管一并置于(50±0.1)℃水浴,反应60 min,之后立即向各试管中加入DNS试剂3.0 mL,摇匀。后续试验操作同上[19]。
1.3.3 菌种的鉴定
形态学特征初步鉴定:对菌落形态特征、颜色、大小、革兰氏染色等进行观察。
生理生化试验鉴定参照文献[20]。
分子生物学鉴定:以总DNA为模板,利用16S rDNA的1492R和27F通用引物开展聚合酶链式反应(polymerase chain reaction,PCR)扩增实验,得到的PCR扩增产物,经过凝胶电泳后采用凝胶成像系统观察,再进行测序与拼接,测序结果在GenBank数据库系统中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对后,采用MEGA 7.0软件构建系统发育树。
1.3.4 产酶条件优化单因素试验
分别考察不同氮源、碳源、发酵温度、发酵时间、初始pH值等单因素对菌株产纤维素酶能力的影响。
不同碳源对菌株产酶的影响:分别以CMC-Na、麸皮、蔗糖、葡萄糖、淀粉作为液体产酶培养基单一碳源(添加量为1.5%),接种量为5%,37 ℃、150 r/min恒温摇床培养72 h后测定酶活性[21-22]。确定最适碳源后,改变碳源添加量分别为1%、2%、3%、4%、5%,按上述条件测定酶活以确定碳源添加量。
不同氮源对菌株产酶的影响:分别以蛋白胨、硝酸铵、硫酸铵、尿素、酵母粉作为液体产酶培养基单一氮源(添加量为0.1%),接种量为5%,37 ℃、150 r/min恒温摇床培养72 h后测定酶活性。确定最适氮源后,改变氮源添加量分别为0.2%、0.4%、0.6%、0.8%、1.0%,按上述条件测定酶活以确定氮源添加量。
培养时间对菌株产酶的影响:在接种量为5%的条件下,将液体产酶培养基于恒温摇床中37 ℃、150 r/min分别培养1 d、2 d、3 d、4 d、5 d后测定酶活性。
培养温度对菌株产酶的影响:在接种量为5%的条件下,将液体产酶培养基分别置于28 ℃、31 ℃、34 ℃、37 ℃、40 ℃恒温摇床中150 r/min培养72 h后测定酶活性[23]。
培养基的初始pH对菌株产酶的影响:在接种量为5%的条件下,用柠檬酸缓冲液调节液体产酶培养基的初始pH值分别为4.0、5.0、6.0、7.0、8.0,37 ℃恒温摇床中150 r/min培养72 h后测定酶活性[16]。
1.3.5 产酶条件优化响应面试验
在单因素试验的基础上,使用DesignExpert8.0.6软件,确定3因素3水平的最佳参数进行响应面分析研究,优化产纤维素酶菌株的产酶条件。响应面试验因素与水平编码见表1。

表1 菌株4-2产酶条件优化响应面试验因素与水平Table 1 Factors and levels of response surface experiments for optimization of enzyme production conditions by strain 4-2
2 结果与分析
2.1 产纤维素酶菌株的分离与筛选
将样品酒醅稀释液涂布于CMC-Na培养基上培养,共分离筛选出89株菌株,进一步将菌株点种于刚果红纤维素固体培养基上,用刚果红溶液进行染色。测透明圈直径(D)与菌落直径(d)比值(D/d),筛选得到8株D/d值较大的菌株。将筛选得到的8株菌株接种到羧甲基纤维素钠液体培养基中,测定CMC酶活、FPA酶活。结果见表2。

表2 菌株水解圈直径与菌落直径比值及酶活力测定结果Table 2 Determination results of hydrolysis circle diameter to colony diameter ratio and enzyme activity of strain
由表2可知,菌株4-2酶活力最高,其CMC酶活达149.93 U/mL,FPA酶活达92.90 U/mL。
2.2 菌株4-2的形态学鉴定及生理生化试验
在37 ℃条件下,将菌株4-2于CMC培养基中培育1 d后,观察菌株的菌落形态,结果表明,菌株的菌落颜色为乳白色,表面湿润、不透明,菌落为规则的圆形或者椭圆形。显微镜下观察的革兰氏染色结果为紫色,菌株形态为短杆状,说明菌株4-2为革兰氏阳性菌。菌株4-2的生理生化试验结果见表3。

表3 菌株4-2生理生化试验结果Table 3 Results of physiological and biochemical experiments of strain 4-2
由表3可知,菌株4-2可水解淀粉、V.P试验、明胶液化、硝酸盐还原均为阳性,而吲哚试验、硫化氢试验均为阴性。
2.3 菌株4-2的分子生物学鉴定
菌株4-2的系统进化树如图1所示。由图1可知,菌株4-2与Bacillus tequilensis相似性达100%。结合菌株4-2的生理生化结果、菌落形态特征及16S rDNA分析,鉴定菌株4-2为特基拉芽孢杆菌(Bacillus tequilensis)。

图1 基于16S rDNA基因序列菌株4-2的系统进化树Fig.1 Phylogenetic tree of strain 4-2 based on 16S rDNA gene sequences
2.4 不同条件对菌株4-2产酶的影响
2.4.1 不同碳源对菌株4-2产酶的影响
由图2可知,液体产酶培养基碳源为淀粉时,CMC酶活力最高,为2 028.01 U/mL,由此确定,淀粉为该菌株产酶的最佳碳源。由图3可知,在淀粉添加量为3%时,该菌株发酵产酶能力最好,CMC酶活达2 403.78 U/mL,FPA酶活达2 234.65 U/mL。由此确定,该菌株产酶的最佳培养基碳源添加量为3%。
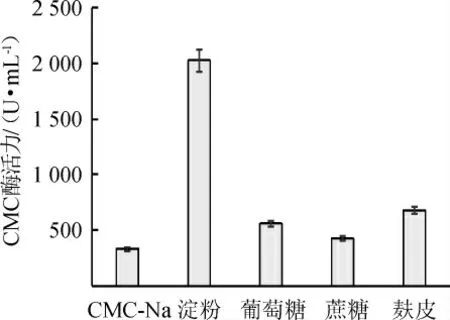
图2 不同碳源对菌株4-2产酶活力影响Fig.2 Effect of different carbon sources on the activity of enzyme produced by strain 4-2

图3 淀粉添加量对菌株4-2产酶活力影响Fig.3 Effect of starch addition on the activity of enzyme produced by strain 4-2
2.4.2 不同氮源对菌株4-2产酶的影响
由图4可知,液体产酶培养基氮源为酵母粉时,CMC酶活最高,为195.83 U/mL,由此确定,酵母粉为该菌株产酶的最佳氮源。由图5可知,当酵母粉添加量为0.6%时,该菌株发酵产酶能力最好,CMC酶活达199.88 U/mL,FPA酶活达133.71 U/mL。由此确定,该菌株产酶的最佳培养基氮源添加量为0.6%。

图4 不同氮源对菌株4-2产酶活力影响Fig.4 Effect of different nitrogen sources on the activity of enzyme produced by strain 4-2
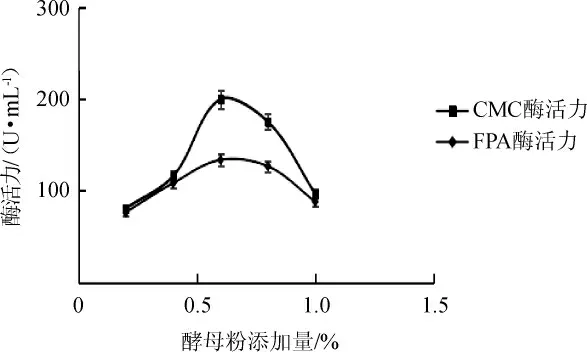
图5 酵母粉添加量对菌株4-2产酶活力影响Fig.5 Effect of yeast powder addition on the activity of enzyme produced by strain 4-2
2.4.3 不同培养温度对菌株4-2产酶的影响
由图6可知,培养温度为34 ℃时,菌株4-2发酵产酶能力最好,CMC酶活达115.59 U/mL,FPA酶活达111.73 U/mL。由此确定,该菌株产酶的最佳培养温度为34 ℃。

图6 不同培养温度对菌株4-2产酶活力影响Fig.6 Effect of different temperature on the activity of enzyme produced by strain 4-2
2.4.4 不同初始pH对菌株4-2产酶的影响
由图7可知,在初始pH值=5时,菌株4-2发酵产酶能力最好,CMC酶活达206.64 U/mL,FPA酶活达120.22 U/mL。由此确定,该菌株产酶的培养基最佳初始pH值为5。
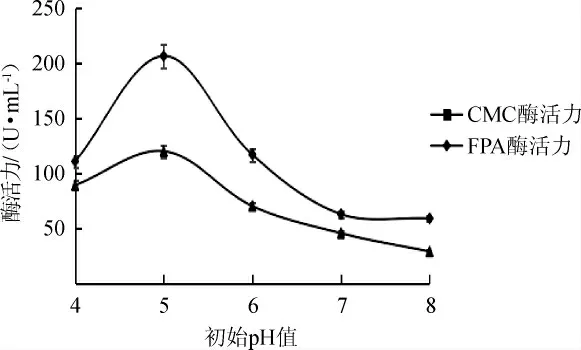
图7 不同初始pH值对菌株4-2产酶活力影响Fig.7 Effect of different initial pH value on the activity of enzyme produced by strain 4-2
2.4.5 不同培养时间对菌株4-2产酶的影响
由图8可知,菌株4-2在培养5 d的时候,发酵产酶能力最好,CMC酶活达223.61 U/mL,FPA酶活达108.64 U/mL。由此确定,该菌株产酶的最佳培养时间为5 d。

图8 不同培养时间对菌株4-2产酶活力影响Fig.8 Effect of culture time on the activity of enzyme produced by strain 4-2
2.5 产酶条件优化响应面试验
2.5.1 响应面设计、回归模型的建立及其显著性检验
由表4、表5可知,回归模型F值为489.14,且显著性检验为极显著(P<0.000 1),失拟项不显著(P=0.892 7>0.05),说明该模型可靠。根据试验结果表5对各因素试验结果的影响进行二次拟合,经回归拟合,得回归方程:

回归方程决定系数(R2)=99.84%,表明该模型可以解释99.84%的酶活变化,非常适合实际的情况。该方程式提供了适用于菌株4-2产纤维素酶的模型,因此该模型可用于代替实际试验点,以进行数据分析和纤维素酶生产能力的预测。

表4 菌株4-2产酶条件优化响应面试验设计与结果Table 4 Design and results of response surface experiments for optimization of enzyme production conditions by strain 4-2
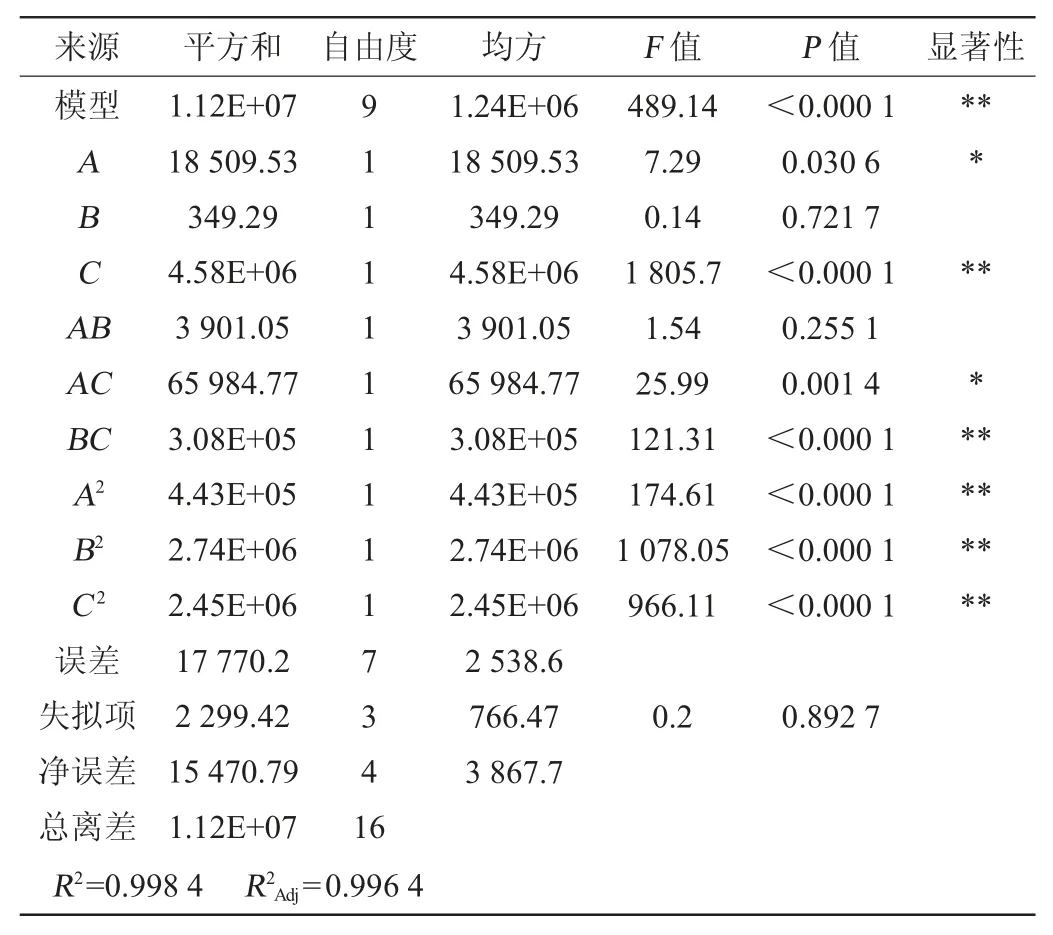
表5 回归模型的方差分析Table 5 Variance analysis of regression model
2.5.2 各因素交互作用的响应面图
采用Design-Expert 8.0.6软件得到二次响应面回归模型,并分析和创建相应的响应面。利用回归模型绘制的响应面及等高线见图9。对获得的回归拟合方程中的三个变量分别求一阶偏导数,组成方程组求解。所得结果即为最大酶活力时菌株4-2所需最佳发酵条件,为A=3.53,B=0.59,C=5.75。根据实际操作条件即得最佳发酵条件为:淀粉添加量为3.5%,酵母粉添加量为0.6%,初始pH为5.8,在此优化条件下,理论上预测的CMC最大酶活为3 058.15 U/mL,重复验证试验的CMC酶活实际值为3 101.83 U/mL,是优化前的20.69倍。基本上与预测值接近,说明所构建的模型具有良好且稳定的拟合性能。
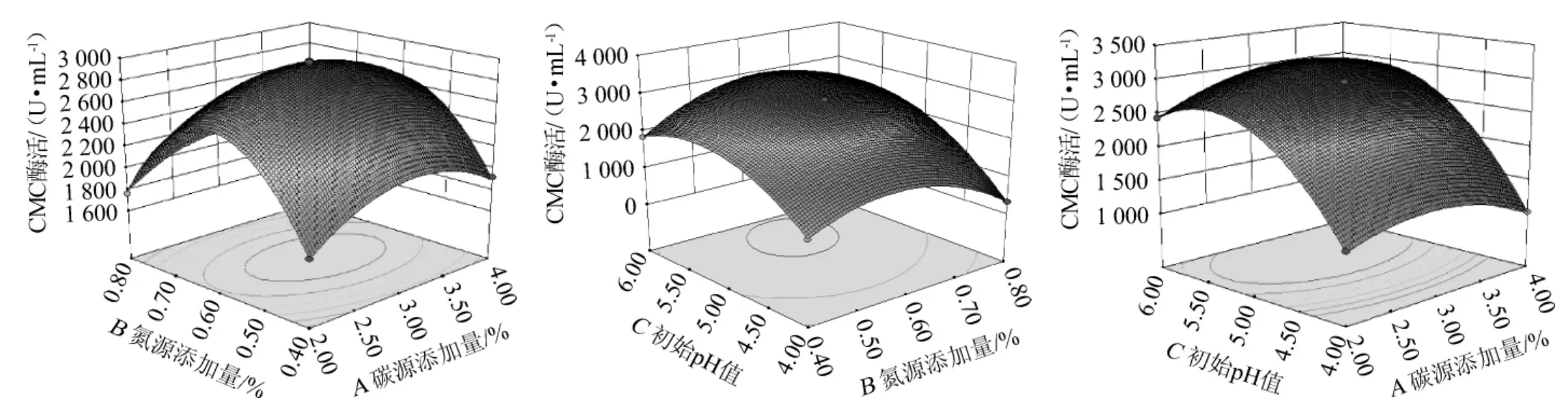
图9 淀粉添加量、酵母粉添加量与初始pH值交互作用对菌株4-2产酶活力影响的响应曲面与等高线Fig.9 Response surface plots and contour lines of effects of interaction between starch addition,yeast powder addition and initial pH on the activity of enzyme produced by strain 4-2
3 结论
本研究通过刚果红染色测透明圈法初筛和DNS法复筛,从赊店老酒酒醅中筛选出1株产纤维素酶能力高的菌株4-2,通过形态学观察和分子生物学鉴定,确定该菌株为特基拉芽孢杆菌(Bacillus tequilensis)。通过单因素和响应面试验确定该菌株产纤维素酶的最优条件为液体产酶培养基,淀粉添加量3.5%,酵母粉添加量0.6%,初始pH 5.8,培养时间5 d,培养温度34 ℃。在此优化条件下,该菌株产纤维素酶活力达3 101.83 U/mL,是优化前的20.69倍。
