贵州喀斯特山区不同种植年限花椒根际土壤细菌群落结构特征研究
2021-03-09杨睿李娟龙健廖洪凯王显李宜蓉
杨睿,李娟,龙健,廖洪凯,王显,李宜蓉
1.贵州师范大学/贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳 550001;2.贵州师范大学地理与环境科学学院,贵州 贵阳 550001
贵州喀斯特地区地形地貌复杂,地表植被覆盖率低,土壤侵蚀退化造成水土流失严重,大面积岩石裸露,形成大量的溶沟、石芽、石缝,加之人为活动干扰,石漠化愈发严重且有蔓延趋势,这已经成为岩溶地区最大的生态问题(孙建等,2019)。花江喀斯特大峡谷隶属于贵州省关岭县板贵乡,该区域属典型喀斯特生境,为改善生态环境和增加农民收入,该地区于 1999年种植 328 hm2花椒(Zanthoxylumbungeamun)林,从开始发展至今长达 20余年。在长期生产经营过程中土壤性质有朝盐碱化、板结、土壤中毒、生物活性变化等方向发展的趋势(王程等,2019;王宏,2018),地力衰退影响植物养分供给平衡,同时引起土壤微生物细菌群落结构变化。根际是指受植物根系活动影响,在物理、化学和生物学性质上不同于土体的那部分微域土区(郑毅等,2003),根区土壤环境对植物根系有效地吸收水分和养分有着积极的意义,根际微生物在改善植物根际微生态平衡方面的巨大潜力已经得到充分认可(叶雯等,2018)。根际土壤中的细菌是土壤生态系统中贡献最大的类群,它们对环境改变特别敏感,特别是少数高丰度物种与多数低丰度物种比整个微生物群体更容易受土壤生态系统变化的影响(蒋景龙等,2018)。有研究表明三叶赤楠(Syzygiumgrijsii)根际细菌多样性随着种植时间的增加而增加(刘玮等,2010);还有研究表明猕猴桃(Kiwifruitorchards)细菌群落多样性随着种植年限增加而显著降低(朱海云等,2019);油用牡丹(Paeoniaostia)根际细菌菌群丰度和多样性随着种植年限增加而降低(郭丽丽等,2017);也有研究表明宁夏枸杞(Lyciumbarbarum)根际细菌多样性随着种植年限的增加而降低(肖龙敏等,2018),基于以上研究可知种植年限会对不同植物细菌群落产生不同的影响。
花椒是芸香科花椒属落叶灌木或小乔木(喻阳华等,2018)。由于植株较小,根系分布浅,保水固土能力好,常用于钙质土山地造林(王钰等,2007)。目前关于花椒生长状况、土壤理化指标的研究主要集中在表层土壤多种形态有机碳的含量变化(张文娟等,2015;廖洪凯等,2015;龙健等,2018)、根系分布抗旱特征(容丽等,2007)、土壤酶活性变化(刘姣姣等,2019)等方面,并取得了一些成果。但对花椒不同种植年限根际土壤理化指标变化情况、细菌群落结构差异及二者的关系尚未明确。
因此,本研究基于花椒的不同生长年限,测定花椒根际土壤理化指标,并采用高通量 16S rRNA测序技术测定根际土壤细菌群落结构,分析土壤理化指标与细菌丰富和稀有类群的关系,以期找出影响花椒根际土壤细菌群落结构变化的主要因子及预测随着生长年限变化花椒土壤环境致病菌的演替规律,为解决花椒林地力衰退和指导贵州喀斯特地区花椒产业发展提供参考。
1 材料与方法
1.1 研究区概况
研究区位于贵州省安顺地区关岭县花江干热河谷小流域(25°39.8′—25°40.0′N,105°39.3′—106°39.7′E),海拔 600—1200 m。该地区碳酸岩盐广布,水热充沛,降水分布不均匀,5—10月降水量达全年降水量的83%,气候垂直变化明显,多以热带河谷气候为主。该区域白云质和泥质灰岩较多,土壤类型大部分是黑色和棕黄色石灰土。土壤结构不良、质地粘重、且富含较高的钙质。该地区植被总体覆盖率<3%,岩石裸露率为70%以上,植被郁闭度低,生境干旱显著,非耕地资源丰富。当地的花椒纯林从1992年开始有规模种植,1995年开始成熟,至 2000年左右进入丰产期,主要是选择沟穴或石穴种植,多为一穴一株,单株花椒具有相对独立的生长空间,除花椒(Zanthoxylumbungeanum)外,还有少量草本植物伴生,如蒲公英(Taraxacummongolicum)、仙人掌(Opuntia dillenii)、扭黄茅(Heteropogoncontortus)等。
1.2 研究方法
1.2.1 样品采集与分析
于2019年4月在贵州省关岭花江地区选取5、10、20、30 a生长状况相近,管理措施相同的健康花椒3株,采集其根际土。土样采集过程为:去除地表凋落物,选取细根比较发达的地方,利用根钻按五点取样法采集各范围内0—10 cm深土壤2 kg,取样后按四分法混匀,共获得 12个土壤样品。将采集到的土壤样品分两份,一份用保鲜袋封装,用于土壤理化因子分析;另一份装于无菌采样袋用于土壤细菌群落的测定。
1.2.2 土壤理化性质测定
土壤理化性质分析参考鲍士旦《土壤农化分析》第3版(鲍士旦,2000)。其中pH值测定采用玻璃电极法,有机质测定采用高温外热重铬酸钾氧化-容量法,含水率(SMC)测定采用烘箱(105±2) ℃烘干法,有效磷测定采用盐酸-氟化铵提取-钼锑抗比色法,铵态氮测定采用靛酚蓝比色法,硝态氮测定采用氯化钾浸提-紫外分光光度法。
1.2.3 土壤微生物分析
DNA提取及质量检测:根据 E.Z.N.A soil试剂盒(Omega Bio-tek,Norcross,GA,U.S)说明书取0.5 g土壤进行总DNA抽提,DNA浓度和纯度利用NanoDrop 2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量。
文库制备:338F 5′-ACTCCTACGGGAGGCA GCAG-3′和 806R 5′-GGACTACHVGGGTWTCTA AT-3′引物对 16S rRNA V3—V4区进行 PCR扩增(PCR仪:ABIGene Amp®9700型),扩增程序为:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,27个循环,最后72 ℃延伸10 min。扩增体系为 20 μL,4 μL 5×FastPfu 缓冲液,2 μL 2.5 mmol·L−1d NTPs,0.8 μL5 mmol·L−1引物,0.4 μL FastPfu聚合酶,10 ng DNA模板,灭菌dd H2O补足 20 μL。
Illumina Miseq测序:使用2%琼脂糖凝胶回收PCR产物,利用 AxyPrep DNA GelExtraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega,USA)进行检测定量。根据Illu-mina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE2×300的文库。构建文库步骤:(1)连接“Y”字形接头;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)氢氧化钠变性,产生单链DNA片段。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.3 数据处理
土壤细菌16S rRNA数据处理:(1)基于usearch、vsearch软件处理下机序列,主要利用unoise3去除嵌合体并经后续处理[https://github.com/torognes/vsearch/releases,http://www.drive5.com/usearch/],获得代表序列和OTU表。(2)采用朴素贝叶斯算法训练特征分类器(基于Silva 132版本数据库),利用代表序列和特征分类器进行进一步训练,得到物种注释文件。(3)基于Unoise方法,将OTU表与注释文件进行匹配,即得到物种的分类水平。(4)利用QIIME2插件“qiime diversity core-metrics-phylogenetic”、“qiime diversity alpha”计算多样性指数(Vázquez et al.,2013)。

式中,Sobs为实际测量出的OTU数目;ni为含有i条序列的OTU数目;N为所有的序列数

式中,Schao1为估计的OTU数;Sobs为观测到的OTU数;n1为只有一条序列的OTU数目;n2为只有两条序列的OTU数目。
Simpson为随机取样的两个个体属于不同种的概率;Observed_otus为样本优化序列得到的 OUT数目。
(5)删掉 reads<20的 OTU,将相对丰度在所有样本中≥0.01和在所有样本中≥0.0001并且在某些样本中>0.01的OTU划为丰富类群,相对丰度在所有样本中<0.0001和在一些样本中<0.0001并都<0.01的OTU划为稀有类群。将筛选的丰富类群、稀有类群用于分析物种在进化过程中与环境因子的关系(Dai et al.,2017)。(6)基于 QIIME1.91使用“pick_closed_reference_otus.py”分析,获得的OTU表的biom文件用于BugBase预测,参考OTU预先计算的基因组含量预测生物样品中每个 OTU的性状覆盖率。在所有生物样品不同覆盖阈值下,计算特质丰度。这些丰度估计值用于标识覆盖率阈值,从而提供跨样本的最高方差。数据集中的OTU通过16S拷贝数进行归一化,并预测每种性状的微生物组表型,并将其绘制为每种样品的性状相对丰度(表型相对丰度)。
以最小显著差异法(LSD)检验不同年限根际土壤理化因子的差异情况,vegan包cmdscale函数作PCoA分析,并以adonis函数对群落显著性差异进行检验,RDA函数做冗余分析。以 indicspecies包strassoc函数寻找花椒不同种植年限指示种,然后用pheatmap包绘制热图。用ggtree包绘制进化树热图,系统发育树是使用邻接法构建的,可以分配给科级别的分类单元显示为科,否则显示为 OTU ID。K值是使用“picante”R包中的“multiPhylosignal”函数计算得出的进化信号。K值描述了在基于布朗运动的系统发生信号强度度量中,分类单元与系统发生的相关程度如何。K值接近零表示进化的随机或收敛模式,而K值大于1表示强烈的系统发生信号和性状保守性。其余图采用ggplot 2包绘制,上述数据处理过程和图的绘制均在R语言(4.0版本)中完成。
2 结果与分析
2.1 不同年限花椒林根际土壤理化性质
如表1所示,随着年限增加花椒根际土壤含水率呈现上升趋势,不同种植年限间出现差异,但未达到显著水平(P>0.05)。pH随着年限增加则出现先升高后降低的趋势,30 a与其他3个年限均未出现显著差异(P>0.05)。有效磷含量随着年限增加其含量先降低后升高,在10 a达到最低值。有机质、铵态氮、硝态氮含量随着年限增加呈现先降低后升高的趋势,均在20 a达到最低值。
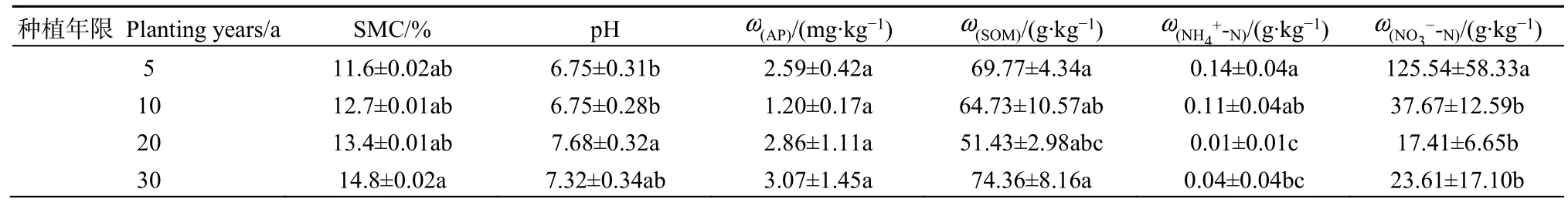
表1 不同种植年限花椒根际土壤理化因子Table 1 Physicochemical factors of rhizosphere soil of Zanthoxylum bungeanum in different planting years
2.2 不同年限花椒林根际土壤细菌α多样性分析
在97%分类水平下,不同年限Observed_otus、Chaol、Shannon和Simpson指数存在差异,但均未达到显著水平(P>0.05,图1)。Shannon指数可以同时反映群落丰富度以及均匀度,其值随着种植年限的增加而升高,即 5 a<10 a<20 a<30 a。Simpson指数可以指示优势物种相对丰度高低,其在5 a达到最低值,30 a达到最高值。Observed_otus、Chao1指数用来估计群落中实际存在的物种数,10 a花椒根际土壤样本的Chao 1指数和Observed_otus指数与其他3个种植年限相比最小,说明种植年限影响细菌的丰富度和多样性,但其影响程度在不同年限间差异较大。

图1 不同种植年限花椒根际土壤细菌群落多样性指数Fig.1 Bacterial community α diversity index of different planting years in the rhizosphere soil of Zanthoxylum bungeanum
2.3 不同种植年限花椒根际土壤细菌群落差异分析
本研究利用主坐标(PCoA)分析,通过分析不同样本群落组成,反映样本间的差异和距离(图2a),第一、二主轴共解释了样本信息的63.79%。10、20、30 a在0.95置信水平下,置信椭圆有重叠,说明随着种植时间的增加,根际细菌群落组成渐趋于相似。5 a与其他年限样本椭圆无重叠,说明它与其他年限细菌群落组成差异较大,Adonis检验结果说明4种年限细菌群落组成差异显著(r2=0.65,P<0.001)。为进一步探索细菌随花椒种植年限变化的潜在规律,通过指示种分析(图2b)得出,5 a差异指示种为 Firmicutes,10 a为 Cyanobacteria,20 a为Planctomycetes,30 a为 Entotheonellaeota。相对丰度图(图 3)也验证了随着种植年限的增加,Firmicutes相对丰度在 5 a较其他年限高,Cyanobacteria逐渐消失,Planctomycetes在20 a比较突出,30 a 则Entotheonellaeota相对丰度高于其他年限。

图2 不同种植年限根际土壤细菌门水平PCoA分析(a)和热图分析(b)Fig.2 PCoA analysis (a) and heatmap analysis (b) of rhizosphere soil bacterial phylum levels in different planting years
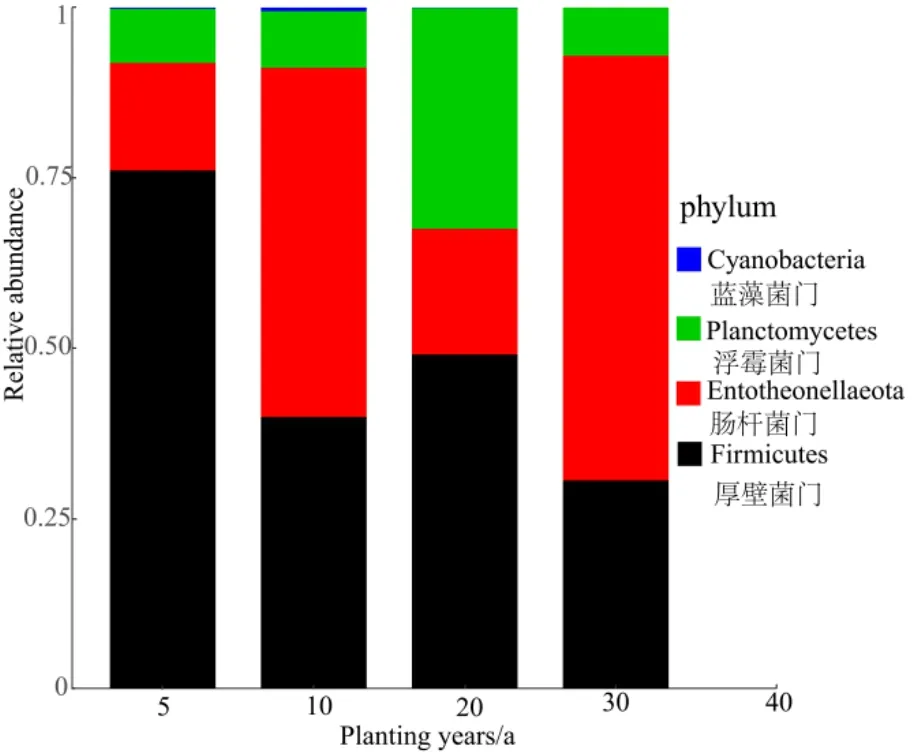
图3 不同种植年限根际土壤细菌差异指示种相对丰度图Fig.3 Relative abundance of difference indicator species in different planting years
不同年限花椒根际土壤细菌纲水平统计分析(图4)发现:Actinobacteria(放线菌纲)、Bacilli(芽孢杆菌纲)、Saccharimonadia、Subgroup 25随年限增加相对丰度逐渐下降;Thermoleophilia(嗜热菌纲)、Chloroflexia(绿弯菌纲)、Blastocatellia(Subgroup 4)、Acidimicrobiia(酸微菌纲)、Gemmatimonadetes(芽单胞菌纲)、MB-A2-108、NC10、TK10、Acidobacteriia(酸杆菌纲)、KD4-96、JG30-KF-CM66、Verrucomicrobiae(疣微菌纲)随着年限增加呈现先升高后降低的趋势。其中Thermoleophilia、Chloroflexia、Blastocatellia(Subgroup 4)、Gemmatimonadetes、NC10、Acidobacteriia、Verrucomicrobia在10 a达到最高值,Acidimicrobiia、MB-A2-108、TK10、KD4-96、JG30-KF-CM66在20 a达到最高值。

图4 不同种植年限根际土壤细菌纲水平相对丰度图Fig.4 Relative abundance of bacteria at class level in rhizosphere soils of different years
2.4 细菌群落结构与环境因子的相关性分析
RDA分析表明,第一、二主轴共解释了细菌门水平组成方差的56.35%(P<0.05,图5)。总体上,有机质是影响整个群落分布的首要因子。不同的菌门与各个环境因子相关性不同,环境因子与物种之间夹角为锐角,说明存在正相关关系,反之,钝角则为负相关关系。用筛选出的丰富类群(OTU)和稀有类群(OTU)分别做进化分析和潜在性状相关性分析(图6),放线菌为丰富、稀有类群中的优势菌门,并且总体上与潜在性状呈显著正相关(P<0.05)。此外,丰富分类群独有己科河菌门和硝化螺旋菌门,稀有类群特有厚壁菌门和Patescibacteria。总体上丰富类群与 SOM 呈现负相关,稀有类群与AP呈现负相关(P<0.05)。同时还发现,丰富类群与潜在性状的显著相关性较稀有类群多。通过计算K值发现稀有类群较丰富类群具有更强的发育信号(图7),说明稀有细菌比丰富细菌对农田生态环境偏好具有较强的系统发育保守性。
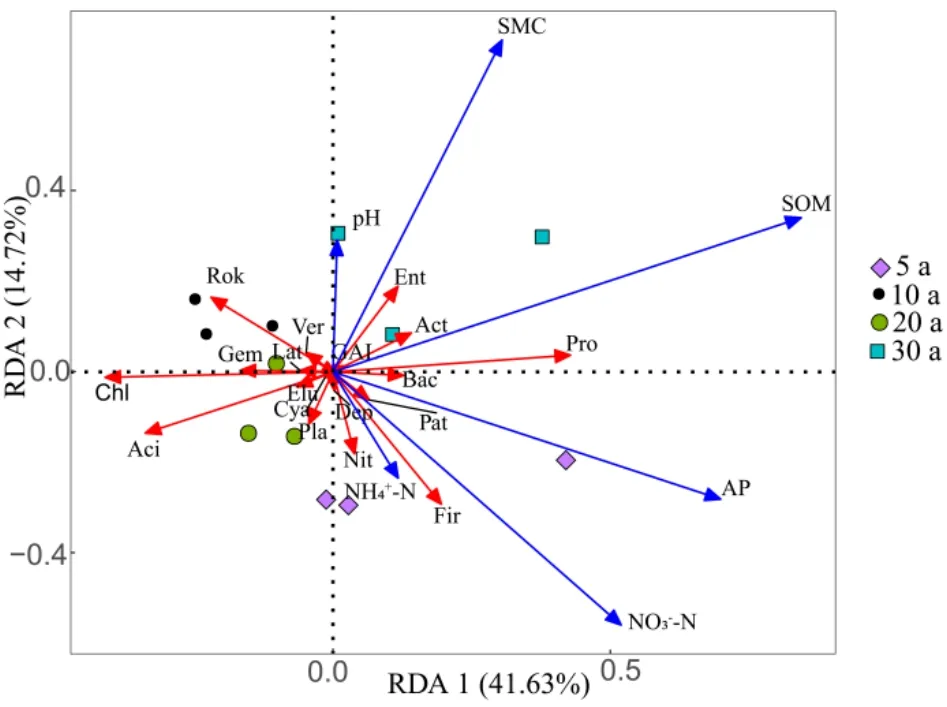
图5 基于门水平下土壤不同菌门与理化因子的冗余分析Fig.5 Redundancy analysis of different bacteria and physical and chemical factors in soil based on phylum level

图6 丰富类群与稀有类群的系统发育分布及其与环境因子的相关性分析Fig.6 The phylogenetic distribution of abundant taxa and rare taxa and their correlation analysis with environmental factors

图7 丰富和稀有类群的系统发生信号(布郎伯格K值)Fig.7 Phylogenetic signals of abundant and rare taxa (Blomberg’s K)
2.5 BugBase细菌表型预测分析
BugBase细菌表型预测结果表明,好氧细菌随着年限的增加呈现上升趋势(图 8),厌氧细菌随着年限的增加大体呈现下降趋势,酸杆菌门占主体地位(图9)。氧化胁迫耐受细菌总体看在20、30 a大于5、10 a,大部分取决于放线菌门的作用(图10),5、10 a致病潜力细菌高于20、30 a,主要是由酸杆菌门驱使的,归因于变形菌门丰度差异(图11)。

图8 不同种植年限根际土壤好氧菌的表型相对丰度Fig.8 Phenotypic relative abundance of aerobic bacteria in rhizosphere soil of different planting years

图9 不同种植年限根际土壤厌氧菌的表型相对丰度Fig.9 Phenotypic relative abundance of anaerobic bacteria in rhizosphere soil of different planting years
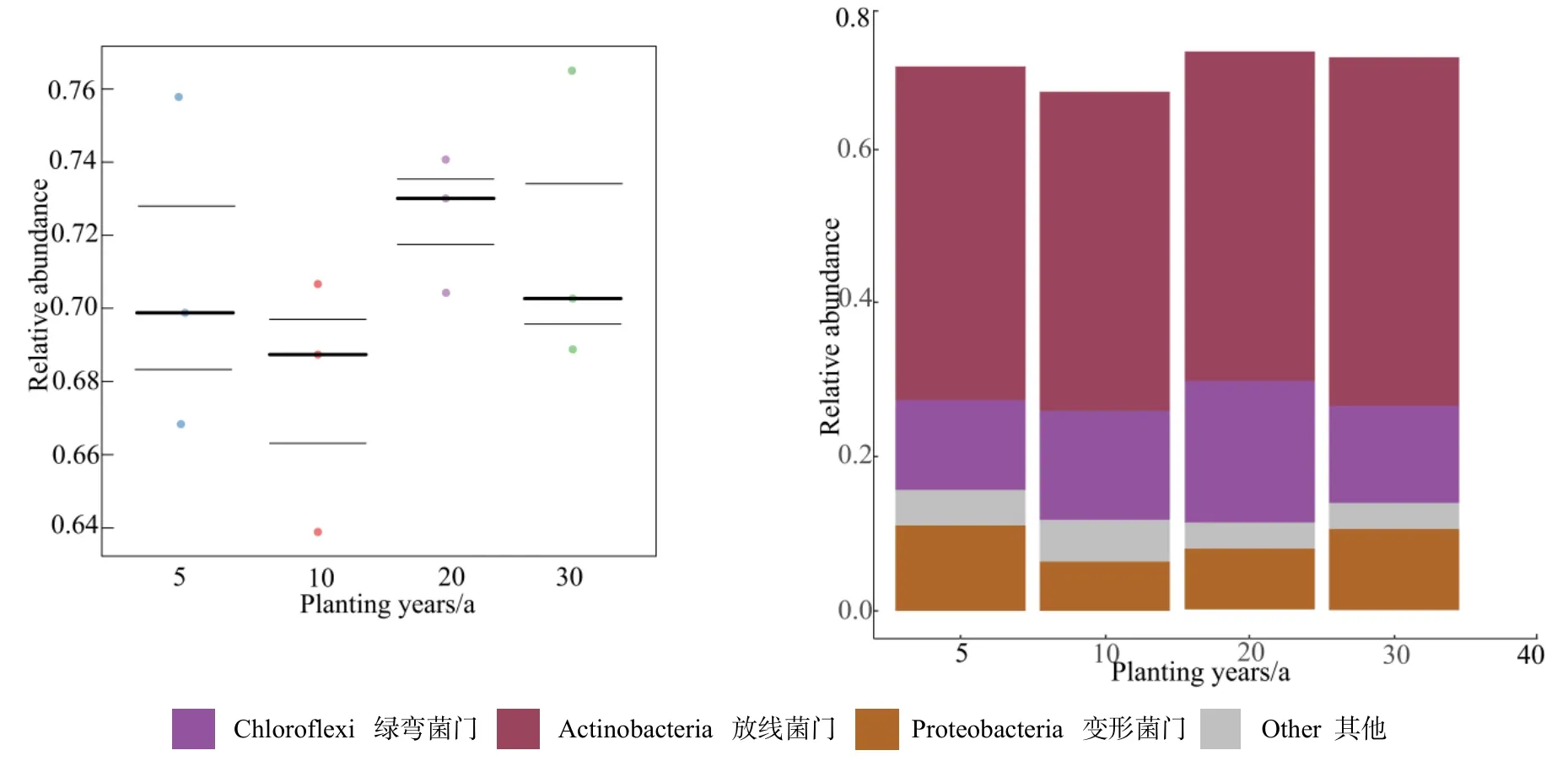
图10 不同种植年限根际土壤氧化耐受胁迫菌的表型相对丰度Fig.10 Phenotypic relative abundance of oxidative stress-tolerant bacteria in rhizosphere soil of different planting years

图11 不同种植年限根际土壤致病菌的表型相对丰度Fig.11 Phenotypic relative abundance of pathogenic bacteria in rhizosphere soil of different planting years
3 讨论
中国西南喀斯特是岩溶发育最强烈的地区,由于碳酸盐岩的风化溶蚀和地表径流的冲刷过程逐渐形成石槽、石沟、石坑等微地貌造成喀斯特地区土层厚度不均、分布不匀,农业可持续利用的土地少之又少(黄钰铃等,2006),花椒作为当地恢复退化喀斯特生态环境的重要物种,研究根区土壤环境对花椒的生长发育有着积极的意义。本研究对土壤理化性质的分析发现,随种植年限的增加根际土壤含水率、pH、有效磷含量呈现上升趋势,这可能与花椒根系扩散速率提高,大量根毛利用地表浅层水能力上升有关(牛晓丽等,2014)。此外花椒属于喜钙物种,易吸收钙镁等离子,使得根际凝聚大量盐基离子导致pH升高(车家骧等,2008)。随着pH的增加,磷元素易被土壤黏粒和阳离子(Fe3+、Ca2+和Al3+等)吸附、固定(秦昌鲜等,2019),此时植株会诱导根系分泌更多磷酸酶或植酸酶,进而有效地促使难溶性磷水解转化成植物根系直接利用的磷,提高了根际磷素的利用效率(李慧敏等,2020)。本研究还发现有机质、铵态氮、硝态氮含量呈现先降低后升高的趋势,是因为随着花椒生长,根系分泌酸类、多聚物类和碳水化合物质增多(罗永清等,2019),从而影响微生物大量繁殖,种间竞争加速了有机质的分解(李艳春等,2019;张强等,2009)。而土壤氮素水平与有机质密切相关,间接促进了土壤铵态氮、硝态氮的供给。
植物-土壤之间的相互作用影响着微生物群落变化,而土壤细菌群落多样性水平对保持农田生态系统稳定和功能恢复起决定性的作用(王秋红等,2018)。有研究发现,植被群落多样性提高,有助于促进地下部分有益拮抗菌的聚集生长(Latz et al.,2012),本研究中随着年限增长,花椒根际土壤细菌群落结构多样性逐渐提高,但在发育初期细菌群落优势物种相对丰度低于发育后期,可能是因为根系通过向土壤中分泌大量有机碳和抗菌等物质“招募”对其生长发育有益的根际促生菌在根系周围聚集,使得发育初期和后期细菌组成出现差异(葛艺等,2019)。还有研究表明,药用植物怀牛膝(Achyranthesbidentata)在长期种植后,根际土壤微生物中养分循环相关微生物增加,其品质、产量等得到提高(于佳月,2019),推测花椒长期种植吸引了更多参与土壤养分物质循环的物种导致多样性提高。其次,不同年限根际土壤中出现差异物种,是因为植物具有根际选择作用且不同阶段对微生物的喜好不同(Hartmann et al.,2009)。本研究中5 a根际土壤中厚壁菌门作为差异指示种,可能是因为在花椒发育初期土壤中像有机质等营养物质较高,吸引发酵和固氮性物种聚集。到中后期光合作用的增强,根系分泌的光同化物产物的增多影响了不同物种对资源的利用倾向(田平雅等,2020;Pérez et al.,2019)导致光合放氧,生物固氮的Cyanobacteria(蓝藻菌门)和在缺氧环境下能利用亚硝酸盐(NO2−)、氧化铵离子(NH4+)生存的Planctomycetes(浮霉菌门)的富集(陆玉芳等,2020)。但随着发育时间的增加群落结构组成会逐渐相似。大量研究报道了土壤理化性质也是影响土壤细菌群落组成的重要因素(陈海滨等,2016;Pei et al.,2016;Zhalnia et al.,2015)。本研究中随着种植时间的增加根际含水率呈上升趋势,而肠杆菌对含水率比较敏感且它的纤毛对植物根的粘附能力很强导致在 30 a其相对丰度增加。随着年限增加,放线菌纲、芽孢杆菌纲呈现下降趋势,而绿弯菌纲、嗜热菌纲、芽单胞菌纲、酸杆菌纲在10 a出现最高值,酸微菌纲在20 a出现最高值,说明随着种植时间的增加,进行化学循环细菌的改变可能会影响土壤肥力变化。基于农业土壤细菌群落,有研究发现丰富类群会竞争性地利用多种资源并得到很好的适应(Pedrós-Alió et al.,2006),而稀有类群的竞争能力较低,生长会受到限制(Ramiro et al.,2015)。本研究中与丰富类群相比,稀有类群具有更强的系统发生信号,表明花椒根际土壤环境可能更适应稀有类群,稀有类群作为微生物的“种子库”,它们可以在适当条件下成为优势种,从而增加抗环境干扰的能力。(Jiao et al.,2020)。对不同年限根际土壤的BugBase预测得到,种植时间越长土壤好氧细菌丰度越高,相反,厌氧细菌的生长就会受到抑制。酸杆菌门喜欢厌氧和微氧环境,根际较低pH值(分泌有机酸)有利于酸杆菌某些亚群的生长,但根际的高营养环境又不适于酸杆菌的生存,因此根际微环境的差异导致不同年限根际酸杆菌不一致(王光华等,2016)。致病菌在前期比例较高,表明花椒在发育初期受病原菌侵染的风险较高,随着一定时间发育根际氧化胁迫耐受菌增加使得花椒抗病原菌侵染的能力上升。耐受菌大部分属于革兰氏阳性菌,而致病菌多属于革兰氏阴性菌,一般认为酸杆菌门和硝化螺旋菌门不具有致病性,所以推测花椒潜在致病菌来源于变形菌门。有研究发现放线菌门具有抗压和抗病原菌感染的能力(Vries et al.,2020),在本研究中放线菌门作为稀有和丰富类群中主要菌门,因此它可能在花椒适应环境胁迫中具有重要潜能。研究表明土壤中致病菌丰度较高导致作物发病,其分泌有毒有害物质会造成植株矮黄、生长不良、根系分叉多等不良影响,最终导致作物减产(周文杰等,2016)。因此建议在花椒发育前期进行合理有机栽培管理,适当翻耕,以促进微生物与植物互作,提高作物抗性。
4 结论
长期种植花椒导致根际土壤有效磷、有机质、硝态氮、铵态氮含量先降低后升高,表明花椒长期种植在一定程度上改善了土壤质量,对喀斯特生态环境恢复有促进作用。测序结果表明,花椒根际细菌群落多样性随种植年限增加而增加,丰富度在10 a时显著降低(与种植5 a和20、30 a花椒相比),表明花椒根际土壤细菌群落丰度和多样性受种植年限影响较大。对微生物群落结构分析发现,在不同种植年限花椒根际土壤中细菌群落结构发生显著改变。RDA分析结果表明土壤有机质是影响花椒根际土壤微生物群落结构变化的重要因子。表型预测分析发现随着种植时间的增加,花椒根际抗胁迫耐受物种的增加降低了潜在致病风险。
