新疆黄萎病发病程度不同棉田土壤细菌群落结构差异分析
2021-03-09刘海洋张仁福王伟杨寒丽姚举
刘海洋,张仁福,王伟,杨寒丽,姚举*
1.新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,新疆 乌鲁木齐 830091;2.巴州农业技术推广中心,新疆 巴音郭楞蒙古自治州 841000
新疆棉区棉花黄萎病发生日趋严重(刘海洋等,2018),但是目前针对该病的生态防控技术相对缺乏。土壤细菌中含有大量具有拮抗、促生作用的有益微生物,调控土壤微生物群落结构或改变微生物功能多样性对土传病害防控有积极作用(李斌等,2006;李胜华等,2009)。研究认为,土壤类型是形成土壤细菌功能群落的决定性因素(İnceoglu et al.,2012),而pH值、土壤水分是土壤细菌群落结构变化的主要驱动力(Bainard et al.,2016),此外,农业管理方式、种植作物种类、病原菌入侵(顾美英等,2009)等因素同样会影响土壤细菌多样性(Marschner et al.,2001;Suzuki et al.,2009;Tóth et al.,2017)。李雪萍等(2017)发现青稞根腐病的发生减少了作物根际土壤细菌和放线菌数量,而Yu et al.(2019)研究西瓜(Citrullus lanatus)根际细菌群落发现,接种尖孢镰刀菌(Fusariumoxysporum)不仅增加了西瓜根际细菌群落的多样性,同时激发了有益菌群的数量。Rosenzweig et al.(2012)亦发现在利于马铃薯(Solanumtuberosum)赤霉病发病的土壤中芽胞杆菌属(Bacillus)的丰度显著高于马铃薯赤霉病抑病土壤;Anees et al.(2010)同样报道,立枯丝核菌(Rhizoctoniasolani)病区内木霉菌(Trichoderma)的丰度高于健康区域,且病区分离的木霉菌比健康区的木霉菌拮抗作用更强,但Luan et al.(2012)发现棉花黄萎病株根际土壤中木霉菌等有益菌群的数量显著低于健康棉株,与Anees et al.(2010)研究结论相反。前人研究表明,土壤中有益细菌种群对土传病害发生的响应存在争议,且目前有关棉花黄萎病发生与土壤细菌群落尤其有益菌群相关性的研究较少,缺乏对棉田土壤有益细菌种群参与棉花黄萎病发生变化过程的了解。为此,本文采用Illumina Hiseq 2500测序平台对新疆黄萎病发生程度不同棉田土壤细菌群落的结构特征进行分析,揭示新疆棉田土壤黄萎病变化过程中细菌群落多样性变化、结构差异及主要影响因素,分析土壤细菌群落尤其有益菌群在棉花黄萎病发生过程中的作用,为提高新疆棉花黄萎病的生态防控技术水平提供理论依据。
1 材料与方法
1.1 供试土壤
2016年在阿克苏市( 40°36′55.86″N,81°18′47.69″E )、库尔勒市( 41°45′9.05″N,85°52′43.11″E)以及石河子市(44°19′8.17″N,85°59′26.44″E)分别选择棉花黄萎病代表性的重病田与无(轻)病对照田各1块,3地共计6块棉田(刘海洋等,2019)。于8月在重病田采集发病等级3级以上棉株根围土壤,对照田采集健康棉株根围土壤,每块棉田3点取样,每取样点间隔50 m,每点取0—20 cm土层5份土样,每份200 g,混合为1份土壤样品。共计18份混合样品,经2 mm孔径过样筛处理,保存于−80 ℃冰箱备用,棉田土壤样品类型及编号见表1。
表1 棉田土壤样品类型及编号Table 1 Type and serial number of cotton field soil samples
1.2 采样棉田信息
阿克苏棉花黄萎病重病田(Aksu serious disease field,AD)为自然发病棉田;对照田(Aksu disease-free field,ACK)为相邻的无病棉田,该棉田前期为棉花黄萎病重病田,经水稻轮作后变为无病田,种植棉花品种均为中棉49号。石河子棉花黄萎病重病田(Shihezi serious disease field,SD)、轻病对照田(Shihezi mildly disease field,SCK)均为自然棉田,种植棉花品种均为新陆早64号。库尔勒棉田原为一整块条田,从中间一分为二,一块从2014年开始每年人工接种棉花黄萎病菌改造成重病田(Korla serious disease field,KD),另一块未接种病原菌的作为对照田(Korla mildly disease field,KCK),种植品种均为新陆中66号。
以上棉田均为覆膜滴灌棉田,每个区域重病田与对照田的管理措施一致。棉田病情指数、土壤理化性质等数据见表2。

表2 采样棉田土壤理化性质、病情指数和微菌核数量信息Table 2 Physical and chemical properties, disease index and microsclerotium amount of cotton soil in different regions
1.3 土壤DNA提取与文库构建、测序
利用北京百泰克生物技术公司生产的 DP4001土壤试剂盒,严格按照操作步骤提取土壤总DNA,利用1%琼脂糖凝胶电泳检测提取的DNA质量,使用Nano Drop 2000 UV-Vis光谱仪测定DNA浓度,总量满足 3次及以上建库要求。所用引物为细菌16SrDNA(V3+V4)区域引物,338F:5′-ACTCCTAC GGGAGGCAGCA-3′;806R:5′-GGACTACHVGGG TWTCTAAT-3′。PCR 扩增程序:98 ℃预变性 2 min;98 ℃变性30 s,50℃退火30 s,72 ℃延伸1 min,25个循环;72 ℃延伸5 min。由北京百迈客生物科技有限公司构建 DNA文库,采用 Illumina Hiseq 2500 PE250模式进行测序。
1.4 数据处理与分析
对测序获得的原始数据使用FLASH V1.2.7软件(Magoč et al.,2011),按照最小重叠长度 10 bp、重叠区最大错配比率0.2对每个样品的序列进行拼接,得到的拼接序列即原始序列。将拼接得到的序列用Trimmomatic软件设置50 bp的窗口,过滤质控后长度小于标签长度75%的标签,使用UCHIME软件(Edgar et al.,2011)并去除嵌合体,得到高质量的序列。在相似性97%的水平上使用UCLUST软件(Edgar,2010)对序列进行聚类,以所有序列数的0.005%作为阈值过滤OTU。在细菌16S Silva数据库(Quast et al.,2012)进行比对,在置信度阈值为0.8利用RDP Classifier软件(Wang et al.,2007)进行物种注释分类。利用 PyNAST软件(Caporaso et al.,2010)进行多重比对,邻接法建树。利用Mothur version V.1.30软件(Schloss et al.,2009)进行Alpha多样性指数分析,包括ACE指数、Chao1指数、香农-威纳指数;基于Bray curtis算法呈现物种多样性矩阵,进行 Beta多样性分析(n≥3),绘制样本非度量多维尺度分析以及环境因子与样本组成冗余分析。利用LEfSe分析方法设定显著差异的LDA值为4.0,寻找组间丰度差异显著物种。
利用Excel软件对数据进行整理、汇总及相关系数等计算分析,利用SPSS 19.0软件中的Duncan分析法对数据进行单因素方差分析,P<0.05为差异显著。
2 结果与分析
2.1 棉田土壤细菌的Alpha多样性分析
在97%相似度水平下,阿克苏、石河子两地重病田土壤细菌的OTU数量及ACE指数、Chao1指数、Shannon-Wiener指数均高于各自无(轻)病对照田土壤,但是各项指数均未达显著性差异(P<0.05)。石河子重病田土壤细菌的 OTU 数量低于对照田土壤,无显著差异,ACE指数、Chao1指数均显著低于对照田土壤,而Shannon-Wiener指数显著高于对照田土壤。综合来看,三地重病田土壤细菌的Shannon-Wiener指数均高于对照田土壤,黄萎病的发生在一定程度上增加了土壤的细菌多样性(见表3)。

表3 采集土壤中细菌Alpha多样性指数Table 3 Alpha diversity index of bacterial community in soil samples
2.2 棉田土壤细菌群落的聚类分析
聚类分析发现,阿克苏重病田样品 an8b1、an8b2、an8b3单独聚为一支,对照田土壤样品a8w1、a8w2、a8w3单独聚为一支,土壤细菌群落结构差异明显(图1a);石河子重病田样品sn8b1、sn8b2、sn8b3单独聚为一支,对照田样品bn8w1、bn8w2、bn8w3同样聚为一支,土壤中细菌群落组成差异明显(图1b)。而库尔勒土壤样品聚类分析结果与阿克苏、石河子均不同,来自轻病对照田的k8c1单独聚为一支,来自重病田的k8v1、k8v2、k8v3与来自对照田的k8c2、k8c3聚在一支,且来自重病田的k8v2与来自对照田的k8c2聚为一支,库尔勒重病田和对照田土壤细菌群落具有较高的相似性(图1c)。
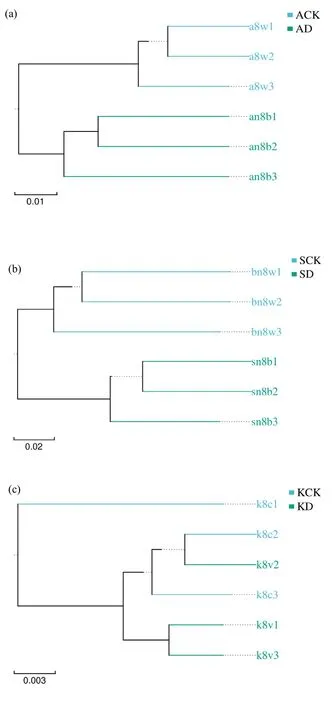
图1 土壤样品中细菌群落聚类分析Fig.1 Cluster analysis of bacterial community in different soil samples
2.3 土壤中细菌属分类水平有益种群分析
阿克苏、石河子、库尔勒三地棉田土壤中细菌属分类水平丰度前 20的种群中能分类到属的有Sphingomonas、溶杆菌属(Lysobacter)、假单胞菌属(Pseudomonas)和Haliangium(0.81%—2.0%)(见图 2),其中溶杆菌属、假单胞菌属包含多种对病原真菌具有拮抗作用的菌群,分析发现溶杆菌属在阿克苏AD组土壤中的丰度值为3.67%,显著高于ACK组(2.35%);在库尔勒KD组(1.05%)和对照 KCK组(1.37%)之间以及在石河子 SD组(1.15%)和SCK组(0.97%)之间均没有显著差异。假单胞菌属在阿克苏 AD组土壤中的丰度值为3.15%,极显著高于 ACK组(0.18%);在库尔勒KD组(1.73%)和对照KCK组(1.67%)之间没有显著差异,在石河子 SD组(0.18%)、SCK组(0.29%)之间同样没有显著差异。芽胞杆菌属包含大量的有益拮抗菌,分析发现其在新疆棉田土壤中并不是优势菌群,丰度比例较低,该属在 AD组(0.13%)和ACK组(0.23%)、KD组(0.11%)和KCK组(0.09%)、SD组(0.10%)和SCK组(0.11%)之间均无显著性差异。链霉菌属(Streptomyces)同样在AD组(0.23%)和ACK组(0.26%)、KD组(0.21%)和KCK组(0.37%)、SD组(0.26%)和SCK组(0.30%)之间均无显著性差异。

图2 棉田土壤属水平细菌种群组成分析Fig.2 Bacterial communities in rhizosphere soil of cotton on genus level
综合来看,溶杆菌属和假单胞菌属在阿克苏重病田土壤中的丰度均显著高于无病田对照,而芽胞杆菌属和链霉菌属的丰度在阿克苏、石河子和库尔勒三地重病田与对照田之间均无显著差异。
2.4 棉田土壤细菌群落的组间差异分析
LEfSe分析发现,当LDA值≥4.0时,阿克苏AD组中的显著差异种群为变形菌门(Proteobacteria)、γ变形菌纲(Gammaproteobacteria)、黄单胞杆菌目(Xanthomonadales)以及假单胞菌目(Pseudomonadales)、假单胞菌科(Pseudomonadae)、假单胞菌属,ACK组土壤中显著差异种群为酸杆菌门(Acidobacteria),显著差异物种主要集中在AD组土壤中(图3a)。石河子SD组土壤中的显著差异种群为放线菌门(Actinobacteria);SCK组中的显著差异种群为酸杆菌门(Acidobacteria)、Blastocatellia、Blastocatellales、Blastocatellae_Subgroup_4,显著差异种群主要集中在SCK组中(图3b)。而库尔勒人工接种KD组与KCK组之间的细菌种群在门至属分类水平上都没有显著差异种群(图3c)。

图3 不同土壤细菌种群组间差异分析Fig.3 Analysis of the difference between bacterial populations in different soil samples
2.5 土壤理化性质与细菌多样性的相关性
由表4可知,土壤pH值与土壤细菌的OTU数量和ACE指数、Chao1指数、Shannon指数均呈显著正相关,表明在一定区间内,土壤pH值升高对土壤细菌的丰度和多样性有促进作用;土壤总盐含量与土壤细菌OTU数量和ACE指数、Chao1指数、Shannon指数均呈显著负相关,土壤总盐含量升高,对土壤细菌的丰度和多样性有抑制作用。全钾含量与土壤细菌OTU数量以及ACE指数、Chao1指数正相关,土壤碳氮比与土壤细菌的OTU数量、ACE指数、Chao1指数、Shannon指数均负相关。土壤有机质、全氮、全磷含量均与土壤细菌的 OTU数量和Alpah指数无显著相关。
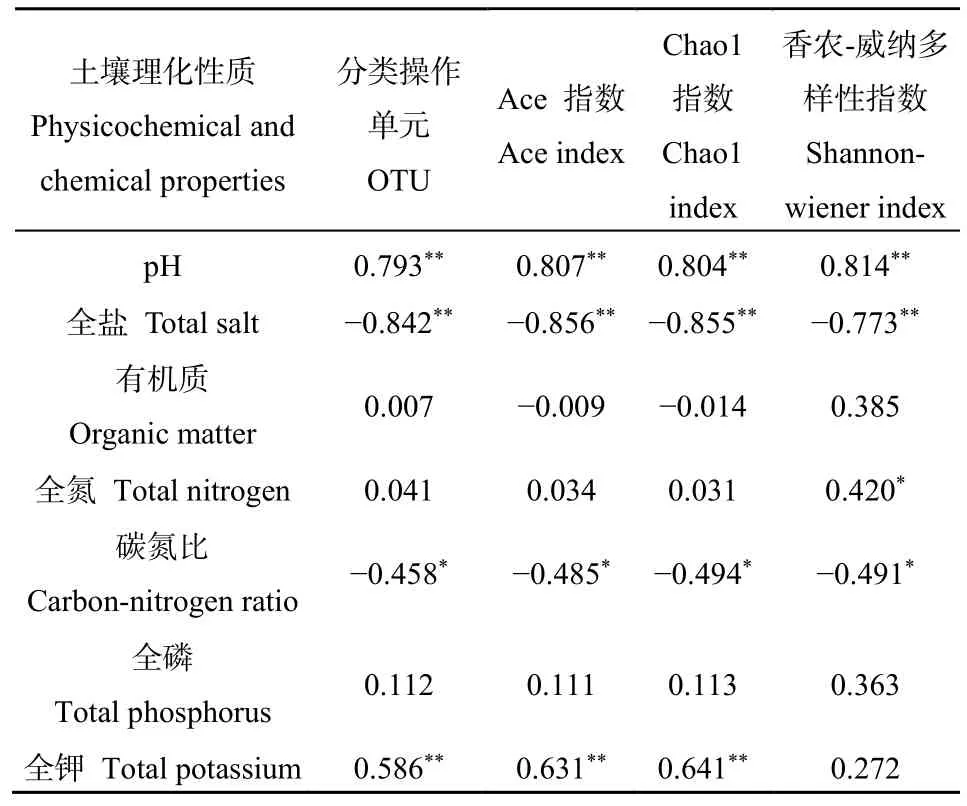
表4 土壤理化性质与细菌多样性指数的相关系数Table 4 Correlation analysis of soil physical and chemical properties with bacterial diversity index
2.6 土壤理化性质、发病程度与细菌种群的冗余分析
2.6.1 土壤理化性质与细菌种群的冗余分析
根据图4可知,土壤理化性质与丰度前20的细菌种群的相关程度较高,其中节杆菌属、黄单胞菌属、类诺卡氏菌属(Nocardioides)、Sphingopyxis、Defluviicoccus、Ilumatobacter、Pelagibius与土壤全盐(TS)呈显著正相关。Bryobcter、Sphingomonas、Nitrospira与土壤 pH 值显著正相关。Altererythrobacter、Lysobacter、Thermomonas与土壤全钾(TK)显著正相关,Sterioidobacter与 TK负相关。Blastocatella、芽单胞菌属(Gemmatimonas)、Haliangium 与土壤中全氮(TN)、有机质(OM)含量呈显著正相关,假单胞菌属、Arenimonas、Iamia与土壤中全氮、有机质含量呈显著负相关。
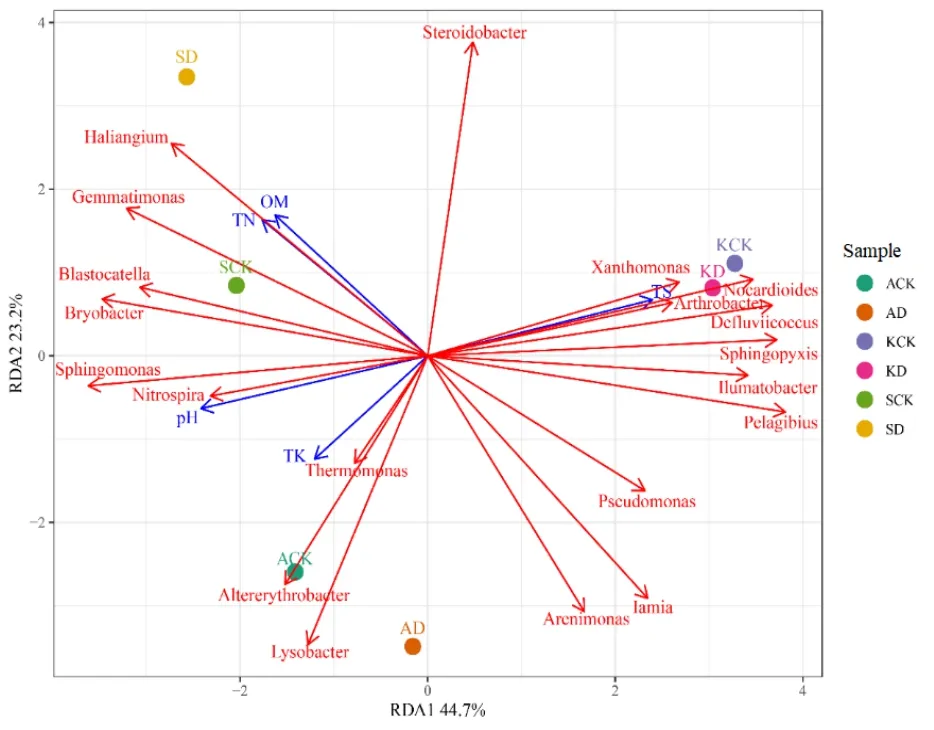
图4 土壤细菌群落与土壤理化性质的冗余分析Fig.4 Redundancy analysis of soil bacterial community with soil physical and chemical properties
2.6.2 发病程度与细菌种群的冗余分析
由图5中看出,土壤丰度前20的细菌属中仅热单胞菌属(Thermomonas)、Steroidobacter与棉田发病程度(DI,病情指数)显著正相关,而其余18个细菌属与棉田黄萎病的发生程度无明显相关性。
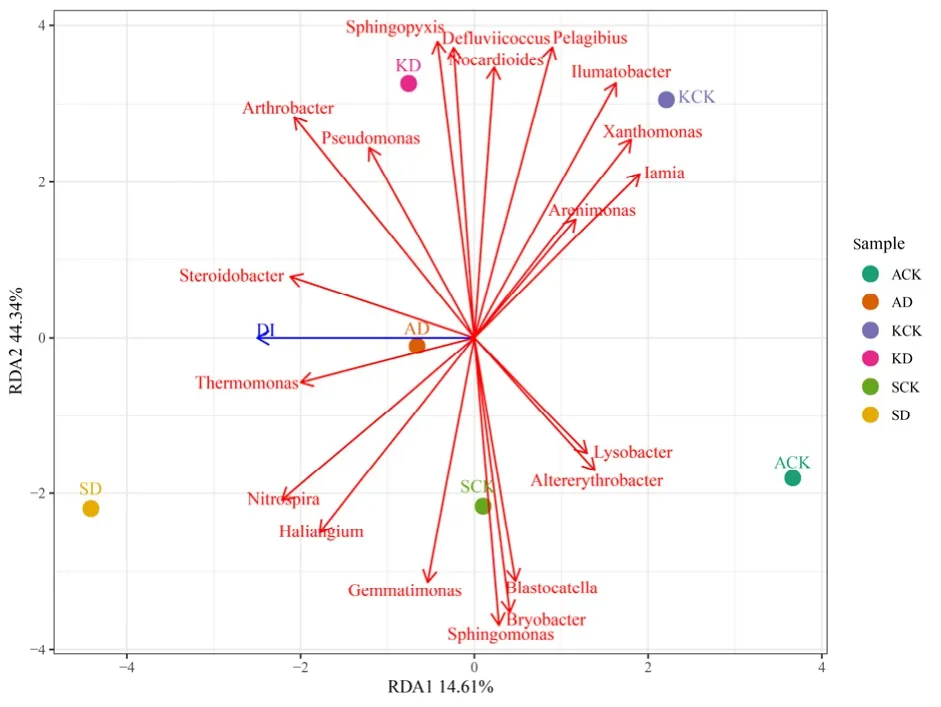
图5 病情指数与土壤理化性质的冗余分析Fig.5 Redundancy analysis of soil bacterial community with the disease index
3 讨论
3.1 田间病情对土壤细菌群落多样性和种群结构无显著影响
抑病性土壤能够提供丰富的微生物资源,被应用于植物土传病害的生物防治中,但在农业生态系统中还未充分认识到这一现象的功能并加以应用(Mazzola,2004),本研究旨在探究新疆不同发病程度棉田土壤是否存在有益菌群的差异,并了解棉花黄萎病发生对棉田土壤细菌群落的影响。前人报道,西瓜接种尖孢镰刀菌增加了其根际细菌群落多样性的同时激发了有益菌群(Yu et al.,2019),马铃薯赤霉病土壤中含有大量拮抗菌的芽胞杆菌属,其丰度显著高于抑病土壤(Rosenzweig et al.,2012),立枯丝核菌病区内的木霉菌丰度和拮抗作用均高于健康区域(Anees et al.,2010),以上研究均表明土壤中病原菌与有益菌群具有某种互作关系。本研究发现,阿克苏、石河子、库尔勒三地重病田土壤中细菌的Shannon指数均高于对照田,其中石河子重病田 Shannon指数显著高于其轻病对照田,与Yu et al.(2019)研究认为病原菌侵染增加了土壤细菌多样性的结论较为一致。但本文未发现在库尔勒人工接种重病棉田和对照田土壤中的有益细菌种群如溶杆菌属(Jochum et al.,2006;Ji et al.,2008;Ko et al.,2009)、假单胞菌属(Kloepper et al.,1980)、链霉菌属(Sabaratnam et al.,2002)、芽胞杆菌属存在显著差异,这与Rosenzweig et al.(2012)和 Anees et al.(2010)认为病原菌的存在激发了土壤中芽胞杆菌属、木霉菌等有益菌丰度的研究结果不同,而Lioussanei et al.(2010)报道番茄接种烟草疫霉菌(Phytophthoranicotianae)未对番茄根际细菌群落结构产生显著影响,本研究与该研究结论有较好的一致性。与此同时,本研究发现库尔勒人工接种重病田与其对照田土壤之间细菌群落相似度很高,无显著差异的种群,说明土壤细菌群落结构受病原菌的影响较小。
3.2 土壤理化性质对细菌群落多样性和种群结构影响显著
土壤pH值、含水量、电导率以及碱解氮、有效磷等养分含量等多种因素与土壤细菌群落结构的变化有关(Preem et al.,2012;Yang et al.,2017)。然而,Shen et al.(2016)研究发现在集约化管理的生态系统中高施氮量会导致土壤次生盐碱化和酸化,从而降低土壤细菌系统类型丰富度和系统发育多样性,细菌群落与土壤pH值呈正相关,与土壤电导率呈负相关。Bainard et al.(2016)、Meng et al.(2019)也一致认为pH是影响土壤细菌群落结构和多样性的主要因素。Zheng et al.(2019)研究番茄田间细菌群落多样性与青枯病(Ralstonia solanarum)严重程度的关系发现,健康土中变形菌门的丰度较高,酸杆菌门的丰度较病土低。青枯雷尔氏菌丰度与全氮、土壤 pH、有机碳、总磷、总钾呈显著相关,与绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和浮霉菌门(Planctomycetes)的丰度呈正相关,与硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)的丰度呈负相关。本研究发现,土壤理化性质是造成阿克苏、石河子两地重病棉田与其对照棉田土壤中细菌群落结构显著差异的原因,土壤pH值、总盐含量是影响细菌群落多样性及其种群结构的主要因素,其中pH值与细菌群落多样性呈显著正相关,总盐与细菌群落多样性呈显著负相关,结论与前人研究一致,而全氮、全磷、有机质与细菌群落多样性相关不明显,Marschner et al.(2001)亦发现氮肥对土壤细菌群落结构没有显著影响,本文研究结论与前人一致。
3.3 其他因素对土壤细菌群落多样性的影响
土地利用历史、作物品种、轮作等管理措施对土壤细菌群落影响显著。Bainard et al.(2016)发现细菌群落在作物整个生长季出现时间变化,细菌群落变化与土壤水分及湿度、温度等因素息息相关,Kang et al.(2004)报道土壤细菌群落结构有强烈的时间趋势,空间分异明显,也认为细菌群落差异与土壤含水量有显著的相关性。作物轮作是控制土传病害的传统方法,但是Navarro-Noya et al.(2013)发现小麦(Triticumaestivum)-玉米轮作对土壤细菌群落结构影响不显著,Bainard et al.(2016)也报道土壤细菌群落的变化不受作物(小麦、小扁豆Polygalatatarinowii、豌豆Pisum sativum、欧洲油菜Brassicanapus)种类的影响,而是土壤环境因子削弱或平衡了作物对土壤细菌群落的影响。Suzuki et al.(2009)亦认为土壤类型对细菌群落的影响大于施肥。İnceoglu et al.(2012)同样发现土壤类型是形成马铃薯根际细菌功能群落的最具决定性参数,但其肯定了作物品种对微生物群落结构有显著影响,不同作物品种对微生物群落的利用存在差异。
综合前人研究来看,土壤理化性质、土壤类型、土壤水分等是影响土壤细菌群落的主要因素,植物种类、作物轮作等因素对土壤微生物群落结构的影响存在一些争议。土传病害的减轻与土壤中病原菌减少、病原菌致病力下降或有益微生物种群的增多有关,本文观察到棉花黄萎病重病田在2015年种植水稻后棉花黄萎病菌消失变为无病田(ACK),但在病情变化过程中未观察到ACK组中芽胞杆菌属、假单胞菌属等有益菌群显著高于AD组的证据,反而AD组中溶杆菌属和假单胞菌属丰度均显著高于ACK组,与Rosenzweig et al.(2012)和Anees et al.(2010)的研究结果相近。Larkin et al.(2011)田间首季种植白芥菜(Sinapis alba)+东方芥菜(Brassicajuncea)、高粱(Sorghum bicolor)-苏丹草(Sorghumsudanense)杂交种两种绿肥后显著减轻了后茬的马铃薯黄萎病,然而第二季种植再两种绿肥后黄萎病依然发生严重,前期种植历史对病害或土壤微生物群落的显著影响减弱了,加之 Bainard et al.(2016)、Navarro-Noya et al.(2013)均认为作物对土壤微生物没有显著影响,而土壤水分的变化会显著影响土壤微生物群落结构(Kang et al.,2004;Bainard et al.,2016)。本文综合分析认为可能是由于土壤水分等非生物操作因素减轻了棉花黄萎病的发生(ACK),而不是由于土壤中有益种群的变化造成的。
4 结论
(1)阿克苏、石河子、库尔勒三地重病棉田土壤中细菌的Shannon-Wiener指数均高于对照田,其中石河子重病田土壤细菌的Shannon指数显著高于对照田,黄萎病的发生增加了棉田土壤的细菌多样性,但土壤细菌的OTU数量、ACE指数和Chao1指数在不同区域的棉花黄萎病发病程度不同棉田之间没有一致规律。阿克苏、石河子两地重病棉田均分别与其对照棉田土壤中细菌群落差异明显,而库尔勒人工接种重病棉田与对照田土壤中细菌群落相似性较高,无显著差异种群。病原菌入侵对土壤细菌群落结构的影响较小。
(2)土壤细菌多样性、种群结构受土壤理化性质影响显著,其中土壤pH值、总盐是主要影响因子,棉田土壤细菌的OTU数量、Alpah多样性指数与土壤pH值、全钾含量呈显著正相关,与总盐含量、碳氮比呈显著负相关,与有机质、全氮、全磷含量及棉田发病程度无明显相关。
(3)棉田土壤中有益菌群在库尔勒人工接种重病棉田土壤中的丰度与对照田无显著差异,溶杆菌属和假单胞菌属在阿克苏重病棉田土壤中的丰度显著高于无病对照田,石河子重病田土壤中显著富集了放线菌门,未发现有益细菌种群参与黄萎病减轻或加重过程的证据,非生物因素可能是减轻棉花黄萎病发生的主要原因。
