泾渭茯砖茶发酵过程中霉菌的变化
2021-03-02伍金金吕嘉枥胡歆史朝烨
伍金金,吕嘉枥,胡歆,史朝烨
(1.陕西科技大学食品与生物工程学院,陕西西安 710021)(2.咸阳泾渭茯茶有限公司,陕西西安 710089)
茯砖茶是中国传统黑茶,起源于陕西泾阳,主要经过毛茶选配、筛制拼配、汽蒸渥堆、压制定型、发花干燥和成品包装[1]精制而成。其中发花干燥是茯砖茶加工过程中的关键技术,发花时期茶砖的温度、湿度对最终发花率和成品质量有重要影响[2]。“发花”是一个复杂微生物菌群相互作用的过程,“金花菌”是其中的优势菌群[3]。目前对于茯砖茶中“金花菌”的鉴定研究较多,产区不同,鉴定的结果也不尽相同[4-7],其中陕西茯砖茶中“金花菌”优势菌鉴定为冠突曲霉,异名冠突散囊菌[8]。对于发花过程中的霉菌的变化研究,多集中在湖南、浙江、四川等地区,陕西茯砖茶发花过程中霉菌的变化研究较少[9]。例如,赵仁亮[10]从湖南冬夏两季节发花过程中的茯砖茶中共分离出27株真菌,其中有黑曲霉、青霉、冠突曲霉、其他曲霉、芽枝霉、毛霉、镰刀菌、木霉和酵母菌。胡治远[11]等对湖南地区茯砖茶加工过程中的霉菌的变化进行研究,发现渥堆期主要是黑曲霉、青霉、根霉为主;发花后期,茶叶被压成砖后则以“金花菌”冠突曲霉为主,占微生物总量的90%以上。阮林浩[12]等研究了浙江和湖南地区不同季节茯砖茶发花过程中优势菌群的类型变化,发现武义四季发花过程中的两株冠突曲霉类型上无季节性差异;而长沙三季发花过程中的五株冠突曲霉、一株阿姆斯特丹曲霉和一株肋状曲霉有季节性差异。梁晓岚[13]研究四川茯砖茶发花干燥时期的霉菌菌群,结果表明发花初期黑曲霉为优势菌,而在后期薛氏曲霉占据优势,而娄地青霉、淡紫青霉、绿色木霉一直存在但数量较少。因此,以泾渭茯砖茶发酵为研究对象,研究其发酵过程中的霉菌菌群数量及种类的变化,为陕西茯砖茶加工过程中品质的控制和提高提供参考。
1 材料与方法
1.1 供试样品
茯砖茶发酵过程在咸阳泾渭茯茶有限公司进行,期间采集发酵0、2、4、6、8、10、12、14、16、18、23、28 d的茯砖茶样品。
1.2 主要仪器设备
SMART生物显微镜,重庆奥特光学仪器有限公司;SW-CJ-1D单人净化工作台,苏州净化设备有限公司;LEICA-EZ4 HD体视显微镜,北京瑞科中义科技有限公司;PHENOM-PRO台式扫描扫描电子显微镜,飞纳上海复纳科学仪器有限公司;3730XL测序仪,Applied Biosystems;2720 thermal cycler PCR仪,Applied Biosystems;5810R板式离心机,Eppendorf;JY04S-3C凝胶成像装置,北京君意东方电泳设备有限公司;JY300C Power Supply电泳仪,北京君意东方电泳设备有限公司。
1.3 主要试剂及培养基
1.3.1 主要试剂
氯化钠、硝酸铵、磷酸氢二钾、硫酸镁、琼脂粉、七水硫酸镁、蔗糖均为分析纯,购自天津市科密欧化学试剂有限公司;石炭酸、乳酸、甘油、棉蓝均为分析纯,购自天津市天力化学试剂有限公司。
1.3.2 培养基
察氏改良培养基(CZG):NaCl 50.0 g,NH4NO33.0 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,蔗糖40 g,琼脂20 g,蒸馏水1000 mL;20%蔗糖查氏培养基(CZ20):NaCl 50.0 g,NH4NO33.0 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,蔗糖200 g,琼脂20 g,蒸馏水1000 mL;斜面培养基:NH4NO30.1 g,MgSO4·7H2O 0.05 g,NaCl 5 g,蔗糖4 g,琼脂2 g,蒸馏水100 mL;所有培养基121 ℃下灭菌30 min。
1.4 实验方法
1.4.1 泾渭茯砖茶的发酵工艺
将压制定型的茶砖放入温度28 ℃的培养箱中进行发酵(每块茶砖间隔距离2 cm);前2 d每隔7.5 h将培养箱微开30 min(降低湿度),使培养箱中湿度保持在60%~75%之间;两天后打开湿度调节装置调节湿度为50%,温度28 ℃继续培养18 d(湿度保持在50%~60%之间);待检测茶砖内部发花面积占80%时继续发花2 d后,进行升温干燥,关闭培养箱加湿装置调节温度至30 ℃,每隔1 d升高2 ℃,在升温至39 ℃(5 d)后,每隔1 d升高1 ℃至42 ℃,再次烘干1 d后关闭培养箱加热装置,常温放置自然冷却1 d,即可完成生产当中所需要的发酵控制。
1.4.2 泾渭茯砖茶发酵过程中可培养霉菌的分离纯化
采集12个不同发酵阶段的茯砖茶样品,根据改良后的国标GB 4789.15-2016[14]方法进行霉菌数量检测,记录其菌落形态差异明显的霉菌菌落数量,然后将菌落差别明显的霉菌通过三点法用CZG培养基分离纯化,得到单一菌落后再进行一次分离纯化确保菌株的纯化度,将纯化好的11株霉菌编号为M1-M11转移至斜面培养基培养,放入4 ℃冰箱保存[15]。
1.4.3 泾渭茯砖茶发酵过程中可培养霉菌的形态学鉴定
从4 ℃冰箱中取出保存菌株,将斜面接种到CZG培养基中,放入28 ℃培养箱中培养5 d~7 d,进行菌株活化[16]。将活化好的“金花菌”以单点的方式接种于CZ20培养基中培养,观察霉菌菌落形态,用体式显微镜拍照观察菌落的显微形态;用插片法、棉蓝染色法在光学显微镜下观察;再通过扫描电子显微镜进一步观察金花菌闭囊壳、子囊、子囊孢子、分生孢子、分生孢子头、分生孢子梗等形态以及其他霉菌的菌体繁殖特征[17,18];最终通过《中国真菌志》等[19-23]相关专著确定霉菌菌属。
1.4.4 泾渭茯砖茶发酵过程中可培养霉菌的ITS序列测序
将11株霉菌用CZG培养基培养5 d,用无菌接种铲铲取纯的新鲜菌丝体,进行DNA提取后使用ITS序列以ITS1和ITS4区域为引物进行引物扩增,采用琼脂糖凝胶电泳对扩增产物纯化后进行测序,所得序列与NCBI中进行序列比对所得结果构建系统进化树[24,25]。
1.4.5 泾渭茯砖茶发酵过程中可培养霉菌的变化
根据茯砖茶发酵过程中霉菌的数量检测结果,结合M1-M11的形态学和ITS序列测序结果,将鉴定的同种霉菌重新归纳在一起,编号为J1-J8,绘制茯砖茶发酵过程中可培养霉菌的菌落数量表,再利用origin堆积柱状图进行细致分布,综合分析制成泾渭茯砖茶发酵过程中可培养霉菌的变化图。
2 结果与分析
2.1 泾渭茯砖茶发酵过程中可培养霉菌的形态学鉴定
M1-M11是从不同发酵阶段中形态差异明显的菌落中对应分离纯化得到的11株霉菌,体式显微镜拍照观察菌落的显微形态,如图1所示。
由图1可知,M1的菌落生长良好,色泽由菌落中心向外从较深的橘红色逐渐变浅成为黄色,整体色泽偏深趋近于橘黄色,形状为不规则圆形,外部轮廓为锯齿状,菌落向四周蔓延,厚度约2 mm,具有一定的吸附力,菌落中菌丝为黄色,未发现绿色菌丝;M2的菌落为不规则圆形,色泽为黄色,越往外围颜色变浅趋近于亮黄色,厚度约为2 mm,有继续蔓延的趋势,菌丝较为密集,发散性较强;M3与菌落M2较为相似,但厚度较高,色泽趋近于黄色,发散性比M2较弱,形状为不规则圆形具有一定的差异性;M4的色泽为淡黄色,未有渐变色,形状为较规则圆形,菌落吸附力较弱,厚度约1 mm,较薄,菌落密集度较差,与上述菌落形态具有明显差异;M5的菌落色泽为亮黄色,比M3色泽较亮,发散性强于M2,厚度相似,但存在少许差异;M6菌落较圆,色泽由中心向外灰色由深变浅最终趋近于白色,菌丝为埋伏型菌丝体,质地为绒状;M7菌落呈白色,菌丝缠绕茂盛;M8菌落为白色,生长较高,颜色由内向外颜色逐渐变浅,最终接近与灰色,有较为密集的黑色分生孢子,孢子粗壮,少数浅灰色分生孢子梗分布;M9菌落形态与M8较为相似,但色泽由中心向外部从绿色逐渐变浅为黄绿色,菌落白色较皱上层可以看出为绿色分生孢子梗茂密分布;M10菌落色泽为棕黄色,由中心至外围色泽逐渐变浅最终为白色菌毛,菌丝较为密集,发散性较弱,具有较强的吸附性,菌落厚度约为3 mm,菌落整体较小为不规则图形;M11菌落色泽为棕绿色,中心至外围颜色逐渐变浅最终为淡绿色菌毛,菌丝密集,发散性同M10均较弱,吸附性较弱,中心处菌落容易散落,厚度较薄约1 mm,菌落整体趋近于椭圆形。
将这11株霉菌的菌体繁殖特征用光学显微镜和扫描电子显微镜观察后得到图2至图12。
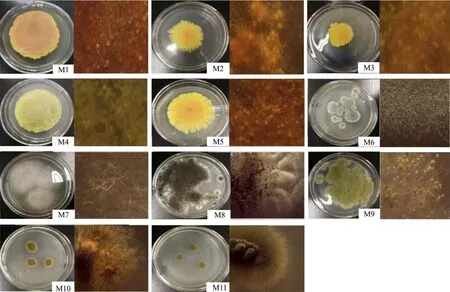
图1 茯砖茶发酵过程中霉菌的菌落形态Fig.1 Mold morphology during Fuzhuan brick tea fermentation

图2 M1霉菌的菌体繁殖特征Fig.2 Mycelial morphology of mold M1

图3 M2霉菌的菌体繁殖特征Fig.3 Mycelial morphology of mold M2

图4 M3霉菌的菌体繁殖特征Fig.4 Mycelial morphology of mold M3
由图2~6所示,M1-M5的菌体形态都包括有性繁殖的子囊果、子囊、子囊孢子,无性繁殖的足细胞、分生孢子梗、分生孢子、顶囊。根据《中国真菌志》,可以将M1、M2、M4、M5初步鉴定为冠突曲霉(A.cristatus),其中M1的形态与鉴定手册中描述的冠突散囊菌(冠突曲霉)形态特征最为接近。M1子囊果近球形,黄色,直径100~200 μm,具拟薄壁组织包裹着子囊,近球形,6~10 μm,子囊内含8个子囊孢子,子囊孢子呈双凸镜形,凸面粗糙具小疣,孢子体4~5 μm×5~6 μm,具有两个明显的纵向鸡冠状突起,赤道沟较窄且深;无性繁殖的分生孢子梗茎没有分枝,顶囊烧瓶形或球形,分生孢子头幼时球形,老后疏松放射型,分生孢子腰鼓型,4 μm×3~5 μm,表面粗糙具小刺。M3的无性繁殖特征与其他4株“金花菌”接近,但有性繁殖的子囊孢子除了形似龟壳、具有两个明显的纵向鸡冠状凸起、有较窄且深的赤道沟外,在子囊孢子的凸面有网结状不规则的肋状突起,可以用于和其他“金花菌”区分,所以M3初步鉴定为肋状曲霉(A. costiformis)。

图5 M4霉菌的菌体繁殖特征Fig.5 Mycelial morphology of mold M4
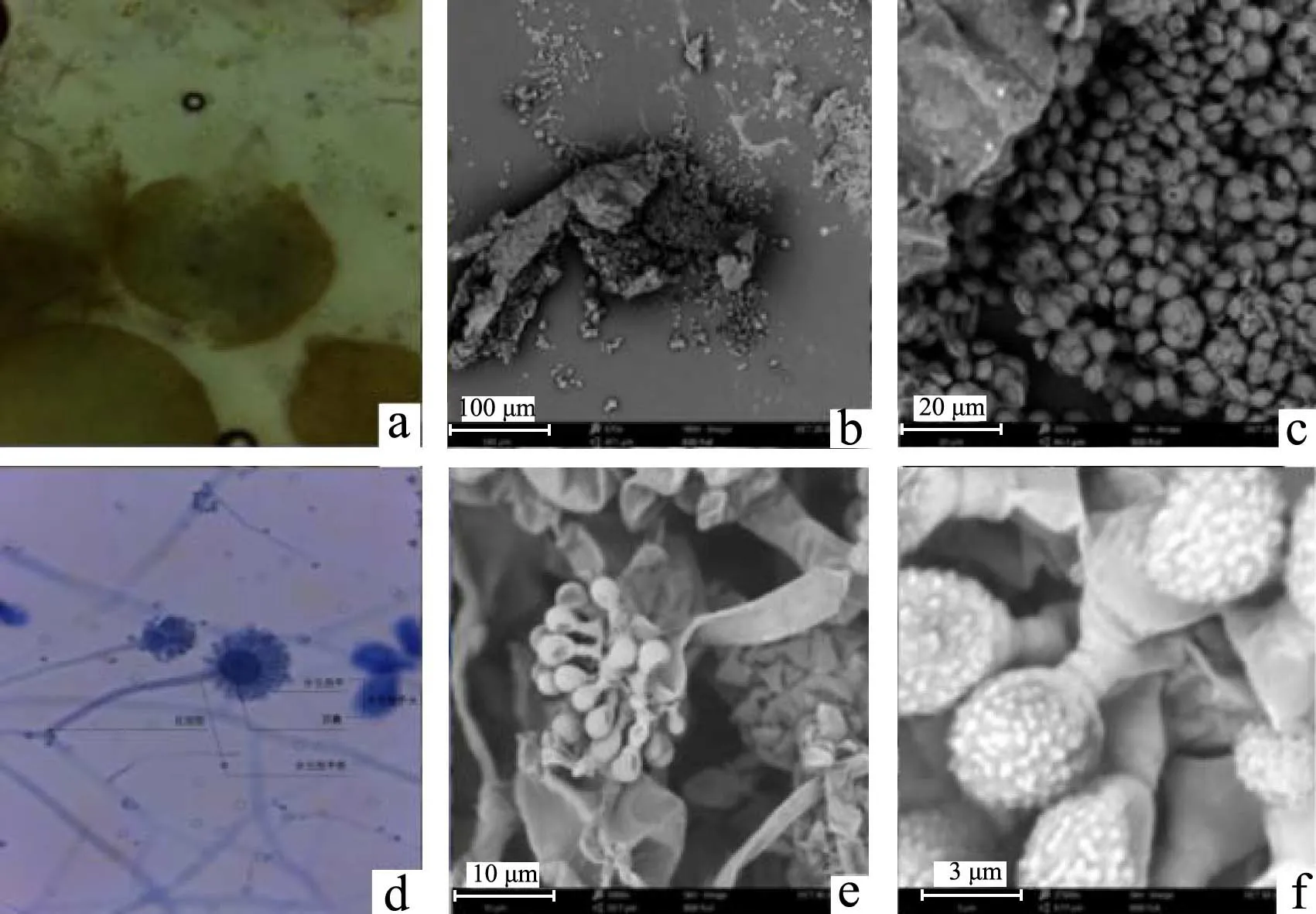
图6 M5霉菌的菌体繁殖特征Fig.6 Mycelial morphology of mold M5

图7 M6霉菌的菌体繁殖特征Fig.7 Mycelial morphology of mold M6

图8 M7霉菌的菌体繁殖特征Fig.8 Mycelial morphology of mold M7

图9 M8霉菌的菌体繁殖特征Fig.9 Mycelial morphology of mold M8

图10 M9霉菌的菌体繁殖特征Fig.10 Mycelial morphology of mold M9
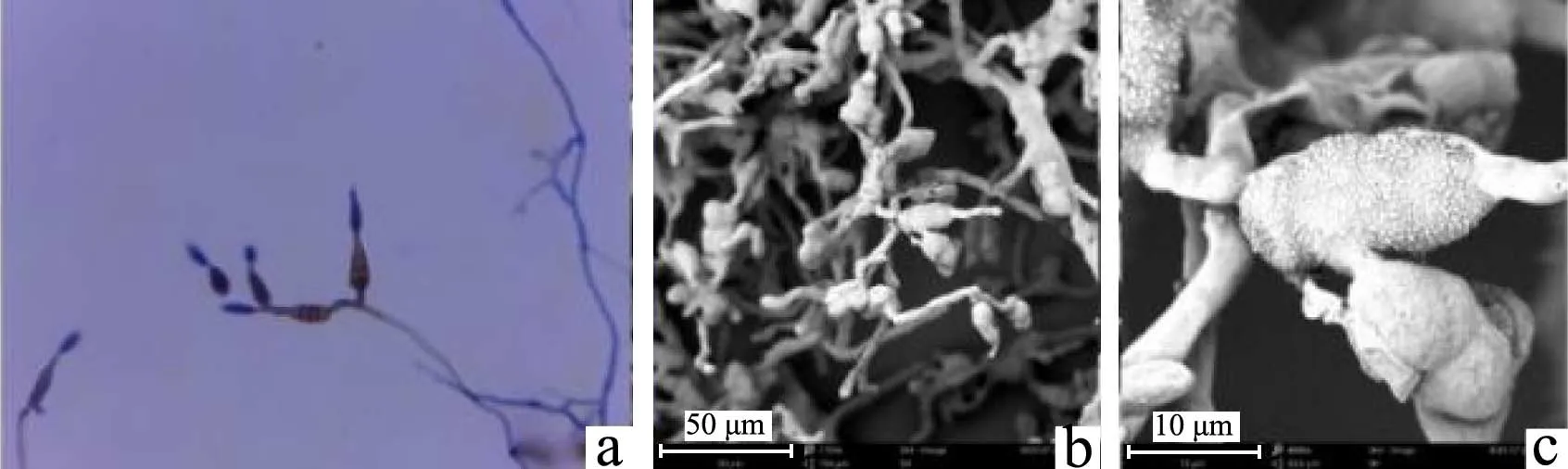
图11 M10霉菌的菌体繁殖特征Fig.11 Mycelial morphology of mold M10

图12 M11霉菌的菌体繁殖特征Fig.12 Mycelial morphology of mold M11
由图7可知,M6分生孢子梗呈帚状枝,含有副枝,类副枝,梗基,瓶梗四部分单轮生基本没有,分生孢子很小,形状为卵形,孢壁含有细刺状,孢子大小为5~6 μm;根据形态学可初步鉴定为青霉属(Penicillium)。由图8可知,M7菌丝有隔,分枝,分生孢子梗分枝,分生孢子镰刀形,有较多的横隔,根据基本形态初步鉴定为镰刀菌属(Fusarium)。由图9可知,M8霉菌无性阶段分生孢子梗不含有梗基,由瓶梗处分生出分生孢子,分生孢子梗茎不分枝,不具septum,壁的表面较光滑,顶囊明显呈球形,瓶梗顶端变窄,呈安瓿状,分生孢子呈卵形,表面为竖状条纹,两端具有小的突起,呈灯笼状,分生孢子头呈球形大小为3~5 μm;根据形态学进行鉴定,初步鉴定为黑曲霉(Aspergillus niger)。由图10可知,M9霉菌为无性阶段,分生孢子梗不含有梗基,由瓶梗处分生出分生孢子,分生孢子梗茎不分枝,不具septum,壁的表面较光滑,顶囊明显呈棒形,瓶梗顶端变窄,呈安瓿状,分生孢子呈球形,表面粗糙具有小刺,两端具有小的突起,呈球状,分生孢子头呈棒形大小为4~7 μm;根据形态学进行鉴定,初步鉴定为米曲霉(Aspergillus oryzae)。由图11可知,M10分生孢子形状为倒梨形,有分割膜,孢子大小20 μm±5 μm,根据基本形状可初步鉴定为链格孢属(Alternari)。由图12,M11的产孢结构为枝孢型,形成分枝的孢子链,分生孢子为卵圆形,孢子大小为8 μm±2 μm,根据基本形状可初步鉴定为枝孢属(Cladosporium)。
2.2 泾渭茯砖茶发酵过程中可培养霉菌的ITS序列测序
将11株霉菌M1-M11,经过ITS1和ITS4区域扩增纯化后进行测序后输入到NCBI中进行序列比对所得结果构建系统进化树如图13所示。由进化树可看出M1-M5与刺针曲霉(Aspergillus spicules)的同源性为100%;M6与橘青霉(Penicillium citrinum)的同源性为100%;M7与木贼镰刀菌(Fusarium equiseti)的同源性为100%;M8与黑曲霉(Aspergillus niger)的同源性为100%;M9与米曲霉(Aspergillus oryzae)的同源性为100%;M10与互隔铰链孢霉(Alternaria alternate)的同源性为100%;M11与芽枝状枝孢霉(Cladosporium cladosporioides)的同源性为100%。

图13 M1-M11霉菌鉴定系统进化树Fig.13 M1~M11 phylogenetic tree for mold identification

表1 茯砖茶发酵过程中可培养霉菌的菌落数量Table 1 The number of fungus colony in Fuzhuan brick tea fermentation
根据ITS序列测序结果结合形态学鉴定结果进行分析比对可知霉菌M6-M11鉴定的结果基本一致,但霉菌M1-M5的ITS序列测序鉴定结果为同一种菌,不能够区分开来,这是因为ITS序列测序仍存在一定的局限性,在NCBI中进行比对时,发现同源性趋近于100%的菌种有多个,例如阿姆斯特丹曲霉(Asperqillus amstelodami),谢瓦氏散囊菌(Eurotium chevalieri)等,不能够准确鉴定到种,只能鉴定到属。吕嘉枥[8]等人在对陕西茯砖茶中优势Eurotium属的鉴定过程中也遇到了同样的问题,在对7株“金花菌”进行18S rDNA序列分析时,发现这7株菌与Aspergillus glaucus、Eurotium herbariorum、Aspergillus pseudoglaucus、Aspergillus cristatus、Eurotium chevalieri、Eurotium amstelodami、Eurotium rubrum、Aspergillus amstelodami都在系统发育树的同一枝上,同源性都超过99%,不能区分开来。所以M1-M5 “金花菌”的鉴定不能只通过单一手段完成,一般至少要结合两种鉴定方法才能得出结论。综合形态学和ITS测序两者最终鉴定结果是M1、M2、M4、M5为冠突曲霉(A. cristatus),M3为肋状曲霉(A. costiformis),M6为橘青霉(Penicillium citrinum),M7为木贼镰刀菌(Fusarium equiseti),M8为黑曲霉(A. niger),M9为米曲霉(A. oryzae),M10为互隔铰链孢霉(Alternaria alternate),M11为芽枝状枝孢霉(Cladosporium cladosporioides)。关于分子生物学的鉴定方法还有对NRPS、barcode or MLST、MALDI-TOF等[26-28]的差异分析,也有利用转录组水平的多基因系统发育分析菌株的种属关系[6,29],但这些研究目前均有一定的偏差,因此需要寻求更准确、分辨率更高的分子生物学鉴定方法。
2.3 泾渭茯砖茶发酵过程中可培养霉菌的变化
由图14所示,发酵前期6 d左右,除第2 d、第4 d有少量冠突曲霉外,无其他“金花菌”生长,有检出其他霉菌橘青霉菌落数量较多,还检出较少的黑曲霉、互隔铰链孢霉和芽枝状枝孢霉;发酵中期第8 d时,橘青霉的数量仍然占据优势,但检出了少量“金花菌”肋状曲霉的生长,随后“金花菌”冠突曲霉开始大量生长,在发酵中后期和干燥期占据主导地位,期间有少量木贼镰刀菌、黑曲霉、米曲霉存在,最后到28 d样品中冠突曲霉的菌落数量达到134000 CFU/g,占可培养霉菌总数的99.99%,只检测出极少量10 CFU/g的黑曲霉。另外,在整个发酵过程中曲霉属的数量呈现先下降后上升的趋势。这与LI等[30]研究的结果类似,即在茯砖茶发酵的不同阶段中,Asperqillus的丰度先下降后上升,在S5阶段时相对丰度已上升至98%,最终成品中达到了99.95%。
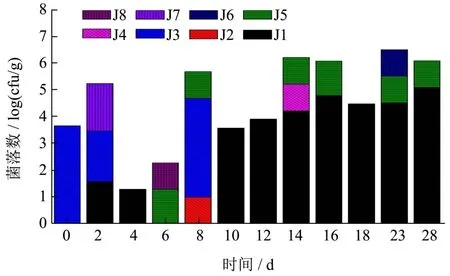
图14 茯砖茶发酵过程中霉菌的变化Fig.14 Molds changes during Fuzhuan brick tea fermentation
3 结论
泾渭茯砖茶发酵过程中共分离鉴定出8种霉菌。发酵前期第2 d和第4 d有少量“金花菌”冠突曲霉生长,但橘青霉为优势菌群,另外还有少量黑曲霉、互隔铰链孢霉和芽枝状枝孢霉;发酵中期自第8 d检测出少量“金花菌”肋状曲霉之后,“金花菌”冠突曲霉开始大量生长并一直占据主导地位,发酵终点时占霉菌总数的99.99%。泾渭茯砖茶发酵前期霉菌菌群丰富,随着发酵的进行,其中的冠突曲霉逐渐成为优势菌群。
