河水与海水混合过程中Eh-pH的变化特征及影响因素❋
2021-03-02廖辉杰范德江孙学诗
廖辉杰,范德江,2❋❋,逄 悦,孙学诗
(1.中国海洋大学海洋地球科学学院,山东 青岛 266100;2.中国海洋大学海底科学与探测技术教育部重点实验室,山东 青岛 266100)
氧化还原电位(Eh)是表示水体或者沉积物氧化还原程度的参数之一,可以在无外加电流的情况下由惰性电极测得[1];酸碱度即pH,是一个反映物质酸化程度的参数。海水的Eh和pH是海水生物地球化学参数的关键因子,它们直接影响了水体中金属元素的赋存状态和矿物的形成,同时Eh和pH变化都会对水系、水团甚至海域的生态环境带来巨大的影响,因此,这两个参数经常被用于海洋生物地球化学的研究中[2]。近些年来,我国人口数量激增且逐渐发展成为一个工业大国,大量的生活污水和工业废水通过江河湖泊最终汇聚到河口地区,导致河口地区以及其附近海域的水体中大量的重金属以及有机污染物富集、沉降,引起水体环境的恶化。开展河口水体Eh与pH的研究,对于河口和海域环境治理以及海洋渔业经济的可持续发展有着重要的意义。
长江是中国第一大河,每年输送(9.28~9.79)×1011m3淡水和4.86×108t沉积物入东海,同时携带1.9×104t重金属物质、3.3×104t石油以及各类N、P、Si的营养盐物质[3],其中的重金属、营养盐等组分在河口混合带中随着水体Eh、pH等环境因子的改变发生迁移和转化,对长江河口地区和东海海域生态系统有着深远的影响。前人关于长江口地区沉积环境以及水环境中的Eh以及pH的研究主要是通过现场调查数据的分析。季节变化、长江冲淡水的输入扩散以及水系水团混合对Eh和pH的影响较为显著[4-6],但是关于河口混合过程中Eh和pH随时间的变化以及影响因素并不清楚。为此,本文在室内开展了长江水体和东海海水在不同盐度下的混合实验,模拟了河口混合过程中盐度的变化,揭示混合过程中水体Eh与pH的变化特征,探讨其影响因素,试图为全面认识河口混合过程中的物理化学参数的变化提供科学依据。
1 长江与东海端元水样选取
长江口位于启东嘴和南汇嘴之间,徐六泾水文站是长江干流的最后一个控制站,在这之后的长江被崇明岛分为南支与北支[7]。本文选取了徐六泾(31.77°N,121.03°E)作为本次河水端样品取样点,其距离口门120 km,处于南通-常熟断面之上。从20世纪50年代开始,长江口沿岸河段进行了大量的围垦,徐六泾段河宽也受到围垦影响,由13 km缩减到5.8 km,从此成为长江下游一个重要的控制节点[8]。使用水桶采集河流表层3 m处河水水样(31.78°N,120.94°E),经0.45 μm微孔滤膜过滤得到纯净的河流水体样品,供混合实验使用。
东海是典型的陆架边缘海,流系较为复杂,一般受黄海沿岸流、黑潮分支、浙闽沿岸流、长江冲淡水等影响。为采集到典型样品,于东海陆架中部台湾暖流影响区采集中层水样(20 m)使用Rosette采水器采集海水样品(29.5°N,123.91°E),盐度为34,经0.45 μm微孔滤膜过滤得到纯净的东海海水样品,供混合实验使用。需要说明的是,水体混合实验是在开放体系下进行的,混合过程中与大气接触,与河口水体实际混合过程存在一定的差异,采样站位见图1。
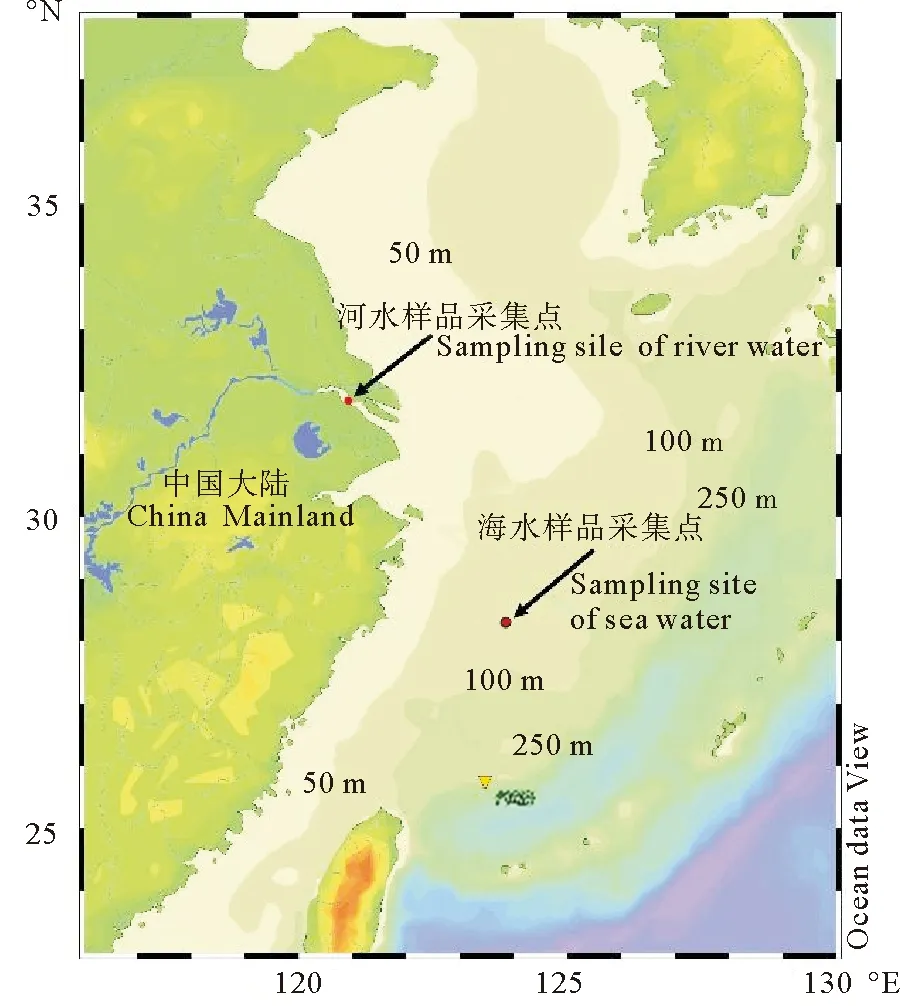
图1 河水样品、海水样品采样站位Fig.1 Sampling sites of river water and sea water
2 混合实验方案和测定方法
2.1 混合实验方案
按照河口混合过程中盐度逐渐增加的特点,设置盐度分别为5、12.5、25的3组混合实验,实时测定水体的Eh、pH等参数,同时依据一定的时间间隔采集混合水样样品经过滤得到新生物相供后续研究使用。其目的动态观测长江河水和东海海水混合过程中水体环境参数改变和所形成的新生物相。模拟实验的流程如图2所示。
具体操作中,为了方便测定混合水体的Eh、pH参数,设置了性质相同的采样组(大样品量,混合水量15 L)、环境因子测定组(小样品量,混合水量5 L)两套实验,大样品量实验用于采集混合水体样品中的新生物相,供扫描电镜下观察新生矿物;小样品量实验用于实时测定混合水体的环境参数,Eh与pH探头以及温度计置于混合容器内保持不动持续测试(见表1、2)。
本实验相关的所有容器,包括抽滤设备以及样品瓶都事先用稀盐酸浸泡24 h以上,然后分别用自来水、纯水和超纯水润洗3遍。室内混合使用的容器材质为聚丙烯,滤膜为whatman直径47 mm的0.45 μm醋酸纤维滤膜。河水水样和海水水样分别取完后置于低温环境,并迅速在无尘环境下进行海水水样的抽滤。抽滤完成后立即进行混合模拟实验,以保证样品未变质。整个实验过程于超净实验室内进行,确保无其他物质引入,超净实验室内温度控制为25 ℃,置于混合容器中的温度计显示溶液温度为室温(25±0.2) ℃。
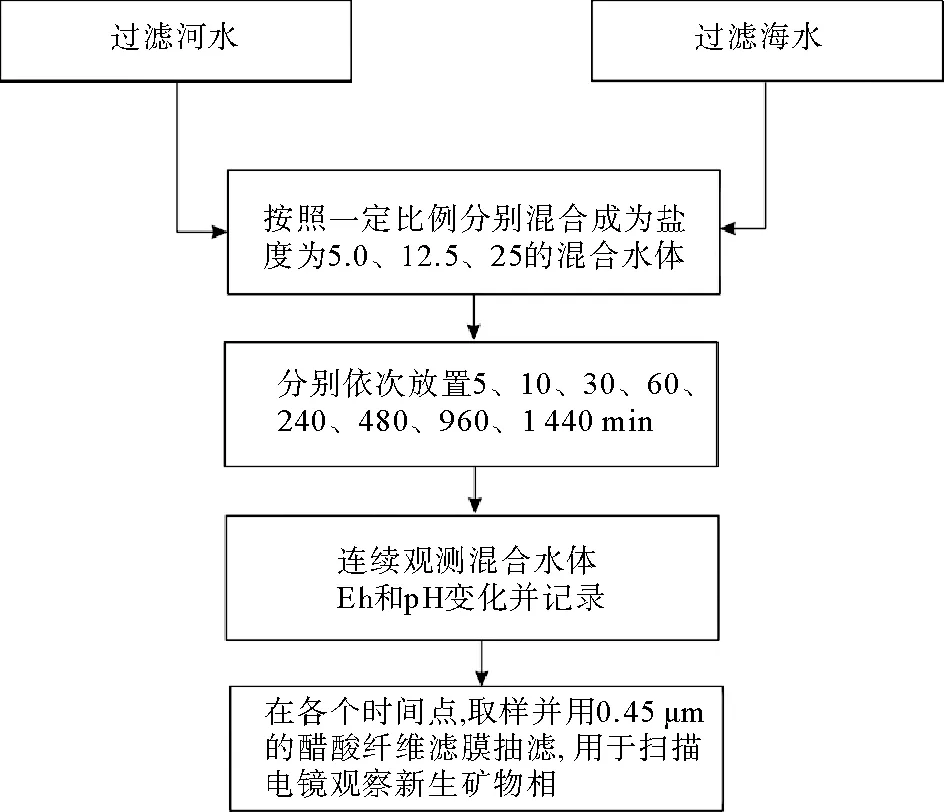
图2 河水和海水混合实验流程图
2.2 环境因子测定方法
本实验中水体的pH值采用pHS—3C型精密酸度计进行测定。该仪器的测量精度为0.01。在首次使用前,将电极于蒸馏水浸泡24 h以上。在正式测定之前,需要预热仪器30 min,然后配置标准缓冲溶液并进行校正,标准缓冲液有效期为2周。本仪器的测定结果每秒钟实时显示,且测定结果一般在2 min内稳定。将探头置于混合水体中,可进行连续pH的测量。
混合水体的Eh采用去极化法测定,仪器型号为FJA—2型全自动氧化还原电位测定仪。同样,在首次使用前应该将电极置于蒸馏水中浸泡24 h,在正式测定之前,需要预热仪器30 min,然后配置Eh (ORP)标准溶液进行仪器校正。该仪器基于极化法原理设计,具有温度自动校正性能,能够迅速获得准确的Eh值,测定误差为±10 mV,2 min可获得实验数据。

表1 采样组混合实验方案Table 1 Schemes for the water mixing experiment of Sampling group

表2 环境因子测定组混合实验方案Table 2 Schemes for the water mixing experiment of Environmental factor measurement group
3 结果
3.1 混合过程Eh变化
混合过程中,混合水体Eh随时间变化的记录如图3所示,图中3种变化曲线分别是不同混合盐度下的变化趋势。水体混合的初始范围为550.5~579.7 mV,平均值564.03 mV。最终稳定混合电位范围为503.7~533.9 mV,平均值为522.2 mV。3组不同盐度的混合实验的Eh均在混合之后最初的1 h内迅速升高,随即在1~5 h内迅速下降,然后下降速率变缓和,一直到混合24 h,Eh持续降低。从混合初始到混合24 h后,3组混合水体整体上都处于氧化体系(400~650 mV)控制,随时间变化有向弱氧化(200~400 mV)体系转变的趋势。对比长江口实测Eh值从径流段至混合带介于516.8~582.7 mV、平均值561.4 mV,到混合带内介于524.4~576.1 mV,平均值557.4 mV(1)孙学诗, 范德江. 长江河口混合带水体与底质Eh-pH转变特征, 未发表.。混合实验得到Eh值范围以及随着盐度增加而小幅度波动的特征吻合。
3.2 混合过程水体pH变化
混合过程中,混合水体pH随时间变化的记录如图4所示,图中3种盐度的混合实验pH变化曲线略有差异。水体的混合初始pH范围为7.83~8.22,平均值为8.06。混合实验24 h后pH范围为7.9~8.11,平均值为7.99。总体上,盐度越高,混合实验各个阶段pH值也越高;混合过程中,pH值呈现混合带内介于7.85~8.09,平均值7.97,总呈现出从径流端向海洋端迅速增加的趋势①。混合实验得到的pH值范围略高于实测值,而pH值随混合盐度而增加与实际吻合。
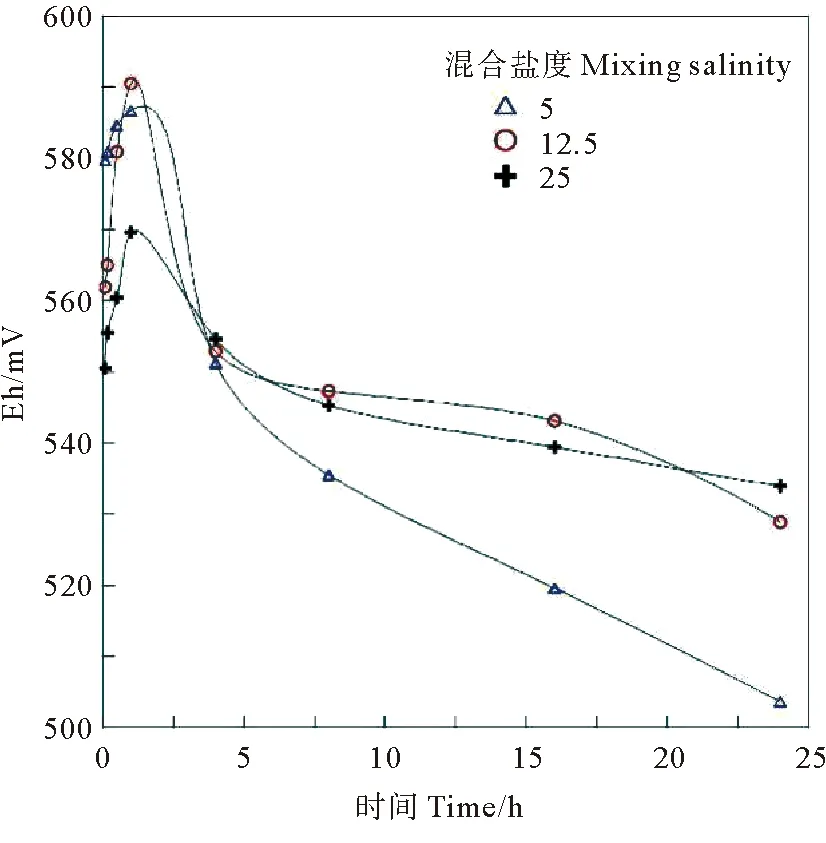
图3 混合过程中水体Eh随时间变化曲线Fig.3 Changes of Eh during the water mixing experiments
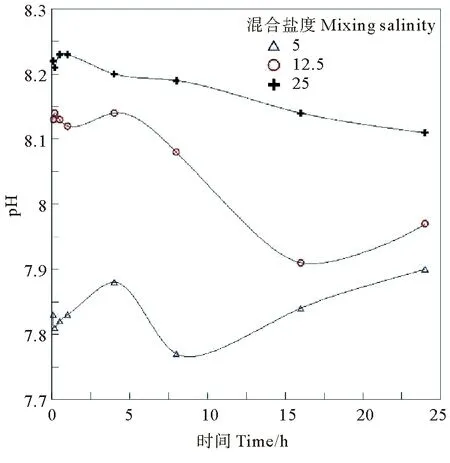
图4 混合过程水体pH随时间变化曲线Fig.4 Changes of pH during the water mixing experiments
4 讨论
在天然的非封闭水域中,如各大江河的入海口处,水动力环境剧烈,水体与水体,水体与大气之间的交换充分,各个不同物理化学性质的水系水团之间的混合时有发生,不同水团温度盐度的差异混合必然会导致混合水体pH和Eh等物理化学参数的变化;同时河口发生的化学过程、生物作用也会引起水体pH、Eh的改变。
研究表明,水体混合作用的强弱会显著影响水体Eh值。在海洋动力环境强的水域,表层、中层、底层水体交换程度高,水体呈现富氧状态,Eh较高。若出现温跃层和盐跃层结构,表明海水层化现象显著,水体交换程度低,出现贫氧状态,Eh值较低甚至表现为负值[9]。海水pH值主要被溶解无机碳酸盐的解离平衡控制[10],所以凡是能够改变无机碳酸盐溶解平衡的作用均能够影响海水pH值。与此同时,海水的实际pH值与海水温度、盐度、压力、以及海-气交换等物理化学过程密不可分。理论上,能够改变海水体系中碳酸盐相对浓度的化学过程,以及海水的温度、海水静压力、盐度以及生命活动释放和消耗CO2均会影响无机碳酸盐的溶解平衡,从而影响海水pH值。
针对本次混合模拟实验,是在超净实验室内通风橱内进行的,虽然在实验过程中有搅拌模拟水体与大气交换的过程,但是与实际开放性水域,空气中大量外源物质输入不同,模拟实验过程中并无其他外源输入物质影响混合过程,整个混合过程中温度,压力等均保持不变,故本混合实验的Eh与pH变化的影响因素更多还是来源于自身混合过程中内部发生的变化,其影响因子比自然界的实际过程简单,主要受到机械混合和氧化还原反应的影响。
4.1 机械混合的影响
河水为高Eh、低pH的水体,而海水为低Eh,高pH的水体,混合初期,机械混合起到重要的作用。依据混合实验的盐度差异,在混合最初的时间段(混合时间5~60 min)里,Eh值随着混合盐度的增大而减小,表现为从河流端向海水端移动的特点;在混合实验的5、10、30、60 min时间点测定的Eh都随着盐度降低而下降,前两者下降趋势更加明显,该下降趋势接近线性关系,可以推测这种过程与机械混合相关(见图5(a))。
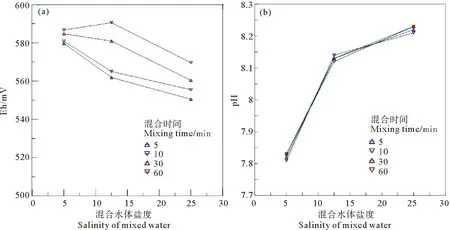
图5 混合实验过程中水体Eh、pH和盐度的关系Fig.5 The relationship of Eh & salinity and pH & salinity during the water mixing experiment
与此同时,随着混合实验的延长,Eh值表现为整体增加的特点,曲线近乎向上平移,这可能与混合实验过程中混合水体与空气中的氧气交换有关,随着混合实验的延长,混合水体与空气交换时间增加,导致Eh值偏高。同样地,混合水体的pH值随着混合水体盐度的增大而增大,也表现为从河水端向海水端移动的趋势(见图5(b))。但是,与Eh值相比,不同混合时间测定的pH值与盐度的关系几乎没有发生变化,未发生趋势性的改变,反映混合水体中CO2分压较稳定,未受到与大气交换的影响。
4.2 氧化还原反应的影响
由于河水和海水物理化学性质的明显不同,使得河口成为天然的地球化学界面,发生广泛的地球化学作用,促进了河流入海物质发生迁移、转化,其中重金属以及有机污染物质等被清除,进而沉积到底质沉积物之中[11]。在河口复杂的地球化学作用中,氧化还原反映占据重要的位置,制约了河口区Fe、Mn等变价元素的地球化学行为,以及通过氧化物的形成进而结合了重金属等微量元素实现了某些元素的清除。河口的氧化还原作用已经被前人观察和研究所揭示[12]。
水体的氧化还原电位(Eh)是反映水体中所有物质的宏观氧化还原性,测得的氧化还原电位越高,表示氧化性越强;氧化还原电位越低,即代表还原性越强。由于天然开放性水域中含有大量溶解氧,氧元素还原电对对Eh起着主要控制作用。但是除了氧元素还原电对外,水体中必然还存在其他多种氧化还原电对[1],他们共同组成了复杂的氧化还原体系,所以其氧化还原电位也是多种氧化还原反应相互影响的结果。
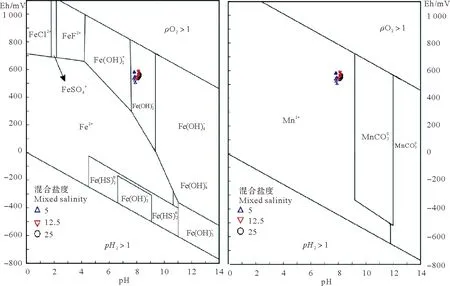
(据Glasby修改,1995[14]。After Glasby,1995[14].)
体中铁锰自生矿物稳定性pH-Eh图解可以看到,整个混合过程中,铁元素的存在化学式为Fe(OH)3,推测在混合过程中可能有自生铁氧化物形成。锰元素存在的化学式为Mn2+,推测混合过程中锰元素始终以游离态形式存在。同时Mn2+离子的稳定性要大大强于Fe2+离子,锰氧化物形成速度非常有限[4],所以存在形式为游离态Mn2+离子。通过混合实验中河水用量与Eh值改变的关系(见图7),可以间接揭示河水中溶解态变价元素含量对混合实验中水体Eh的影响。在混合的初期(混合时间10~60min),河水水量对ΔEh的影响并不明显,这是由于混合初期,河水和海水还处于混合扩散过程,主要受到机械混合的影响,在混合的中后期(240~1 440 min)可以明显的看到,ΔEh与河水水量呈明显的反比例关系,这是由于,河水水量越多,其中所带来的Fe2+离子越多,混合过程中Fe2+离子会向Fe3+离子转变,其过程如下:
12Fe2++3O2+6H2O→8Fe3++4Fe(OH)3(中性环境),
(1)
4Fe2++O2+4H+→4Fe3++2H2O(酸性环境),
(2)
4Fe2++8OH-+O2+2H2O→4Fe(OH)3(碱性环境)。
(3)
可见,无论是在中性抑或酸性、碱性环境下,Fe2+离子会向Fe3+离子氧化过程中都需要消耗O2,导致水体中Eh值降低;混合实验中河水使用量越多,消耗的O2也越多,Eh值下降也越多(见图7)。
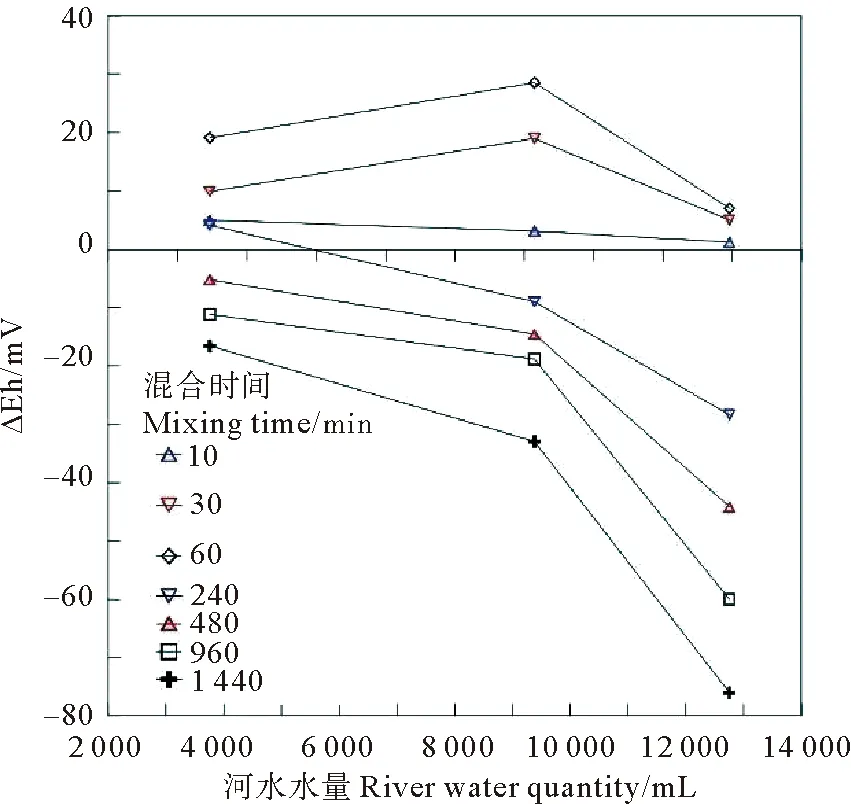
(ΔEh值当前时间Eh与初始混合Eh的差值。ΔEh denotes difference between current measured Eh and initial Eh at the beginning of the experiment.)
通过水体铁锰自生矿物稳定性pH-Eh图解的推测,在混合过程中Fe元素确实参与了氧化还原反应,并对混合水体的Eh会产生影响。一般来说氧元素控制下的Eh高于460 mV,有机质分解和铁锰控制电位位于115~460 mV之间[22]。本次混合实验的Eh变化范围为503.7~579.7 mV,随着混合过程进行,各组氧化还原电位均降低。但仍然为氧元素氧化还原电对为主导,有向有机质分解和铁锰元素控制的范围转变的趋势。出现这种情况的原因是由于海水和河水的混合,河水携带的大量Fe2+通过氧化还原反应转变为Fe3+新生矿物,消耗了O2,使得水体氧化还原电位随着混合的进行而降低,但混合水体中O2并未耗尽,所以氧化还原电位值仍然在氧元素控制的电位值之上。
混合过程中自生矿物的扫描电镜观察与能谱分析证实了具有铁氧化物新生矿物的出现。在各混合实验组的SEM-EDX的观察分析中(见图8),发现两类铁氧化物,其一为不规则集合体状,集合体约10 μm左右,集合体边缘存在针状、板状的微小晶体,其大约1 μm左右,该集合体能谱测定显示成分为Fe与O;该集合体形态、晶体形态、元素组成与前人混合实验中所形成的新生矿物相纤铁矿一致,我们推测该铁氧化物属于纤铁矿[18],其分子式为:γ-FeOOH。另一类铁氧化物为单独存在球状铁氧化物,直径大都在1 μm左右,能谱测定成分为Fe和O。
Fe2+离子在水体中发生的氧化还原反应较为复杂,消耗氧气影响水体Eh的同时,也会在影响混合水体的pH值。在酸性环境下,Fe2+离子氧化过程中消耗H+,使得溶液pH值增大(见反应式2);而在碱性环境中,在形成Fe(OH)3胶体时消耗溶液中的OH-,使得溶液pH值减小(见反应式3)。本次混合实验的12.5盐度组和25盐度组的为碱性环境,在混合过程中pH值降低,符合(3)式的一般规律;而5盐度组为中性-弱碱性环境,在混合之后pH值先上升,后降低,随后又上升,推测可能先以(1)氧化反应生成Fe(OH)3胶体,使得pH值小幅度上升,随这混合水体系偏向碱性,以(3)式反应形成Fe(OH)3,需要消耗OH-使得pH值开始降低。
4.3 其他影响因素
水气相互作用影响水体中CO2、O2分压,从而导致水体pH和Eh的变化。该过程中首先受温度的影响,水温升高时,水体中的CO2向外逸出,从而导致海水中H+浓度降低,从而导致pH值上升;水温增加时,则导致水体酸化,pH值降低。温度同样也会影响水体的O2分压,影响机制同CO2,导致Eh值的改变。由于本次混合实验是在实验室内完成的,实验过程中温度基本稳定,温度对pH、Eh的影响微小。但是当水体搅动时会加快水气交换,可以快速改变水体中气体分压,特别在开始混合时,由于需要对两类水体进行充分搅动和混合,导致水体中溶解态O2增加,这是3组盐度的混合实验初期都出现Eh值的增加的主要原因。
天然开放水域中,生物作用也可以影响水体CO2、O2浓度。水体中的浮游类植物光合作用吸收CO2产生O2的同时合成有机物质,导致水体pH、Eh值上升;而在富营养度环境下水体微生物大量繁殖,出现赤潮,导致海水出现局部的低pH值以及缺氧环境[23]。由于本次实验使用了过滤的河水和海水,已经去除了微生物,生物的影响可以排除。
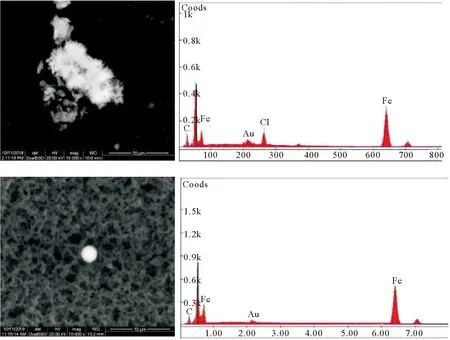
图8 混合过程中的自生铁氢氧化物、氧化物SEM-EDX图像Fig.8 SEM-EDX image of autogenous iron hydroxide and oxide forming in the mixing experiment
河水以及海水中都会含有少量的溶解态有机质,这部分有机质有可能在混合实验过程中发生氧化,会消耗一定量O2,导致混合水体中Eh值的下降。前人观测[24]表明长江河水、东海陆架水体溶解态有机质含量分别为3.3~11.20 mg/L、0.8~1.2 mg/L,包含了陆地来源、海洋来源有机质,其中陆地来源有机质年龄偏老,经过了较长时间的演化,稳定性强,不容易被氧化,这些海源新鲜的有机质较容易被氧化。总体上看,溶解态有机质含量微小,对整个混合体系Eh的影响小。
5 结语
通过长江水体和东海陆架水体的不同盐度的混合实验,模拟了长江河口水体混合过程中Eh、pH变化,分析了变化的制约因素。混合水体为弱碱性-强氧化环境,pH值变化范围为7.83~8.22,Eh值变化范围为503.7~579.7 mV。随着混合作用的进行,pH值总体上呈现下降的趋势;Eh值在混合开始的1 h内迅速升高,随后迅速下降并逐渐趋于稳定。长江河水与东海海水混合过程中Eh、pH的变化主要受机械混合和氧化还原反应控制,机械混合发生在混合实验的初期,导致两类水体Eh、pH快速中和;随后,以Fe2+为主的氧化反应形成铁氧化物,消耗了水体中的O2和OH-,使得混合水体中的Eh、pH呈现下降趋势,并逐渐趋于稳定。
