长江南京段水源水中氨苄西林的时空分布特征及风险评估
2021-03-02龚润强季木兰苏良湖卜元卿张圣虎
龚润强,王 博,季木兰,赵 欣,苏良湖,卜元卿,陈 瑀,3,张圣虎①,邱 慧
(1.生态环境部南京环境科学研究所,江苏 南京 210042;2.南京信息工程大学环境科学与工程学院,江苏 南京 210044;3.贵州大学资源与环境工程学院,贵州 贵阳 550025)
自抗生素问世以来,人类对抗生素的消费需求不断增长。据统计,全球抗生素的消费量在2000年至2015年的16 a间增长了65%[1],我国抗生素年消费量超过1.6×105t,其中约5.4×104t进入自然环境[2]。氨苄西林(ampicillin,AMP)作为β-内酰胺类抗生素,由于其抗菌谱广、杀菌活性强、毒性低、临床疗效好等优点,现已广泛用于呼吸道感染、泌尿道感染、脑膜炎、沙门氏菌感染症以及心内膜炎等感染性疾病的治疗。据统计,AMP约占美国抗生素消费量的44%[3]。与其他抗生素类似,AMP在生物体内并不能完全代谢分解,约60%~80%的AMP以原药形式排出体外[4]。研究发现,现阶段的水处理技术对AMP的去除十分有限,美国17家医院的污水处理设施对AMP的去除率在40%~54%之间[5],达累斯萨拉姆大学废水稳定塘对AMP的去除率为54.0%~56.5%[6]。尽管AMP在生物体内的半衰期较短(1.2~1.5 h),但是由于大量频繁地使用以及污水处理设施较低的去除率,可能会导致其在水体中形成持续存在的“假持久性”状态,进而影响其对天然水体中抗性基因的耐药性[7-8]。目前,天然水体中对AMP赋存浓度的研究相对较少[9-10],但是对其细菌耐药性的研究相对较多,研究表明,波兰的普罗德尼克河和拉巴河[11]以及南非豪登市阿皮兹河[12]中大肠杆菌对AMP的耐药率最高,不同来源的大肠杆菌如牛源大肠杆菌、羊源大肠杆菌、饲料源大肠杆菌、饮用水源大肠杆菌对AMP的耐药率分别为10.7%、25.0%、51.0%、100%[13],气单胞菌[14]、沙门氏菌[15]对AMP的耐药率分别为95.45%、73.39%。环境中的耐药基因可通过遗传或水平转移在细菌间进行扩散,或通过饮用水和食物链进行转移,对生态环境和人体健康造成潜在威胁[16]。
南京地处长江下游平原,是长江下游重要的中心城市。长江南京段上起江宁区和尚港,下至栖霞区大道河口,自西向东贯穿全市,岸线全长近200 km,城南、城北主要的生活用水取水口均设置在长江两岸[17]。截至2018年,南京市拥有常住人口843万,长江为南京市主要的饮用水源地。目前沿江两岸附近分布有化工企业、医院、城市污水处理设施等,因此其水质安全对于周边居民具有潜在影响。2019年11月—2020年1月,笔者通过对长江南京段14个采样点表层水样持续监测,分析了AMP的时空分布特征,并对生态风险及人体健康风险进行了初步评估,以期为新型污染物的环境管理提供基础数据支撑。
1 材料与方法
1.1 仪器与试剂
仪器:超高效液相色谱-串联质谱仪(UPLC-MS/MS,LC系统为Agilent 1290 Infinity, MS系统为AB SCIEX QTRAP 4500,美国 Agilent 公司);Oasis HLB 小柱(6 mL,200 mg,美国Waters公司);旋转蒸发仪(R-300,瑞士BUCHI公司);固相萃取装置(24孔,美国Waters公司)。
试剂:甲醇和乙腈(色谱纯,德国Merck公司);甲酸和氨水(分析纯,国药集团药业股份有限公司);磷酸和磷酸二氢钠、乙二胺四乙酸二钠(EDTA·Na2)(分析纯,南京化学试剂有限公司);抗生素标准品购自百灵威科技有限公司,纯度w大于99%。用甲醇将AMP标准品配制成1 000 mg·L-1标准储备液,然后取标准贮备液配制20 mg·L-1混合标准物质储备液,存储在-20 ℃冰箱中待用。
1.2 样品采集
分别于2019年11月、12月及2020年1月在长江南京段14个断面(S1~S14)(图1)采样,用有机玻璃采集器采集表层水样,采集深度为0.1~1.0 m,每个断面上采集3个平行样,混合后取1 L。将采集到的水样置于用去离子水润洗3次的棕色玻璃瓶中,在低温避光下保存,且在24 h内运回实验室,用0.45 μm孔径玻璃纤维滤膜过滤后储存在4 ℃冰箱内,在3 d内完成水样的预处理。
1.3 样品预处理
参照文献[18],取1.0 L经0.45 μm孔径玻璃纤维滤膜过滤后的水样,加入5 mL 100 g·L-1EDTA·Na2溶液,再用磷酸水溶液(体积比为50%)调节水样pH值至3.0左右;依次向HLB小柱内加入6 mL甲醇、3 mL超纯水和6 mL磷酸二氢钠水溶液使小柱活化,调节小柱溶液流速为4 mL·min-1,活化完成后以相同流速富集水样;抽干水样后向采样瓶中加入10 mL超纯水,抽真空干燥30 min后,依次用6 mL甲醇和6 mL氨水甲醇(体积比为2%)洗脱;洗脱液在40 ℃下旋转蒸发近干,用甲醇复溶至1 mL,使用UPLC-MS/MS分析。
1.4 仪器分析条件
液相色谱条件:测定采用规格为150 mm×2.1 mm×3.5 μm的ZORBAX Eclipse Plus C18色谱柱,柱温设定为30 ℃,样品进样体积为5 μL,流速为0.3 mL·min-1。AMP测定流动相为0.2%(体积比)甲酸水溶液和乙腈,5 min时将流动相甲酸水溶液/乙腈体积比从99/1调整到90/10,25 min时调整到50/50,26 min时调整到99/1,洗脱至30 min结束。
质谱条件:采用离子电喷雾正离子(ESI+),多反应监测(MRM)模式;设定离子源温度为550 ℃,喷雾电压为5 500 V,喷雾气、气帘气和辅助加热气的压力分别为60.0、35.0和65.0 kPa。
1.5 质量控制
采用外标法对样品的质量浓度进行定量分析,在100 mL去离子水中加入2 μg·L-1的混合标样进行测定,回收率为60.5%,相对标准偏差为6.7%。以信噪比S/N≥3和S/N≥10计算仪器的检出限(LOD)和定量限(LOQ)分别为0.005和 0.018 μg·L-1。
1.6 风险评估
1.6.1生态风险评估
风险熵值(risk quotient,QR)可以用来对水体中抗生素的生态风险进行评估[19],根据欧洲风险评估技术指导文件(European Commission Technical Guidance Document,TGD)中风险熵值法对长江南京段水源水中抗生素的生态风险进行评估[20],风险熵值(QR)计算公式为
QR=CME/CPNE。
(1)
式(1)中,CME为实际测定浓度,ng·L-1;CPNE为无效应浓度,ng·L-1。CPNE值是慢性毒性数据(最低观察毒性效应浓度,NOEC)或急性毒性数据(半数致死浓度LC50或半数有效浓度EC50)与评估因子(AF)的比值。由于同种抗生素对不同物种的毒性效应不同,选用最敏感物种的CPNE进行评估。
1.6.2健康风险评估
为评估长江南京段水源水中抗生素对人体健康的风险,根据人体对抗生素的日均可接受量(acceptable daily intake,IAD),计算抗生素对人体健康的风险熵值(QRH)。计算公式为
QRH=CME/LDWE。
(2)
式(2)中,QRH为单一抗生素的健康风险熵;CME为抗生素的测定浓度,μg·L-1;LDWE为饮用水当量值,μg·L-1。
饮用水当量值计算公式为
LDWE=IAD×WB×QH/(IDW×BA×EFO) 。
(3)
式(3)中,IAD为日均可接受摄入量,μg·kg-1·d-1;WB为人均体重,kg;QH为最高风险,按1计算;IDW为每日饮水量,L·d-1;BA为胃肠吸收率,按1计算;EFO为暴露频率,350 d·a-1。不同年龄段人群WB及IDW取值见表1[21]。
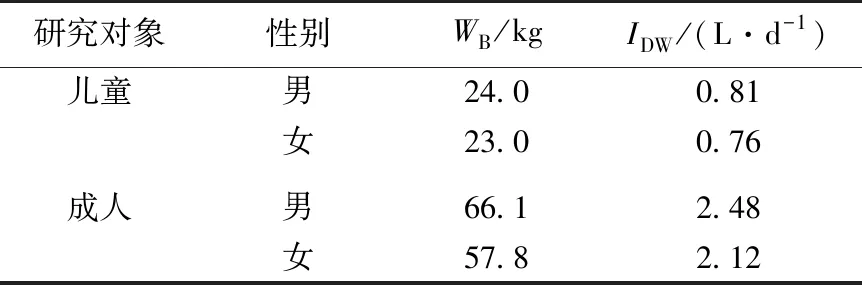
表1 成人及儿童平均体重(WB)以及每日饮水量(IDW)Table 1 Average body weight and daily water intake for adults and children
根据HERNANDO等[22]提出的抗生素对人体健康和生态风险熵(QR)的分类标准:当QR<0.01时,无风险;当0.01≤QR< 0.1时,属于低风险;当0.1≤QR< 1时,属于中等风险;当QR≥ 1时,属于高风险。
2 结果与讨论
2.1 时空分布特征
分别于2019年11月、12月以及2020年1月在长江南京段14个采样点采集了表层水样,AMP的浓度分布见图2。
在连续3个月的检测中,AMP的浓度范围为ND~42.44 ng·L-1(ND为未检出,下同),总体平均浓度为19.67 ng·L-1,检出率为57.5%,与何欣等[9]报道的大连周边近岸水中AMP的浓度范围(ND~29.22 ng·L-1)相近,远低于王瑞杰等[10]报道的2018年宁波月湖中AMP最大浓度(328.0 ng·L-1)。2019年11月AMP的浓度范围为ND~28.44 ng·L-1,平均浓度为2.03 ng·L-1;2019年12月AMP的浓度范围为ND~42.34 ng·L-1,平均浓度为33.55 ng·L-1;2020年1月AMP的浓度范围为ND~42.44 ng·L-1,平均浓度为24.04 ng·L-1。其中12月AMP的检出率最高,达100%;11月的检出率最低,为7.14%。
从各监测点来看,2019年12月和2020年1月均在S13点位监测到AMP峰值,分别为42.34和42.44 ng·L-1,表明该区域AMP的使用量较大。在连续3个月中,S14点位AMP检出率为100%,表明该区域在冬季AMP的使用较为普遍;其中S5、S6、S8、S9、S10、S12和S13点位AMP的检出率均为66.7%,余下点位AMP的检出率为33.3%。此外,各点位3个月累计AMP检出浓度最高值出现在S14点位(103.14 ng·L-1),其次为S13点位(84.78 ng·L-1),最低为S1点位(30.38 ng·L-1)。
2.2 污染来源分析
抗生素在环境中的含量和分布特征主要与其使用量、使用模式、使用地区和环境因子等因素有关[23]。长江南京段建有南京长江大桥等设施场所,可以供市民休闲娱乐和观光旅游,生活污水、医院废水以及家用抗生素的不合理废弃等可能是长江南京段水体中抗生素的输入来源。AMP是临床上常用的广谱抗生素,长江南京段水体中AMP的平均质量浓度为19.67 ng·L-1,最高达42.44 ng·L-1。AMP在牛奶[24]、鸡、鸭等肉类食品的不同组织中[25]均有检出。11月采样检测中只有S14点位有检出,检出率为7.14%,12月14个采样点位全部检出,检出率为100%,可能是南京市冬季天气变化使感染性疾病患者增多,而AMP具有天然青霉素的抗菌谱性,对于肺炎有特别好的疗效,是治疗感染性疾病常用的药物之一[26],AMP的使用量增加导致长江南京段水源水中各采样点抗生素检出率增加;同时11月、12月和1月的水样中S14点位均检测出AMP,质量浓度分别为28.44、36.00和38.70 ng·L-1,一方面可能与该区域医院、家庭的AMP使用量较大有关;另一方面,检出浓度的增加可能与上游水体中AMP浓度有关。
2.3 风险评估
2.3.1生态风险评估
采用单一风险熵值法评估AMP。根据文献[27],AMP毒理数据评估因子(AF)为100,CPNE为75 ng·L-1。由图3可知,长江南京段AMP的生态风险熵(QR)范围为0.40~0.57,表明AMP对长江南京段的生态环境具有中度风险;其中S13的QR最高,为0.57,如果长期处于该水平,可能会诱导生物体产生抗生素抗性基因,而抗生素抗性基因已成为新兴环境污染物[28],势必会对生态环境和人体健康造成危害。因此有必要采取措施控制AMP进入长江南京段,从而保护长江生态系统的安全。
2.3.2健康风险评估
评估长江南京段水体中AMP的人体健康风险水平,因考虑最大风险而选取各采样点各月份检测浓度最大值来计算人体健康风险熵。AMP是半合成青霉素,抗菌谱相同,参考青霉素IAD值0.03 mg·kg-1·d-1[29]。由图4可知,长江南京段AMP对人体健康风险熵(QRH)的范围为3.2×10-5~5.1×10-5,均小于0.01,无健康风险,且QRH整体上呈现出成人大于儿童,同一年龄段中男性比女性稍高的趋势。虽然该结果表明长江南京段中AMP对人体健康无直接风险,但是有研究表明,通过饮水而进入人体(尤其是儿童)的抗生素,是造成肥胖的因素之一[30]。因此水体中残留的痕量抗生素对人体健康的长期影响不容忽视。
3 结论
(1)长江南京段水体中,AMP在2019年11月、2019年12月和2020年1月3个月中检出浓度范围分别为ND~28.44、26.04~42.34 和ND~42.44 ng·L-1,检出率分别为7.14%、100%、66.67%,平均浓度为34.20 ng·L-1,处于低污染水平。
(2)2019年12月和2020年1月AMP检出浓度和检出率总体上高于11月。
(3)根据风险评估标准,长江南京段AMP的生态风险熵QR范围为0.40~0.57,处于中度风险水平;AMP的健康风险熵(QRH)范围为3.2×10-5~5.1×10-5,对人体无健康风险,但是QRH整体上呈现出成人大于儿童,且同一年龄段中有男性比女性高的趋势。
