好食脉孢霉发酵产类胡萝卜素的鉴定、抗氧化性及稳定性研究
2021-03-01邓永平车鑫艾瑞波刘晓兰辛嘉英王晓杰
邓永平,车鑫,艾瑞波,刘晓兰,辛嘉英,王晓杰
1(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔,161006)2(黑龙江省玉米深加工理论与技术重点实验室,黑龙江 齐齐哈尔,161006)3(哈尔滨商业大学,省高校食品科学与工程重点实验室,黑龙江 哈尔滨,150076)
类胡萝卜素具有保护视力、抗氧化、提高免疫力等多种生理功效,在食品、医药和饲料等领域有重要应用价值[1]。类胡萝卜素种类繁多,类胡萝卜素数据库(http://carotenoiddb.jp)目前提供了来自生命领域的691种生物中发现的1 158种类胡萝卜素,但是人类能够通过饮食吸收的只有约50种,其中β-胡萝卜素、虾青素、叶黄素和番茄红素是常见的重要的类胡萝卜素[2]。植物中提取和化学合成是类胡萝卜素的传统生产方法。但是,这两种方法都有局限性,植物源类胡萝卜素受原料来源、生长周期等因素的影响[3];化学合成的类胡萝卜素安全性和环保性受到质疑[4]。在这种情况下,来源于微藻、霉菌、酵母菌和细菌等微生物的天然类胡萝卜素引起了人们极大的兴趣[5]。
类胡萝卜素分子结构中存在类异戊二烯共轭双键,因此具有较强的抗氧化活性,能够保护细胞和组织免受活性氧破坏,对维持机体健康和预防疾病有重要作用[6];但是同时也导致其易受氧气、光和热等环境因素的破坏,从而影响类胡萝卜素的营养价值[5, 7]。因此,对类胡萝卜素的抗氧化性和稳定性进行研究是指导应用的基础。本文在前期研究的基础上[8]对好食脉孢霉(Neurosporasitophila)类胡萝卜素进行初步鉴定,并研究其抗氧化性和稳定性,以期为好食脉孢霉类胡萝卜素的应用提供依据。
1 材料与方法
1.1 菌种
好食脉孢霉(N.sitophila),分离自发酵豆制品,保藏于中国普通微生物菌种保藏管理中心,保藏号CGMCC No.1836。
1.2 试剂和仪器
中性氧化铝(100目),天津市光复精细化工研究所;全反式β-胡萝卜素,纯度≥96%(HPLC),上海阿拉丁生化科技股份有限公司;甲醇、乙腈等试剂均为国产分析纯,国药集团化学试剂有限公司。
赛默飞超高效液相色谱/四极杆-轨道阱质谱联用仪(Thermo UltiMate 3000 UPLC/Q-Exactive Orbitrap MS),赛默飞世尔科技(中国)有限公司;CF15RX Himac冷冻离心机,日立(中国)有限公司;TU-1901紫外可见分光光度计,北京普析通用仪器有限责任公司;层析柱(Φ2.6 cm×30 cm),生工生物工程(上海)股份有限公司。
1.3 实验方法
1.3.1 固态发酵制备类胡萝卜素
固态发酵:250 mL三角瓶中加入5 g干醋糟、0.1 g干豆渣,干醋糟质量与水的体积比为1∶3,添加0.8 mL番茄汁溶液(番茄洗净榨汁,用蒸馏水配制体积分数为5%的溶液),体积计入培养基的加水量中。培养基初始pH值为5.5,接入好食脉孢霉孢子106个/g干基,在28 ℃培养120 h。
固态发酵结束后在低于45 ℃的环境中干燥发酵产物至恒重。
1.3.2 类胡萝卜素的提取和定量
依据参考文献[8]制备好食脉孢霉类胡萝卜素丙酮提取液,采用分光光度法测量类胡萝卜素含量[8]。具体方法:称取1 g干燥的发酵产物,加入10 mL浓度为1 mol/L的 HCl,常温振荡1 h(150 r/min),取出沸水浴5 min,迅速冰浴冷却,4 ℃、7 000 r/min离心10 min除去HCl,加入适量蒸馏水洗涤并离心,弃去上清液。加入20 mL丙酮提取沉淀中的类胡萝卜素,4 ℃、7 000 r/min离心10 min,收集上清液,用丙酮重复提取,直至上清液无色,在455 nm处测吸光值。根据公式(1)计算类胡萝卜素含量:
(1)
式中:B,每克发酵产物中类胡萝卜素的质量,μg/g;Aλmax,455 nm处的吸光值;D,样品稀释倍数;V,丙酮体积,mL;0.16,类胡萝卜素的摩尔消光系数;m,样品质量,g。
1.3.3 类胡萝卜素的分离和初步鉴定
利用氧化铝柱层析对好食脉孢霉类胡萝卜素的丙酮提取液进行初步纯化。称取约120 g氧化铝(200~300目),采用湿法装柱,柱床高度26 cm,样品质量浓度5.67 mg/mL,上样量为10 mL,经过V(丙酮)∶V(石油醚)=4∶6的混合溶液洗脱,利用部分收集器定时收集流出液,离线测定455 nm处吸光值。
利用Thermo Ultimate 3000 UPLC/Q-Exactive Orbitrap MS对经氧化铝柱层析纯化的类胡萝卜素进行初步鉴定。色谱柱:Thermo GOLD HYPERSIL (2.1 mm×50 mm, 1.9 μm)。液相色谱条件:D为100%乙腈,等度洗脱,流速0.3 mL/min;柱温22 ℃,上样量5 μL。电喷雾离子源正离子模式扫描。
1.3.4 类胡萝卜素的抗氧化活性测定
用无水乙醇配制好食脉孢霉类胡萝卜素、α-生育酚、丁基羟基茴香醚(butyl hydroxylanisole, BHA)、特丁基对苯二酚(tert-butyl hydroquinone, TBHQ)和β-胡萝卜素溶液,质量浓度均为1、2、3、4、5、6 μg/mL,以α-生育酚、BHA、TBHQ和β-胡萝卜素为参照物,通过测定DPPH自由基清除率、羟自由基清除率和总还原力评价好食脉孢霉类胡萝卜素的抗氧化活性。
1.3.4.1 DPPH自由基清除率测定方法
将2 mL样品溶液和2 mL DPPH溶液混合,避光反应30 min,测517 nm处吸光值(Ai);将2 mL样品和2 mL无水乙醇混合,避光反应30 min,测517 nm处吸光值(Aj);将2 mL DPPH溶液和2 mL无水乙醇混合,避光反应30 min,测517 nm处吸光值(A0)。DPPH自由基清除率的计算如公式(2)所示:
(2)
1.3.4.2 羟自由基清除率测定方法
取2 mL样品溶液,依次加入2 mL 6 mmol/L的FeSO4和2 mmol/L的H2O2,静置10 min后加入2 mL 6 mmol/L水杨酸,反应30 min后在510 nm处测得吸光值Ai;分别用蒸馏水代替水杨酸和样品,在510 nm处测得吸光值Aj和A0。羟自由基清除率的计算如公式(3)所示:
(3)
1.3.4.3 总还原力测定方法
取2 mL样品溶液,分别加入2 mL磷酸盐缓冲液(pH 6.6、0.2 mol/L)、2 mL的铁氰化钾溶液(10 g/L),50 ℃保温20 min后加入2 mL三氯乙酸溶液(100 g/L),4 000 r/min离心10 min,取上清液2 mL,加入2 mL蒸馏水和0.4 mL FeCl3溶液(1 g/L),50 ℃保温10 min,测定700 nm处的吸光值。以蒸馏水代替样品作为对照。
1.3.5 类胡萝卜素的稳定性
1.3.5.1 光照对类胡萝卜素稳定性的影响
取类胡萝卜素丙酮提取液10 mL,置于黑暗、自然光、日光灯 (功率40 W,距离20 cm)环境中,25 ℃放置3、12、24、36、48、60、72 h 后取样,测定455 nm处吸光值,以黑暗保存3 h为对照计算类胡萝卜素的相对含量。
1.3.5.2 温度对类胡萝卜素稳定性的影响
取类胡萝卜素丙酮提取液10 mL,分别于4、25、50、80 ℃条件下避光保存0、4、8和20 h,测定455 nm处吸光值,以每个温度下0 h为对照计算类胡萝卜素的相对含量。
1.3.5.3 金属离子对类胡萝卜素稳定性的影响
将类胡萝卜素丙酮提取液分别与等体积KCl、NaCl、FeCl3、MgCl2、CaCl2、BaCl2、CuSO4溶液混合,使各金属离子在混合体系中的终浓度为50 mmol/L,用丙酮代替金属离子溶液作为对照,在25 ℃分别避光保存0、3、6、12 和24 h,测定455 nm处吸光值。
1.3.6 数据分析
利用SPSS 11.5软件对数据进行统计分析,所有实验均重复3次,采用Duncan法进行多重比较。同一组柱状图上标记不同小写字母表示差异显著(P<0.05)。
2 结果与分析
2.1 类胡萝卜素的初步鉴定
利用氧化铝柱层析纯化了好食脉孢霉类胡萝卜素,对纯化产物进行了液相色谱-质谱(liquid chromatograph-mass spectrometer,LC-MS)鉴定,结果见图1和图2。

a-好食脉孢霉类胡萝卜素HPLC图谱;b-全反式β-胡萝卜素标准品HPLC图谱图1 HPLC图谱Fig.1 HPLC chromatogram
如图1-a所示,好食脉孢霉类胡萝卜素HPLC图谱在3.57 min出现了较大洗脱峰,与图1-b中全反式β-胡萝卜素标准品的保留时间3.54 min基本一致,初步判断好食脉孢霉类胡萝卜素中含有全反式β-胡萝卜素。推测4.71 min出现的洗脱峰可能是β-胡萝卜素的同分异构体[2]。
如图2所示,类胡萝卜素质谱图谱中质荷比为536.43的离子峰与全反式β-胡萝卜素标准品几乎一致,结合图1结果可确定全反式β-胡萝卜素是好食脉孢霉类胡萝卜素中主要成分之一。β-胡萝卜素具有高VA活性,是生理功能最突出的天然类胡萝卜素之一,应用及其广泛[9]。因此,好食脉孢霉发酵醋糟产类胡萝卜素具有广阔的开发前景。

a-好食脉孢霉类胡萝卜素质谱图;b-全反式β-胡萝卜素标准品质谱图图2 质谱图谱Fig.2 LC-MS chromatogram
2.2 好食脉孢霉类胡萝卜素的抗氧化活性
2.2.1 DPPH自由基清除率
DPPH自由基法广泛用于评估化合物的抗氧化活性[10]。好食脉孢霉类胡萝卜素、α-生育酚、BHA、TBHQ和β-胡萝卜素的DPPH自由基清除率见图3。

图3 类胡萝卜素和抗氧化剂的DPPH自由基清除作用Fig.3 Scavenging effect of carotenoids and antioxidants on DPPH free radical注:不同小写字母表示差异显著(P<0.05)(下同)
如图3所示,随着类胡萝卜素及各种抗氧化剂浓度的增大,DPPH自由基清除率逐渐增强;类胡萝卜素质量浓度在1~6 μg/mL时的,DPPH自由基清除率显著高于α-生育酚、BHA和β-胡萝卜素(P<0.05);在质量浓度为1、2 μg/mL时DPPH自由基清除率显著高于TBHQ(P<0.05),但是质量浓度增加至3 μg/mL后的DPPH自由基清除率显著低于TBHQ(P<0.05)。在质量浓度为6 μg/mL时类胡萝卜素、α-生育酚、BHA、TBHQ和β-胡萝卜素的DPPH自由基清除率分别为60.21%、26.8%、43.45%、77.81%和7.19%。
研究表明,多种抗氧化剂联合使用时,可能因为修复再生、偶联氧化等协同作用,而使抗氧化效果较使用同等剂量的单一抗氧化剂效果明显[11-12]。在图4中可知,好食脉孢霉类胡萝卜素的DPPH自由基清除率显著高于β-胡萝卜素,这是因为类胡萝卜素提取物中含β-胡萝卜素及其合成过程的中间产物,多种成分协同释氢中和自由基而使DPPH自由基清除率效果高于β-胡萝卜素单独作用效果[13]。
2.2.2 羟自由基清除率
好食脉孢霉类胡萝卜素、α-生育酚、BHA、TBHQ和β-胡萝卜素的羟自由基清除率见图4。
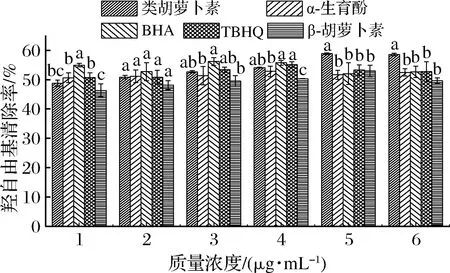
图4 类胡萝卜素和抗氧化剂的羟自由基清除作用Fig.4 Scavenging effect of carotenoids and antioxidants on ·OH
如图4所示,在质量浓度为1 μg/mL时,类胡萝卜素的羟自由基清除率显著低于BHA(P<0.05);当质量浓度为4 μg/mL时显著高于β-胡萝卜素(P<0.05);当质量浓度为5、6 μg/mL时,类胡萝卜素的羟自由基清除率显著高于α-生育酚、BHA、TBHQ和β-胡萝卜素(P<0.05)。抗氧化剂的抗氧化作用具有高度的浓度依赖性,多种抗氧化物质只有在适宜浓度下才最有利于发挥协同抗氧化的作用[12, 14]。好食脉孢霉类胡萝卜素是一种含β-胡萝卜素的多种类胡萝卜素混合物,因此,表现出明显的浓度依赖性,在粗糙脉孢霉类胡萝卜素的抗氧化性研究中也出现相似的结果[15]。
2.2.3 总还原力
好食脉孢霉类胡萝卜素、α-生育酚、BHA、TBHQ和β-胡萝卜素的总还原力见图5。
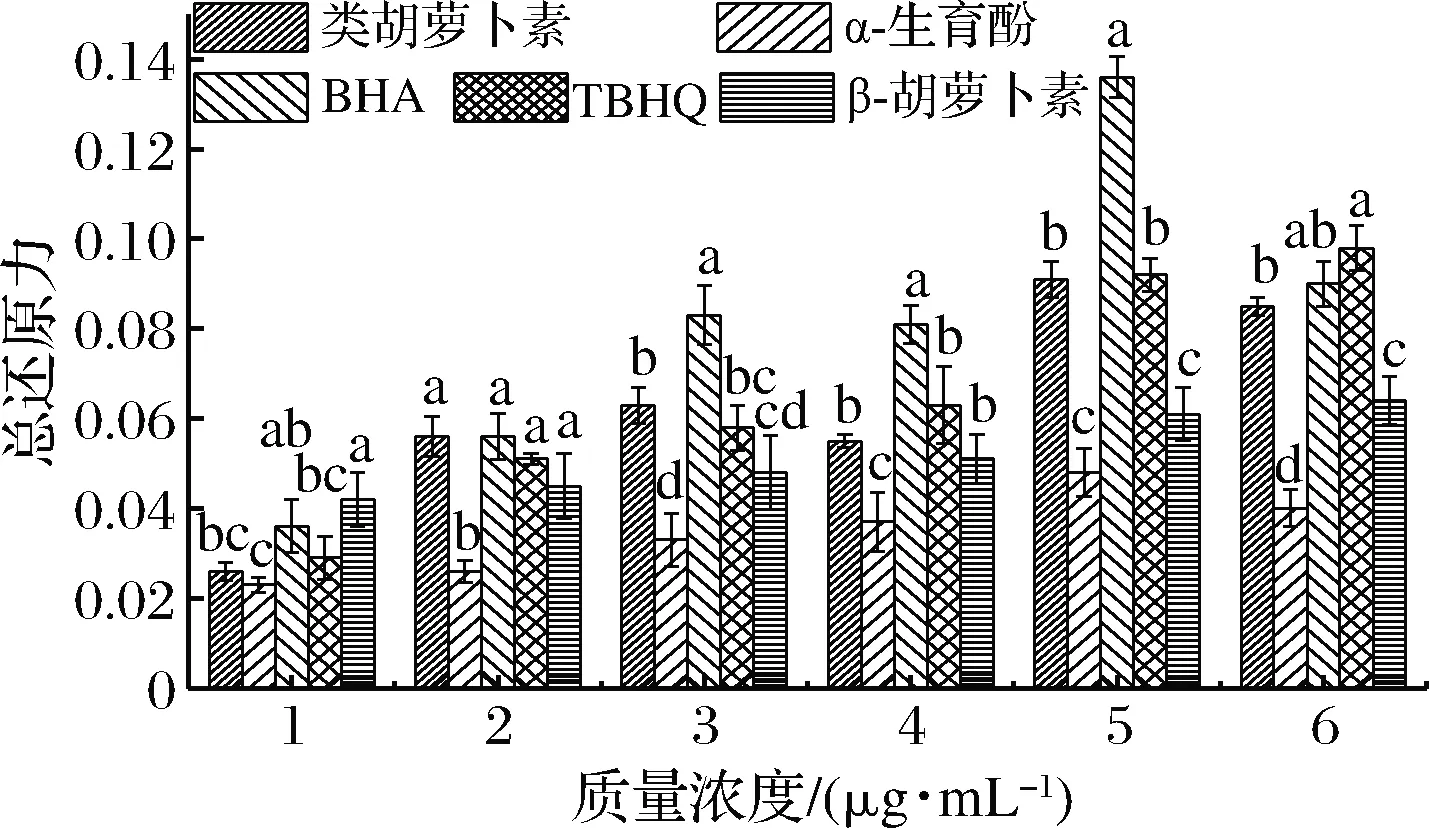
图5 类胡萝卜素和抗氧化剂的总还原力Fig.5 The total reducing ability of carotenoids and antioxidants
如图5所示,类胡萝卜素的总还原力显著高于α-生育酚(P<0.05);当质量浓度为5、 6 μg/mL时,类胡萝卜素的总还原力显著高于β-胡萝卜素(P<0.05)。与合成抗氧化剂BHA和TBHQ相比,当质量浓度为3、4、 5 μg/mL时,类胡萝卜素的总还原力显著低于BHA(P<0.05),6 μg/mL时类胡萝卜素的总还原力显著低于TBHQ(P<0.05)。
通过比较好食脉孢霉类胡萝卜素与4种商品抗氧化剂的DPPH自由基清除率、羟自由基清除率和总还原力,可以确定好食脉孢霉类胡萝卜素具有较强的抗氧化活性。
2.3 类胡萝卜素的稳定性
2.3.1 光照对类胡萝卜素稳定性的影响
光照易引起类胡萝卜素形成顺反双键,使电磁波谱向蓝端漂移2~10 nm;此外,光照还可能加速类胡萝卜素的氧化,使呈色基团降解,失去颜色[16]。光照对好食脉孢霉类胡萝卜素稳定性的影响见图6。

图6 光照对类胡萝卜素稳定性的影响Fig.6 Effects of light on the stability of carotenoids
由图6可知,在避光保存条件下,类胡萝卜素含量随时间延长缓慢下降,在保存至72 h时,类胡萝卜素含量较保存3 h时下降了约26%。在光照条件下,类胡萝卜素含量随光照时间延长迅速下降。日光灯对类胡萝卜素的破坏效果要高于自然光,在保存至72 h时,类胡萝卜素含量较保存3 h时下降了约48%。这与韩永斌等[17]的研究结果一致。由此可知,类胡萝卜素宜在避光条件下保存。
2.3.2 温度对类胡萝卜素稳定性的影响
高温易使类胡萝卜素因发生环氧化而失去其稳定的结构或形成同分异构体[18-19]。温度对好食脉孢霉类胡萝卜素稳定性的影响结果见图7。

图7 温度对类胡萝卜素稳定性的影响Fig.7 Effects of temperature on the stability of carotenoids
如图7所示,随着温度的升高和保存时间的延长,类胡萝卜素的相对含量呈逐渐下降趋势。在4、25、50和80 ℃保存20 h时类胡萝卜素相对含量分别为98.91%、94.13%、81.30%和47.95%。综上所述,好食脉孢霉类胡萝卜素在温度低于50 ℃时较稳定,该温度下的稳定性较柚皮类胡萝卜素强,但较蛹虫草类胡萝卜素的温度稳定性弱[20-21]。
2.3.3 金属离子对类胡萝卜素稳定性的影响
研究了K+、Na+、Mg2+、Ca2+、Ba2+、Cu2+、Fe3+对好食脉孢霉类胡萝卜素稳定性的影响,结果见图8。

图8 金属离子对类胡萝卜素含量的影响Fig.8 Effects of metal ion on the stability of carotenoids
如图8所示,不同金属离子对类胡萝卜素具有不同的影响,随着共存时间的延长,类胡萝卜素的相对含量均呈现下降的趋势。与Ca2+共存24 h时类胡萝卜素相对含量下降近50%;与Ba2+共存24 h时类胡萝卜素相对含量已经下降至20%;Fe3+与类胡萝卜素共存时产生絮状沉淀,无法测定吸光值,所以未在图8中列出结果。蛹虫草类胡萝卜素和红球菌(Rhodococcussp.)B7740的β-胡萝卜素对Fe3+也极其敏感[21-22],可能是因为在Fe3+等金属离子的作用下使类胡萝卜素异构化及氧化分解所致[23]。上述研究结果说明,好食脉孢霉类胡萝卜素保存及应用过程中不宜与以上金属离子(特别是Fe3+)共存。
3 结论
本文对来自好食脉孢霉固态发酵产物的类胡萝卜素进行了初步鉴定,并研究了其抗氧化活性和稳定性。结果显示β-胡萝卜素是好食脉孢霉类胡萝卜素的主要成分之一;与α-生育酚、BHA和β-胡萝卜素相比,该类胡萝卜素表现出较强的抗氧化活性;类胡萝卜素宜在避光、温度低于50 ℃条件下保存,金属离子特别是Fe3+对类胡萝卜素具有一定破坏作用,因此,在应用中应采用微胶囊化、微乳液等技术保护类胡萝卜素的结构和生理活性。通过本文的研究,有望为好食脉孢霉类胡萝卜素在食品或饲料工业的应用奠定基础,为β-胡萝卜素提供新的来源。
