光谱技术分析尿素对BSA糖基化反应的影响
2021-02-03刘光宪涂宗财
李 雪,王 丽,刘光宪*,涂宗财
1.江西省农业科学院农产品加工研究所,江西 南昌 330200 2.江西师范大学生命科学学院,江西 南昌 330022
引 言
蛋白质的结构展开与其糖基化反应之间存在较大的相关性,可以促进蛋白质结构展开的有化学试剂[1-2](尿素、二硫苏糖醇等)、超声波[3]、动态高压微射流[4]等,Yang等[3]研究发现高强度超声波可以促进卵清蛋白结构的去折叠,提高糖基化反应程度;Zhong等[4]研究发现动态高压微射流在80 MPa以下时会使β-乳球蛋白结构展开;Huang等[2]研究发现二硫苏糖醇可使卵白蛋白的二硫键断裂,蛋白质结构展开,糖基化位点从7个增加至12个。但是尚未见研究尿素对牛血清白蛋白(bovine serum albumin,BSA)糖基化产物影响的报道。
由于大部分蛋白质都具有荧光特性,在外力作用或与其他物质作用后,其荧光特性和高级结构可能发生改变。Tang等[5]采用光谱技术测定了不同条件下云扁豆蛋白与葡糖糖反应的结构和理化性质的变化;Anjana Roy等[6]通过荧光光谱和圆二光谱分析了葡糖糖修饰血红素蛋白前后的二级和三级结构变化;Zhong等[7]采用紫外分析和内源荧光光谱分析法,研究了动态高压微射流对β-乳球蛋白与低聚半乳糖糖基化反应前后构象的变化,因此,可以运用蛋白质的光谱学特性分析不同尿素浓度对蛋白质糖基化产物的影响。
血清白蛋白是脊椎动物的血浆和血清中含量最高的一种可溶于水的大分子蛋白[8],含量高达40 mg·mL-1,约占血浆中总蛋白的52%~62%,具有维持血液渗透压、调节血液pH及转运脂肪酸、氨基酸、金属离子、类固醇、药物等多种物质的生理功能[9-10]。其中,BSA是牛血液和牛奶中常见的一种球状蛋白,其序列与人血清白蛋白(human serum albumin,HSA)具有76%的同源性,是由583个氨基酸残基组成的单肽链,是一种常用的模式蛋白,可作为动物来源的代表蛋白[11]。故本文选用BSA为模式蛋白,开展相关研究可为其他动物蛋白的糖基化改性提供理论参考。尿素常作为非蛋白氮原料添加至动物饲料中,因此,本研究的开展可为探索尿素对动物体内甚至是人体内新陈代谢的影响提供理论支撑。
首先采用不同浓度尿素诱导BSA结构发生不同程度的展开,再与葡萄糖进行糖基化反应,基于三维荧光光谱、同步荧光光谱、内源荧光光谱和紫外光谱技术分析不同浓度尿素诱导对BSA糖基化反应产物空间结构的影响,揭示尿素对BSA糖基化的作用规律,为基于尿素导致的蛋白质结构展开对蛋白质糖基化反应的影响提供理论依据。
1 实验部分
1.1 材料、试剂及仪器
BSA、D-葡萄糖均购于Sigma化学试剂公司;尿素、Tris-HCl均为国产分纯。
U-2910紫外光谱扫描仪,日本HITACHI公司;F-7000荧光光谱扫描仪,日本HITACHI公司。
1.2 方法
1.2.1 样品制备
用pH为7.4浓度为0.05 mol·L-1的Tris-HCl溶液配置成100 mg·mL-1的BSA溶液,用同浓度的Tris-HCl溶液配置尿素溶液,浓度分别为0,1,2,3,4,5,6和7 mol·L-1,尿素浓度0 mol·L-1为本实验对照组;在15 mL的离心管中加入0.1 mL BSA溶液,将不同浓度尿素溶液等体积分别加入离心管混合均匀,37 ℃水浴2 h后加入与蛋白质量比为1∶1的葡萄糖,60 ℃水浴3 h,样品制备完成,置于4 ℃冰箱备用。
1.2.2 自由氨基的测定
采用邻苯二甲醛(o-phthalaldehyde,OPA)法测定BSA糖基化产物中自由氨基的含量,OPA试剂的配制方法参照文献[12]。取200 μL样品溶液,加入配好的OPA试剂溶液4.0 mL,混匀,35 ℃避光反应2 min,于340 nm处测定其吸光值,空白采用200 μL蒸馏水。以赖氨酸做标准工作曲线,然后根据标准曲线计算样品中自由氨基的含量。
1.2.3 内源荧光光谱分析
对不同浓度尿素处理的BSA糖基化样品溶液(1 mg·mL-1)进行内源荧光光谱分析。内源荧光参数设置:激发波长为280 nm,发射光谱扫描范围为300~500 nm,扫描速度为240 nm·min-1,激发和发射的狭缝宽度均为5 nm。
1.2.4 同步荧光光谱分析
对不同浓度尿素处理的BSA糖基化样品溶液(1 mg·mL-1)进行同步荧光荧光光谱分析。固定激发和发射波长的间隔为Δλ=15 nm和Δλ=60 nm,在25 ℃下扫描同步荧光光谱。
1.2.5 紫外光谱分析
对不同浓度尿素处理的BSA糖基化样品溶液(1 mg·mL-1)进行紫外扫描,扫描范围为190~450 nm,扫描速度为200 nm·min-1,狭缝宽度为1.50 nm。
1.2.6 三维荧光光谱分析
对不同浓度尿素处理的BSA和3 mol·L-1尿素浓度处理的糖基化BSA样品溶液(1 mg·mL-1)进行三维荧光荧光光谱分析。三维荧光分析的参数为激发波长扫描范围:200~600 nm,发射波长扫描范围:200~600 nm,扫描速率为12 000 nm·min-1,狭缝宽为5 nm。
2 结果与讨论
2.1 自由氨基含量变化
BSA的糖基化反应是葡萄糖分子的羰基与蛋白质分子的氨基通过共价键相互交联而形成的糖蛋白化学反应,因此BSA自由氨基含量的变化可以反映其糖基化程度。从图1可以看出,经过不同浓度尿素处理的BSA,其糖基化产物的自由氨基含量均显著下降。这说明尿素处理可使BSA分子的空间结构发生不同程度的伸展,使BSA分子中的氨基暴露在蛋白质分子表面,葡萄糖的羰基更易与BSA分子中的氨基发生共价交联反应,促进了BSA与葡萄糖的糖基化反应。故经过尿素处理的BSA,其糖基化产物中的自由氨基含量均显著下降。从图1还可看出,在尿素浓度为3 mol·L-1时,BSA糖基化产物的自由氨基含量降至最低为8.75 mg·kg-1,糖基化程度达到最大。而高浓度尿素(4~7 mol·L-1)处理的BSA糖基化产物的自由氨基含量高于尿素浓度为3 mol·L-1时的自由氨基含量,可能是由于高浓度的尿素对BSA的糖基化反应形成了空间位阻,阻碍了葡萄糖分子与BSA分子的共价交联。

图1 不同浓度尿素处理的BSA糖基化产物的自由氨基含量分析Fig.1 The free amino group content of glycosylation of BSA treated with different concentrations of urea
2.2 内源荧光光谱分析
BSA的内源性荧光主要来自分子内部的色氨酸残基(Trp)、酪氨酸残基(Tyr)和苯丙氨酸残基(Phe),其中BSA分子中Trp残基的荧光强度远远大于Tyr残基和Phe残基,因此可以用BSA分子中的Trp残基作为内源荧光探针来分析不同尿素浓度对BSA糖基化产物内源性荧光强度的影响。
从图2可以看出,尿素的加入使BSA糖基化产物的内源荧光强度显著下降,且随着尿素浓度的增加BSA糖基化产物的内源性荧光强度呈逐渐降低的趋势。BSA有两个色氨酸残基Trp134和Trp213(如图3所示),其中Trp213位于BSA分子疏水腔内,而Trp134位于BSA分子表面[13],因此引起BSA糖基化产物内源性荧光强度显著下降的原因可能是由于尿素诱导后的BSA发生了去折叠,降低了Trp残基之间的能量传递,导致BSA分子疏水腔内的Trp213外翻至分子表面,且随着尿素浓度的增加,Trp213逐渐暴露于溶剂中,从而发生荧光猝灭,使得糖基化产物的内源性荧光强度显著下降。从图2还可以看出尿素浓度为1~4 mol·L-1时,BSA糖基化产物的最大发射波长发生了轻微的蓝移(从340到336 nm),这是由于BSA与葡萄糖糖发生糖基化反应后,Trp所处的微环境发生变化,疏水性增加,使得BSA糖基化产物的最大发射波长蓝移。此外,与对照样品对比,当尿素浓度大于4 mol·L-1,最大发射波长逐渐发生红移,从336 nm红移至340 nm,这可能是由于高浓度的尿素处理使得Trp残基周围环境的疏水性降低,亲水性增加,BSA分子已经完全伸展变形,使Trp残基完全暴露于溶剂中。

图2 不同浓度尿素处理的BSA糖基化产物的荧光光谱Fig.2 Fluorescence spectra of glycosylation of BSA treated with different concentrations of ureaa→b:0,1,2,3,4,5,6,7 mol·L-1

图3 BSA的空间结构图Fig.3 The space structure of BSA
2.3 同步荧光光谱分析
蛋白质的同步荧光光谱已被广泛用于研究蛋白质的结构变化,是一种快速、灵敏、无损的分析方法,可用来研究蛋白质分子中发色基团空间结构的变化以及周围微环境的变化。由于内源荧光无法区分BSA分子中Trp残基和Tyr残基的荧光光谱,因此,采用同步荧光光谱法测定不同浓度尿素处理的BSA糖基化样品空间结构的变化。Δλ=15 nm同步荧光光谱显示BSA糖基化产物中Tyr残基的光谱特征,Δλ=60 nm所得到的同步荧光光谱图显示BSA糖基化产物中Trp残基的荧光光谱特征,其残基的最大发射波长与BSA糖基化产物所处的环境极性有关,如果最大发射波长发生改变,说明残基所处的微环境发生改变。图4为不同浓度尿素处理对BSA糖基化产物同步荧光强度的影响。如图4(a)所示,在BSA浓度固定在1 mg·mL-1时,随着尿素浓度的增加,1~3 mol·L-1尿素浓度处理后BSA最大发射波长的强度高于未加尿素对照组,而4~7 mol·L-1的尿素浓度处理后的BSA最大发射波长的强度低于未加尿素对照组,且Tyr残基的特征荧光光谱峰位置发生蓝移,说明经过4~7 mol·L-1尿素处理之后的BSA糖基化产物的Tyr残基所在的微环境发生改变,疏水性增加,亲水性降低。对比图4(a)和(b)可知,Trp残基的荧光强度远远高于Tyr残基的荧光强度,而且相比Tyr残基的荧光强度,Trp残基的荧光强度下降更为显著,表明尿素与BSA的结合点更接近于Trp残基,但同时Trp残基的最大发射波长略有蓝移,说明其附近的疏水性发生一定程度地增强,极性减小,疏水性增加,BSA分子发生去折叠,Trp残基由分子内部展开至蛋白质表面。

图4 不同浓度尿素处理的BSA糖基化产物的同步荧光光谱Fig.4 Synchronous fluorescence spectra after glycosylation of BSA in different urea treatments(a):Δλ=15 nm,(a→b):1,2,3,0,4,5,6,7 mol·L-1;(b):Δλ=60 nm,(a→b):0,1,2,3,4,5,6,7 mol·L-1
2.4 紫外光谱扫描分析
紫外扫描分析是一种简单易行的分析蛋白质空间构象变化的方法[14]。BSA在紫外区(190~450 nm)有紫外吸收,这与BSA分子中的芳香族氨基酸Trp,Tyr和Phe具有密切的关系。因此,可采用紫外扫描的方法来研究不同浓度尿素处理对BSA糖基化产物空间结构的影响。由图5可知,经尿素处理后的BSA糖基化产物的紫外吸收值均大于对照组,而且3 mol·L-1尿素浓度处理后的BSA糖基化产物的紫外吸收值均大于其他浓度,说明尿素的加入,在不同程度上打开了BSA的蛋白质分子结构,使BSA分子内部的芳香族氨基酸残基暴露于蛋白质表面;也可能是尿素处理使蛋白质结构展开,从而有利于BSA与葡萄糖发生羰胺缩合反应,产生较多的糖基化产物羟甲基糠醛,其在278 nm附近也有紫外吸收[15],且在3 mol·L-1的尿素浓度时最有利于糖基化产物的生成,此结果与上述自由氨基含量的测定结果一致。

图5 不同浓度尿素处理BSA糖基化样品的紫外扫描光谱Fig.5 Ultraviolet scanning spectra after glycosylation of BSA in different urea treatmentsa→b:3,4,5,7,6,2,1,0 mol·L-1
2.5 尿素对BSA三维荧光光谱的影响

从糖基化样品(尿素添加量为3 mol·L-1)的三维荧光光谱图(图6)和表1分析可发现,糖基化后BSA的荧光峰Ex/Em出现在280/370,与未糖基化反应的BSA和3 mol·L-1尿素浓度处理的BSA相比,其三维荧光有显著差异,最大发射波长发生了5和10 nm的蓝移,该现象表明经过尿素处理的BSA糖基化产物的肽链骨架发生了空间构象变化,其高级结构发生改变,BSA环境的疏水性增加,极性减小,该结果与同步荧光的研究结果一致。
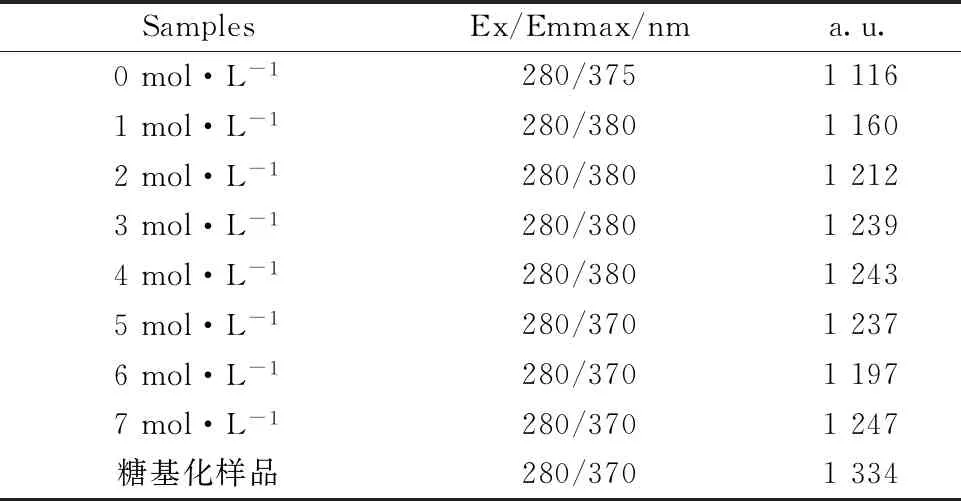
表1 典型三维荧光峰Table 1 Typical three-dimensional fluorescence peaks

图6 不同浓度尿素处理的BSA和糖基化BSA产物的三维荧光光谱图Fig.6 3D fluorescence spectra after glycosylation of BSA and BSA in different urea treatments
3 结 论
利用光谱技术来研究不同尿素浓度对BSA糖基化反应产物空间结构的影响,得到以下结论:
(1)通过内源荧光光谱分析可以看出,尿素的加入会使BSA分子去折叠从而促进蛋白质的糖基化反应,导致其糖基化产物的内源性荧光发生猝灭。
(2)通过同步荧光光谱分析得出BSA与尿素的结合点更接近于Trp残基。
(3)通过自由氨基和紫外吸收光谱分析得出BSA分子在尿素的诱导下紧密的空间结构变得松散,芳香族氨基酸暴露至表面,可促进糖基化反应进行,且3 mol·L-1尿素浓度下最有利与糖基化产物的生成。
(4)通过三维荧光光谱分析得出随着尿素浓度的增加,BSA的最大发射波长先红移再蓝移,经3 mol·L-1尿素诱导的BSA糖基化产物的肽链骨架的空间构象发生变化。
