神经肽FF 在小黄鱼(Larimichthys polyactis)性腺发育早期的表达与定位分析*
2021-02-03宋长普郑利兵迟长凤
肖 燃 宋长普 朱 阳 黄 伟 郑利兵 迟长凤① 楼 宝
(1. 浙江海洋大学海洋科学与技术学院 国家海洋设施养殖工程技术研究中心 海洋生物种质发掘与利用国家地方联合实验室舟山 316022; 2. 浙江省农业科学院水生生物研究所 杭州 310021)
神经肽 FF(Neuropeptide FF, FLFQPQRFa-NH2,NPFF)是一种类酰胺化神经肽, 属于 RF 氨基肽家族(Fukusumi et al, 2006)。神经肽FF 与促性腺激素抑制激素(GnIH)同源, 具有丰富的生理活性, 在调节应激对生殖的影响(Ubuka et al, 2018)、性成熟(Shahjahan et al, 2015)、调节血压(Allard et al, 1995)、体液平衡(Majane et al, 1991; Kalliomäki et al, 2004)、体温(Moulédous et al, 2010)、消化道运动(Decker et al,1997)、抗炎(Yang et al, 2003)、心血管功能(Laguzzi et al, 1996)、脂肪细胞分化(Lefrère et al, 2002)和内分泌(Jhamandas et al, 2013)等方面发挥着重要作用。
小黄鱼(Larimichthys polyactis)又名小黄花, 属于石首鱼科(Sciaenidae)黄鱼属(Larimichthys), 与带鱼(Trichiurus lepturus) 、 曼 氏 无 针 乌 贼 (Sepiella japonica)、大黄鱼(Larimichthys crocea)同被誉为东海“四大海产”之一(Park et al, 2019)。目前各国学者研究主要集中在小黄鱼的资源分布等方面, 但对小黄鱼生殖调控的研究还相对较少(蒙子宁等, 2003; Wang et al, 2009)。由于过度捕捞、环境污染、气候环境变化等原因, 小黄鱼捕捞量急剧下降, 捕获的小黄鱼表现出日趋小型化、性成熟等现象, 种质资源退化严重,已经无法满足人们的消费需求(Chen et al, 1997; 严利平等, 2014)。目前已有学者对小黄鱼生殖周期、精液特性和精子结构等进行了研究(Lim et al, 2010; Le et al, 2011)。Wang 进一步通过实验发现KIF3A 可能在精子发生过程中参与核重塑和尾巴形成(Wang et al,2019), 但关于小黄鱼在生殖方面的研究十分有限。研究表明促性腺激素能与脑垂体生长激素受体相互作用, 说明神经内分泌调节能影响鱼类生长及性腺的发育(林浩然, 2000), 而神经肽FF 能同时调节神经内分泌和性腺发育。因此, 本实验开展神经肽 FF 在小黄鱼性腺发育过程中的潜在功能研究, 分析神经肽FF 基因在性腺发育早期的表达与定位, 为开展神经肽FF 的深入研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 小黄鱼样品采自浙江省宁波市象山港水产育种有限公司。选取健康有活力的第Ⅱ期小黄鱼[体长为(11±2) cm, 体重为(16±2) g], 取出脑、头肾、心、鳃、皮肤、性腺、脾脏、肝脏、胃、肌肉、肠道等组织(n=3), 立即在室温下 RNA 保存液浸泡1 h, 液氮中保存24 h, 然后转移至-80°C 冰箱中, 直至提取总RNA 反转录合成cDNA, 备用。脑、性腺(卵巢)放在预冷的4%多聚甲醛中固定, 用冰袋运回实验室, 4°C 冰箱保存备用。
1.1.2 实验试剂 RNA 保存液、RNAiso Plus、Ex Taq Mix、Reverse Transcriptase M-MLV (RNase H-)、TB GreenTMPremix Ex TaqTMII 均购于TaKaRa 公司、Riboprobe®Combination System-试剂盒购于 Promega科技有限公司、DIG RNA Labeling Mix、Anti-Digoxigenin-AP conjugate、BCIP/NBT 显色试剂盒均购于 Roche 科技有限公司、Anti-FMRFamide 购于ImmuoStar 公司、SABC 试剂盒购于上海生物工程股份有限公司。
1.2 实验方法
1.2.1 小黄鱼神经肽FF 基因组织表达特异性分析采用M-MLVRTase cDNA Synthesis Kit 反转录试剂盒合成cDNA 第一条链, -20°C 冰箱备用。选取小黄鱼 β-actin、18S 基因作为内参, 通过实时荧光定量PCR(qRT-PCR) 分析小黄鱼神经肽 FF 基因在不同组织中表达的差异性。根据所得神经肽FF 基因cDNA全长, 设计其 qRT-PCR 特异性引物, 引物序列见表1。选择第Ⅱ期性未成熟的小黄鱼三只做3 次生物学重复, 每次反应做3 次机械重复。qRT-PCR 实验操作参考SYBR Premix Ex Taq II (Tli RNaseH Plus)试剂说明书进行。qRT-PCR 结果以2-ΔΔCT方法换算成相对表达量, 单因素方差分析分析(One-way ANOVA)运用软件 SPSS 17.0 来实现, 显著性差异分析则通过SPSS17.0 的 Duncan 法得出, P<0.05 为显著差异; 利用Origin 8.1 软件进行柱状图绘图。
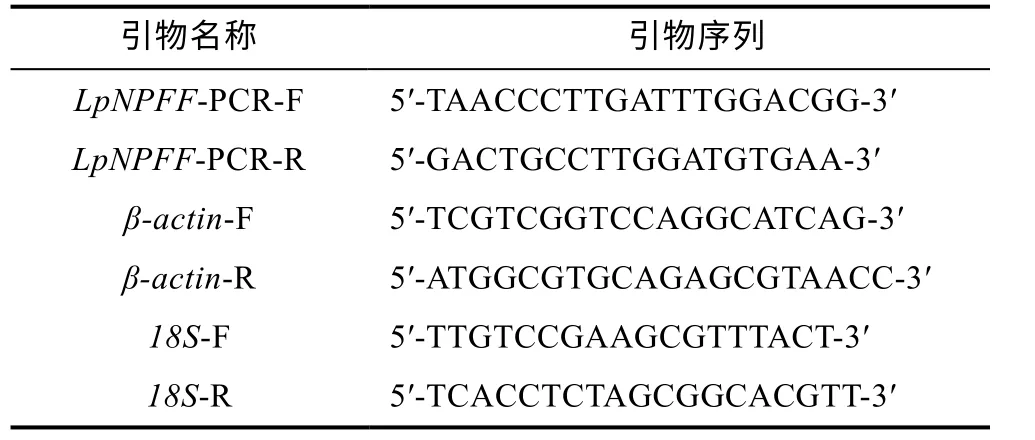
表1 小黄鱼神经肽FF 基因荧光定量引物Tab.1 Primers of LpNPFF used in real-time PCR
1.2.2 小黄鱼神经肽FF 基因在脑和卵巢中的定位分析 在小黄鱼神经肽FF 基因的ORF 区内设计原位杂交探针的引物, 反义探针(用A 表示)需在下游引物前加上T7 启动子序列, 正义探针(用S 表示)需在上游引物前加上T7 启动子序列, 引物序列参见表2。探针根 据 Riboprobe®CombinationSystem-SP6/T7 RNA Polymerase 试剂盒以及DIG RNA Labeling Mix 说明书进行操作。在杂交前对组织切片进行脱蜡、复水、通透处理, 并且在预杂交液中孵育 1 h (42°C); 暗盒中 50°C 杂交过夜; 滴加二抗(抗地高辛-AP 抗体, 稀释1∶2000), 室温暗盒中静置3 h; BCIP/NBT 染色封片后显微观察。
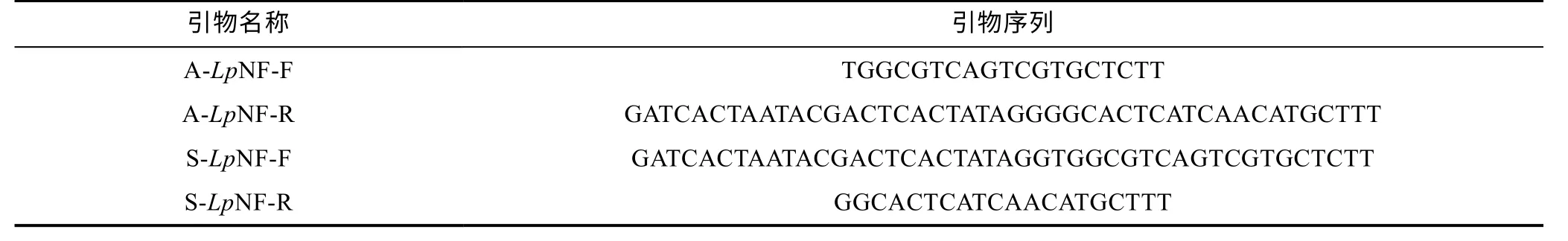
表2 LpNPFF 基因原位杂交引物Tab.2 Primers used in LpNPFF in situ hybridization
1.2.3 FaRPs 成熟肽在小黄鱼脑和卵巢中的定位分析 通过间接免疫过氧化物酶方法处理切片:将组织去石蜡、复水, 然后在pH 7.4 的0.1 mol/L PBS 中洗涤; 切片用0.3% H2O2处理以封闭内源性过氧化物酶。与胎牛血清孵育 20 min 后, 切片在 4°C 下与兔FMRFamide 多克隆抗体(1∶2000 稀释)在湿盒中孵育过夜(阴性对照以PBS 代替一抗); 将切片在PBS 中冲洗数次, 并在室温下与二抗(生物素标记羊抗兔 IgG)在PBS 中按1∶1000 稀释孵育30 min。在PBS 中漂洗两次后, 将抗生物素蛋白-过氧化物酶-偶联物溶液加入到载玻片中, 并在37°C 下孵育30 min。最后, 通过使用二氨基联苯胺(DAB)可视化反应产物, 并用苏木精染色细胞核。然后将切片洗涤、脱水、透明, 使用中性树脂封片, 显微镜下观察并拍照记录。
2 结果与分析
2.1 小黄鱼神经肽FF 基因组织表达特异性分析
以第Ⅱ期的小黄鱼各个组织为模板进行qRT-PCR 荧光定量分析LpNPFF 组织差异性情况。如图 1 所示, LpNPFF 在所有测试的组织中均有表达,包括脑、肾、性腺、头肾、心脏、肝脏、胃、脾脏、鳃、肠和肌肉。其中, LpNPFF 基因在脑组织中高表达, 并且与其他组织比较具有显著性差异。性腺、肌肉和脾脏LpNPFF 表达略高于其他外周组织, 在胃、鳃、肠道中LpNPFF 的表达相对较少。

图1 LpNPFF 基因在小黄鱼不同组织中的相对表达水平Fig.1 Relative expression levels of the LpNPFF genes in different tissues of L. polyactis
2.2 LpNPFF在小黄鱼脑和卵巢中mRNA的定位分析
基于LpNPFF 基因mRNA 的相对表达, 我们选取小黄鱼脑 (端脑、中脑、小脑及延脑)和性腺进行原位杂交实验。实验结果表明, 在小黄鱼端脑(图2b, 2c,2d, 2e, 2f)、中脑(图3b, 3c, 3d), 小脑及延脑(图4b, 4c,4d)组织中能够清晰观察到LpNPFF 基因mRNA 的阳性杂交信号, 用正义探针进行对照实验杂交则不能观察到信号(端脑, 图 2a; 中脑, 图 3a; 小脑及延脑,图4a)。小黄鱼LpNPFF 的mRNA 主要分布于小黄鱼的中脑(视叶)以及延脑, 端脑和小脑部分的表达较少。在中脑的视顶盖(OTec)、圆环体(TL)、结节前核(NAT)、外侧结节核(NLT)、下丘脑弥散核(NDLI)以及延脑(MO)中检测到大量表达LpNPFF mRNA 的细胞,这可能暗指LpNPFF 调控着不同的生理学功能。并且在小黄鱼未成熟的性腺组织中也能观察到明显的阳性信号(图5b)。经小黄鱼性腺组织解剖学分析, 此时期性腺为卵巢, 以不规则多角形的稚龄时相的卵母细胞为主要组成部分, 它们之间彼此紧密相连, 核很大, 呈圆形, 核仁可见分布在核的周围。因此在细胞质与核仁部分能观察到明显的 LpNPFF 基因 mRNA的阳性杂交信号。
2.3 FaRPs 成熟肽在小黄鱼脑和卵巢中的定位分析
免疫组化实验结果表明, 小黄鱼脑组织中的FaRPs 的免疫活性的区域为棕色(图6b, 6c, 6d), 与不具 FaRPs 免疫活性的细胞核区域形成鲜明的对比(图6a), 我们在中脑的表层发现了明显密集的 FaRPs 免疫信号, 而在内部则相对较少。在小黄鱼性腺组织中,FaRPs 的免疫活性的区域为棕色(图7b, 7c, 7d), 与不具 FaRPs 免疫活性的细胞核区域形成鲜明的对比(图7a), 并且 RFamide 主要存在于细胞壁壁或结缔组织周围。我们预测 LpNPFF 肽作用于性腺壁表层细胞,可能参与调控性腺发育等。
3 讨论
小黄鱼是我国浙江舟山沿海地区的一种主要的经济性物种, 由于其肉质鲜美, 深受人们的喜爱。LpNPFF 是 RFamide 相关肽家族中的一员, 在许多生物学过程中具有重要的调节作用。实时荧光定量分析显示, 小黄鱼神经肽 FF mRNA 在所有被测组织中均广泛表达, 其中以脑、性腺、肾脏及周围组织肌肉中表达量最高。在花鲈(Lateolabrax maculatus)(Li et al,2019)和星点东方鲀(Takifugu niphobles)(Shahjahan et al, 2015)中, NPFF 在中枢神经系统及周围神经系统(PNS)和性腺中的表达量最高, 提示LpNPFF 可能在脑和性腺中发挥重要作用, 这与我们得到的结果一致。在大鼠(Mus musculus)中, NPFF mRNA 的最高水平出现在脊髓、垂体和下丘脑(Kivipelto et al, 1991; Majane et al, 1993); 而在人类中, NPFF mRNA 的最高水平出现在髓质和脊髓(Nystedt et al, 2002), 这有可能说明不同的表达模式表明不同物种大脑功能的差异性。
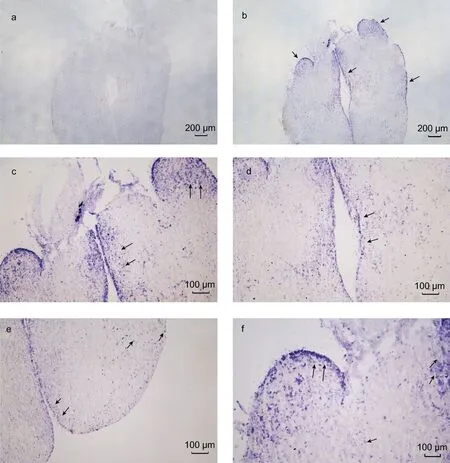
图2 LpNPFF 基因mRNA 端脑原位杂交图Fig.2 Localization of LpNPFF mRNA in telencephalon of L. polyactis
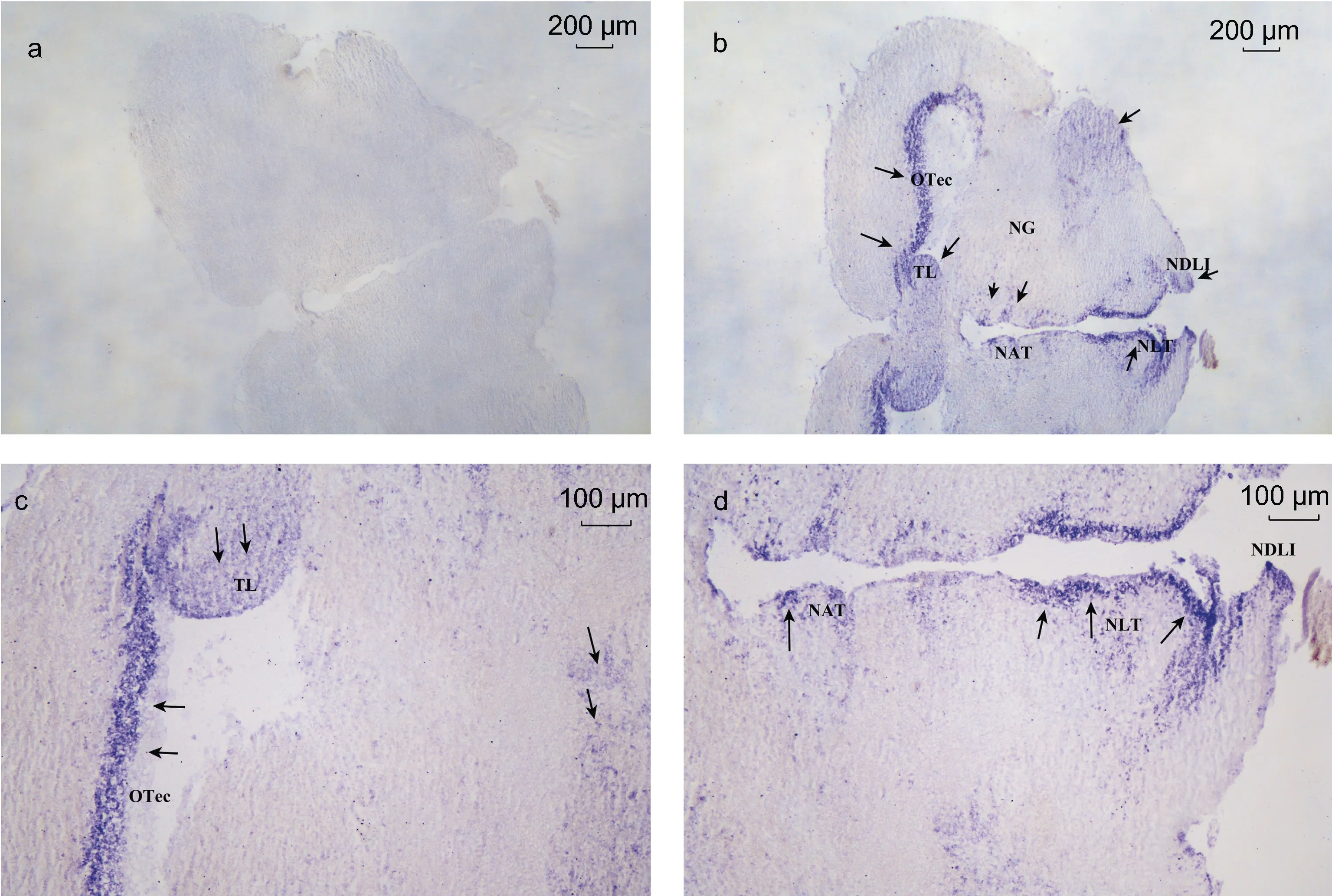
图3 LpNPFF 基因mRNA 中脑原位杂交图Fig.3 Localization of LpNPFF mRNA in midbrain of L. polyactis
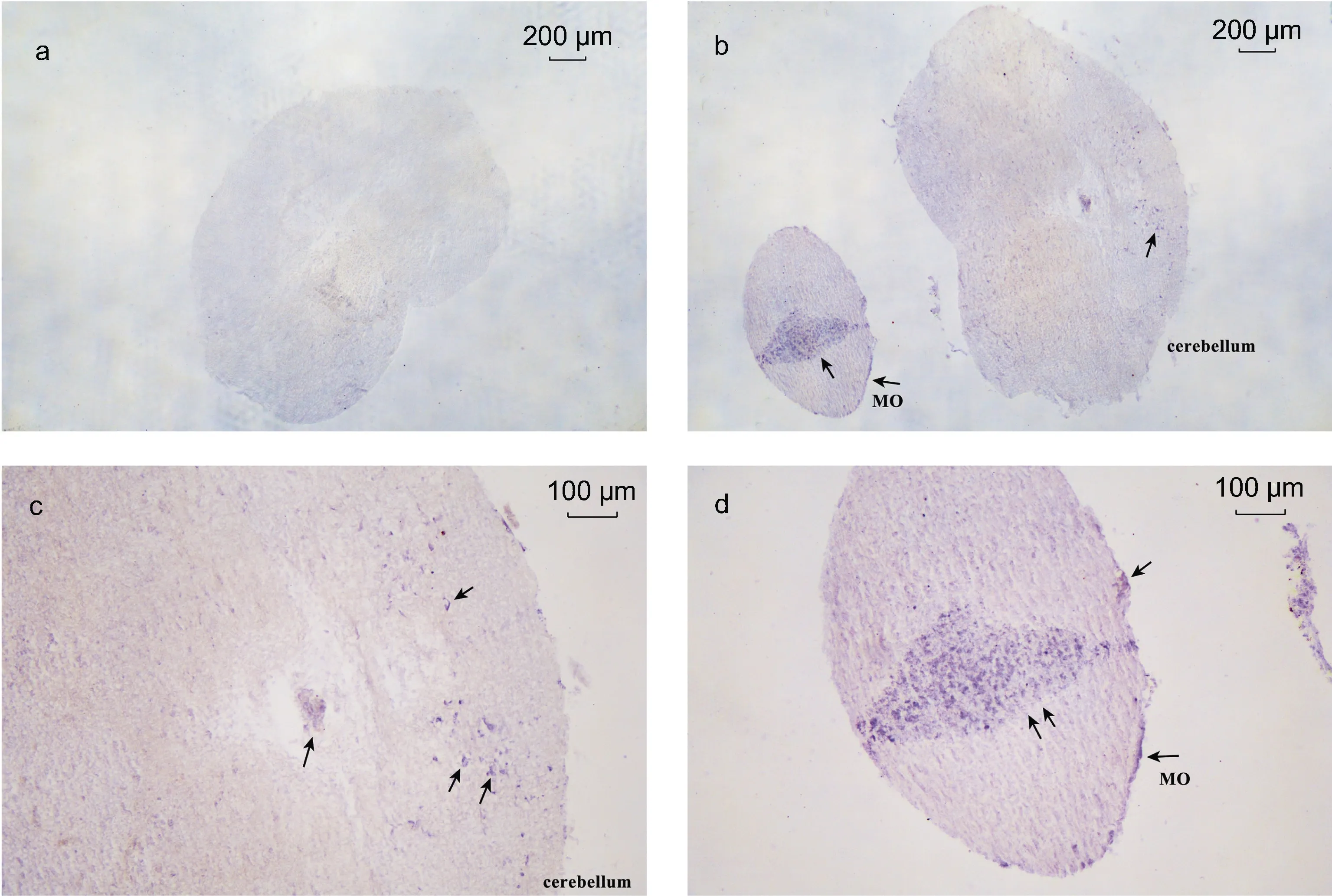
图4 LpNPFF 基因mRNA 小脑及延脑原位杂交图Fig.4 Localization of LpNPFF mRNA in cerebellum and medulla oblongata (MO) of L. polyactis
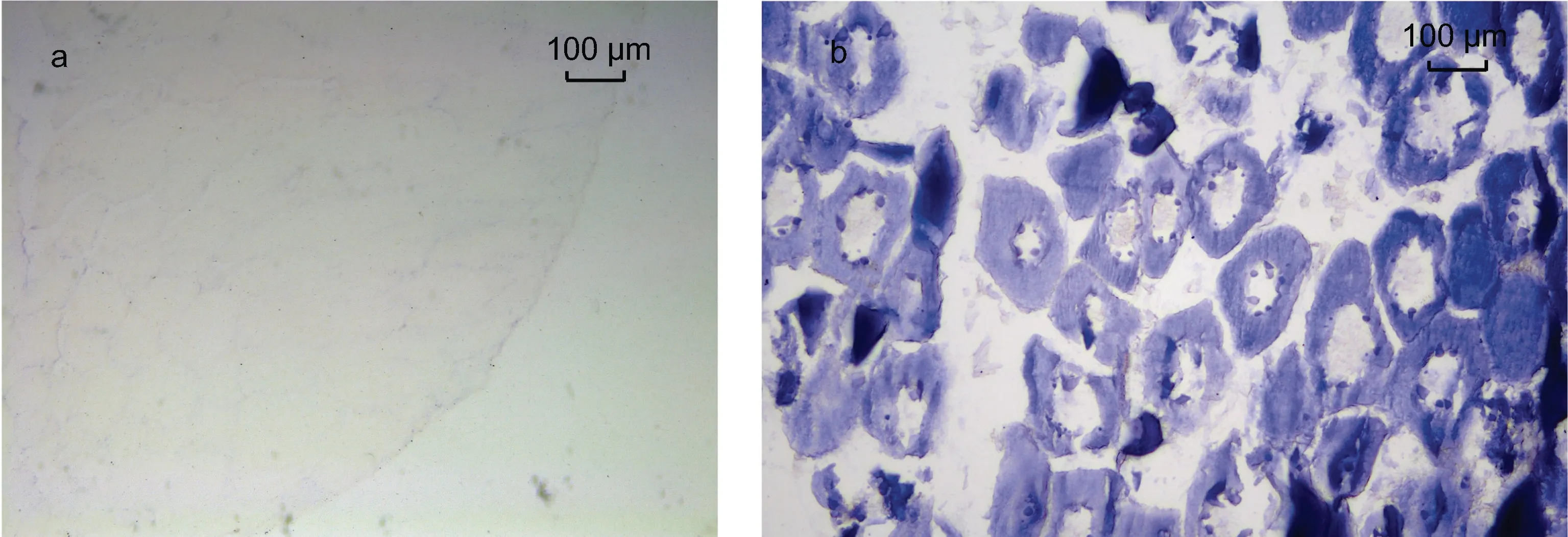
图5 LpNPFF 基因mRNA 性腺原位杂交图Fig.5 Localization of LpNPFF mRNA in gonad of L. polyactis
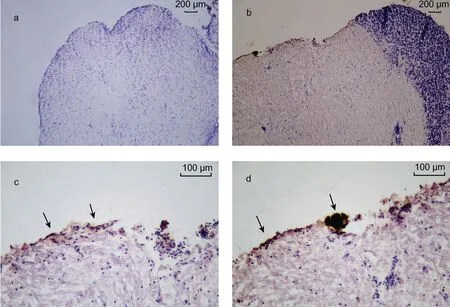
图6 小黄鱼脑组织中的FaRPs 分布图Fig.6 Distribution of FaRPs in brain tissue of L. polyactis

图7 小黄性腺组织中的FaRPs 分布图Fig.7 Distribution of FaRPs in the gonad tissue of L. polyactis
NPFF 在人(Homo sapiens)和大鼠的细胞定位在中枢神经系统的许多区域被检测到。人类NPFF 基因mRNA 定位于大脑和脊髓(Vilim et al, 1999)。在大鼠中 NPFF 基因 mRNA 高表达于下丘脑室旁核(PVN),这是一个对神经激素分泌和交感神经流出调节至关重要的自主核(Jhamandas et al, 2006)。与人类和大鼠不同, 在成熟斑马鱼(Danio rerio)和胚胎中确定了表达 NPFF 基因 mRNA 的细胞的定位。在端脑的嗅球和嗅视神经核中发现了ZfPQRF 神经元表达, 而在下丘脑、脑干和脊髓中则没有 ZfPQRF 神经元表达(Oehlmann et al, 2002)。这些基因在哺乳动物和硬骨鱼之间的差异定位显示了不同的基因功能。然而, 在我们的研究中, 小黄鱼NPFF 基因mRNA 在端脑及小脑部分表达量有限, 但在中脑部分区域和延脑(MO)区域有大量表达, 这可能表示LpNPFF 通过不同的途径向不同组织传递信号并且行使着不同的生理学功能, 其中包括与生殖相关的 NDLI(Kitahashi et al,2009), 与摄食调节相关的NAT、NLT (Cerdá-Reverter et al, 2000, 2003; Shiraishi et al, 2000)。LpNPFF 基因mRNA 在中脑的分布主要在组织的边缘, 并且较为集中且呈长条状分布, 如 OTec 和 NLT 等。NPFF 很可能作为传递信号的途径, 通过不同的途径向不同组织传递信号。根据最近的研究, 在花鲈中发现NPFF 及其受体均位于下丘脑, 说明 NPFF 对下丘脑神经元有直接的调节进食作用(Bechtold et al, 2007;Li et al, 2019)。小黄鱼神经肽FaRPs 的免疫阳性信号主要集中于脑部细胞表层和卵巢壁细胞表层, 这与原位杂交结果中 LpNPFF mRNA 的分布较为集中不同。鉴于原位杂交技术定位的是LpNPFF 的 mRNA,基本可以判定有信号区域是可能分泌 FaRPs 蛋白的细胞。在胚胎斑马鱼中(Pinelli et al, 2000)和鳟鱼(Salmo trutta fario)(Castro et al, 2001)的早期发育阶段也发现了FMRFamide 类免疫反应神经元。我们提出一个假设: 脑部组织是小黄鱼 RFamide 神经肽的来源, 由脑部组织细胞分泌的RFa 神经肽通过神经纤维向下游传递。我们的免疫组织化学实验证实, 小黄鱼脑部细胞分泌的 RFamide 可能通过内外细胞颗粒层和结缔组织向下游传递。这说明小黄鱼脑组织中的NPFF 是由特定的细胞进行转录翻译, 但在翻译成熟之后, NPFF 蛋白将转运至不同的区域发挥作用或进行免疫调节反应。而在小黄鱼卵巢中, 我们发现 FaRPs蛋白的分布较为紧密, 与脑组织中的弥散分布有一定的差异。同时卵巢组织中FaRPs 蛋白主要存在于结缔组织中, 这说明LpNPFF 可能将信号传递给性腺组织,但 LpNPFF 蛋白并没有进入到细胞里面, 仅仅是充当一种信号传递的中间媒介。因此, 这些神经元群可能表达其他的 RFamide, 与已知的 FMRF 抗体的广泛反应性一致(Pinelli et al, 2000)。不同组织中NPFF 的不同分布情况预示着该蛋白具有不同的生物学功能,NPFF 除生殖调控之外, 可能作为一个神经调质调解小黄鱼的更高级的生理活动, 例如摄食、免疫等。
4 结论
组织特异性分析结果显示小黄鱼神经肽FF 基因在脑和性腺中表达含量较高, 肌肉和脾脏次之。原位杂交实验结果显示, LpNPFF mRNA 主要分布于小黄鱼的中脑(视叶)以及延脑, 端脑和小脑部分的表达较少。在中脑的视顶盖(OTec)、圆环体(TL)、结节前核(NAT)、外侧结节核(NLT)、下丘脑弥散核(NDLI)以及延脑(MO)中检测到大量表达LpNPFF mRNA 的细胞,这可能与LpNPFF 调控着不同的生理学功能有关。并且在第Ⅱ期的卵巢细胞中也能观察到明显的阳性信号。免疫组织化学结果显示, 小黄鱼神经肽FaRPs 的免疫阳性信号主要集中于脑部细胞表层和卵巢壁细胞表层, 这与原位杂交的结果中LpNPFF 基因mRNA的分布形成呼应。