基于MRA的个体化腹主动脉瘤计算机仿真
2021-02-01杨冯棱郭立王依影林奕诚
杨冯棱 郭立 王依影 林奕诚
0 引言
随着人口老龄化的加剧及检查方法的进步,腹主动脉瘤(abdominal aortic aneurysm,AAA)的发病率/发现率逐年升高。AAA发生破裂出血时,致死率极高,及时发现AAA和评估其破裂的风险具有重要的意义。多数学者认为该病的发生一方面与主动脉的炎症、平滑肌细胞的凋亡、细胞外基质的降解、氧化应激和感染性病变等病理改变有关,另一方面还与血流动力学的改变相关[1]。多项研究证实了血流动力学在AAA的发生、发展、破裂方面扮演着极其重要的角色[2-4]。计算流体力学的发展拓宽了学者研究AAA的途径,它可以获得基础和动物实验难以获得或难以显示的血流动力学参数,并有望为AAA的诊治提供更多可靠的信息[2]。人们开始从一种生物力学的角度来看观察AAA的破裂:当病变血管壁所承受的应力超过其所能承受的应力极限时,动脉瘤便会破裂、出血[5-6]。
以往国内个体化的AAA计算机仿真模型均是建立在CT血管造影(computed tomography angiography, CTA)图像的基础上。但是,CT扫描对人体存在辐射伤害,并且部分受检者会对CTA所用的碘对比剂发生过敏反应,这些都在一定程度上限制着该技术的应用。磁共振血管造影(magnetic resonance angiography, MRA)与CTA同为AAA的主要影像检查手段,其具有与CTA相当的诊断效能[7]。经查阅文献,国内尚未见基于MRA行AAA数值模拟的报道。本研究通过MRA图像建立个体化的AAA计算机仿真模型,并在此基础上进行AAA的数值模拟,获取并显示与该患者密切相关的血流动力学信息,从而为个体化治疗方案的制定提供帮助。
1 研究方法
1.1 临床资料
在取得知情同意后,采集1名在昆明医科大学第二附属医院住院的52岁AAA患者的MRA资料。
1.2 三维几何模型构建
1.2.1 磁共振检查方法
采用Siemens Sonata 1.5T MR超导磁共振仪对患者行常规平扫及磁共振增强血管造影检查,获取1~4组MRA图像(以AAA瘤完全显影为准)。
1.2.2 几何模型构建
将MRA原始数据(DICOM格式)导入Mimics中[图1(a)],使用阈值分割、区域增长、手动编辑等算法计算出AAA的掩膜[图1(b)]。在3-matic Research中对其进行后处理,获得较为光滑的AAA 3D模型,裁剪掉中心线的两端以建立垂直于中心线的入口及出口平面[图1(c)]。

图1 AAA的三维几何模型
1.3 有限元模型
1.3.1 网格划分
使用3-matic Research优化面网格,在ICEM CFD中设定边界层网格,生成体网格(图2)及边界层网格(图3)。本例AAA模型共生成26 361个网格和10 346个节点。

图2 体网格

图3 边界层网格
1.3.2 材料属性及边界条件
假设血液为绝热、均匀、各项同性的不可压缩牛顿流体,其流动方式为脉动层流[8],设定血液的密度为1 050 kg/m3,运动黏性系数为0.003 5 Pa·s。
设定模型为瞬态流。入口处边界条件引用文献[9]中一个心动周期的速度曲线(图4),出口处采用自由出流边界条件,工作压力设为动脉内平均压力13 332.24 Pa(100 mmHg),不考虑重力的影响。血管壁设定为无滑移的刚性管壁。
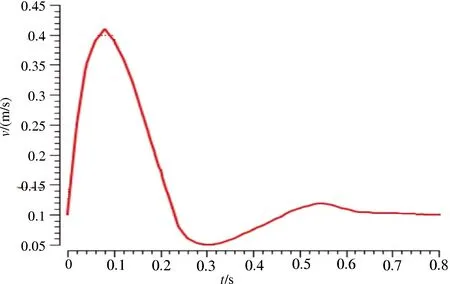
图4 入口速度曲线
使用Fluent软件采用有限体积法求解流体流动、控制血流流动的质量守恒(连续性方程)及动力守恒(Navier-Stokes)偏微分方程为:
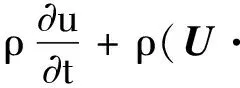
式中:t为时间;U为流体的速度矢量;P为流场压力;ρ为血流密度;μ为运动黏性系数。
1.3.3 求解设置
使用3D耦合式求解器,压力-速度耦合求解方式选用PISO算法,梯度、压力和动量分别选用基于最小二乘单元、标准和二阶迎风的空间离散格式,并且将残差设置为10-5。设定心动周期为0.8 s,计算时间步长为0.005 s,每个时间步长内最大迭代次数为200。
计算结果收敛后,提取最后一个周期的运算结果,在CFD-Post软件进行后处理,输出心动周期内不同时刻的血流流线、血流速度、壁面切应力及壁面压力分布云图。
2 结果
2.1 血流流线分布
图5为心动周期不同时刻的流线分布图。从流线的空间分布来看,血流在流经近端瘤颈时各血流流线相对平直,排列整齐。当血流进入明显扩张的瘤腔内时,流速随即明显降低,流线也变得不规则:入口血流的直接延续区域仍以层流方式为主,随后血流撞击瘤体右前下壁面,并经远端瘤颈流出;而在入口血流的非直接延续区域(特别是瘤体膨大较为明显的部位)则出现不同程度的涡流、湍流。当血流进入远端瘤颈时,上述流线又从混乱逐渐变得规则(本例以左手螺旋状为主),随后转变为层流。

t=0.04 s为加速射血期,t=0.08 s为射血峰值,t=0.14 s、t=0.20 s和t=0.25 s分别为减速射血的早、中、晚期,t=0.30 s为加速充盈期,t=0.58 s和t=0.80 s为减速充盈期
从流线的时间分布来看,当血流处于加速射血期至减速射血前期这一时间段时,血流速度较快,同一截面上瘤腔内的流线数目较少,流速较快且无明显的涡流。但进入减速射血中后期后,瘤体后缘膨大处开始出现少量涡流和湍流,并且涡流的范围随着时间的推移而逐渐增大,涡流的核心区域也逐渐向瘤体膨大的前缘区域移动,此时的流线变得更加混杂。
2.2 速度的大小和分布
图6为心动周期内不同时刻AAA矢状切面的速度分布云图,图7为心动周期内不同时刻的AAA最大横截面速度分布云图。从空间分布上来看,瘤颈处的血流速度明显大于瘤腔内的血流速度,瘤腔内入口血流的直接延续区域的血流速度较其周围区域(对应着血管膨大区域)快。从时间分布来看,射血期瘤体内的血流速度明显快于充盈期,并且快速射血期瘤腔内的血流速度快于减速射血期;而减速充盈期瘤体内的血流速度略慢于加速充盈期。在整个心动周期内,最大的峰值流速出现在t=0.08 s(射血峰值)时,其位置在近端和远端瘤颈处。

t=0.04 s为加速射血期,t=0.08 s为射血峰值,t=0.18 s为减速射血期,t=0.30 s及t=0.55 s为加速充盈期,t=0.80 s为减速充盈期

t=0.04 s为加速射血,t=0.08 s为射血峰值,t=0.20 s为减速射血期,t=0.30 s为快速充盈期,t=0.58 s及t=0.78 s为减速充盈期
从最大横截面上来观测流速的时间和空间分布,在加速射血期内,瘤体内高速的血流主要集中AAA入口血流的直接延续区域,其高速血流的分布范围随着时间的推移而逐步扩大,并于t=0.08 s(射血峰值)时达到最大;随后,随着减速射血期的到来,其范围又开始逐渐减小。AAA入口血流的非直接延续区域(即血管膨大区域)在整个心动周期内都处于较低的流速水平。
2.3 壁面压力的大小和分布
图8为心动周期内不同时刻的AAA壁面压力云图。在加速射血前期,整个AAA的壁面压力分布呈由近至远阶梯式逐渐降低的趋势,此时的最大壁面压力位于近端瘤颈处。从加速射血中后期开始,最大壁面压力开始出现在瘤体的右前上壁,其范围及数值随着时间的推移而逐步扩大,至t=0.08 s(射血峰值)时达到最大。随后,最大壁面压力的位置逐渐向瘤体远心端移动,数值也逐渐减小。至减速射血后期,整个AAA的最大壁面压力位于远端瘤颈处,压力的分布呈由近至远逐渐升高的趋势。

t=0.02 s为加速射血期,t=0.08 s为射血峰值时,t=0.15 s及t=0.24 s为减速射血期,t=0.42 s为加速充盈期,t=0.62 s为减速充盈期
在加速充盈期,整个AAA的壁面压力呈由近至远逐渐降低的分布。从减速充盈期开始,瘤体右前下壁面始终为最大壁面压力出现的位置,只是其范围及量值会随时间的推移而发生轻微的变化。
2.4 壁面切应力的大小和分布
图9为心动周期内不同时刻的AAA壁面切应力分布云图。从空间分布上来看,作用于AAA近、远端瘤颈的壁面切应力较作用于瘤体处的大,最大切应力出现的区域在近、远端瘤颈处。就瘤体而言,其壁面一直都处于较低的切应力水平,并且作用于近心端壁面的切应力要小于作用于远心端壁面的切应力。
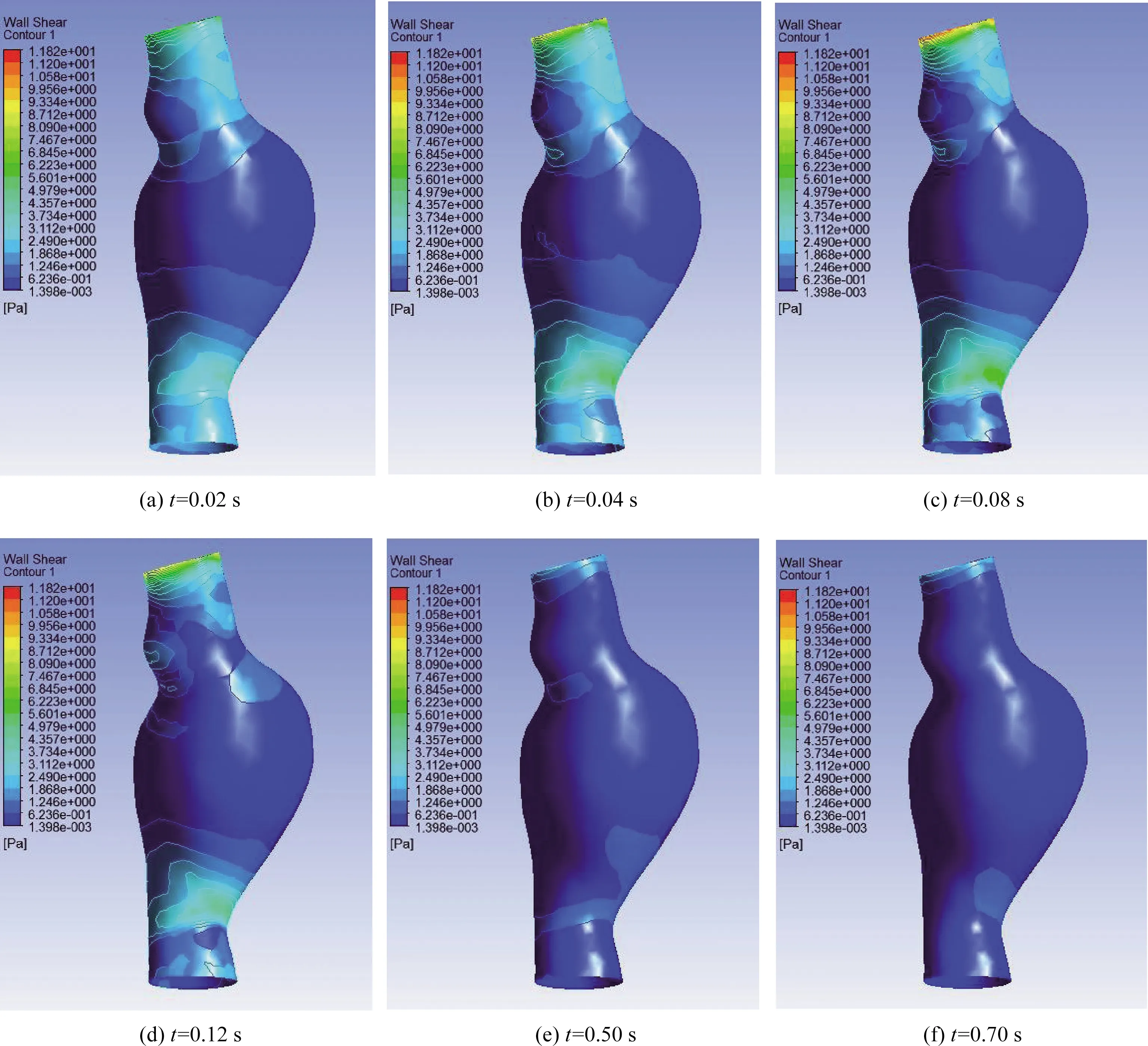
t=0.02 s及t=0.04 s为加速射血期,t=0.08 s为射血峰值,t=0.12 s为减速射血期,t=0.50 s为快速充盈期,t=0.70 s为减速充盈期;图中颜色越接近红色表示切应力值越高,越接近蓝色则代表切应力值越低
从时间分布来看,射血期作用于AAA壁面上的切应力的量值及其变化范围均明显大于充盈期。在加速射血期,壁面切应力会随着时间的推移而逐渐增高,至t=0.08 s(射血峰值)时达到最大值。从减速射血期开始,作用于AAA壁面上的切应力则会随着时间的推移而逐渐降低。到充盈期时,作用于AAA壁面上的切应力则处于相对较低的水平,且变化不明显。
3 讨论
3.1 基于MRA建立AAA仿真模型的可行性及优势
AAA发病率逐年升高,一旦发生破裂,致死率可高达80%~90%[3,10-11]。约75%的AAA可伴有腔内血栓,而腔内血栓的脱落可能会造成远端动脉血管栓塞,进而增加相应组织、脏器发生功能障碍的风险[12]。因此,及时发现和评估AAA破裂的风险具有重要的意义。以往的AAA计算机仿真均基于CTA,MRA与CTA同为AAA的主要影像检查方法,具有与CTA相当的诊断效能[7]。相较于CTA,MRA不仅无辐射危害,有利于进行反复多次扫描,而且其使用造影剂的剂量少而毒性低,不良反应发生率也更低[13]。此外,MRA可多角度、多参数成像,能更直观地显示瘤体形态、动脉瘤内的血栓及动脉粥样斑块,有利于对AAA进行更全面评估[13-14]。本研究基于高分辨率MRA建立个体化的AAA计算机仿真模型,通过模型上的流线、流速、压力、切应力等血流参数来协助该例患者的诊治。
3.2 速度分布
在整个心动周期内,AAA内始终存在着血液流动,并且在心动周期内血流速度的变化趋势与上游血管(入口处)流速-时间的波形图相对应,即血流速度在加速射血期持续增加,到0.08 s时达速度峰值,随后流速下降;在加速充盈期,血流又经历了一个小的加速过程。这说明AAA内的血流模式仍然受到心脏泵血以及主动脉弹性贮器作用的影响。不过,因受AAA扩大的瘤腔影响,瘤体内血流速度随时间变化的趋势不如瘤颈处明显。血流相对停滞可能会造成局部内膜细胞营养不足和代谢紊乱,并引发一系列生物学变化,加剧血管壁弹性纤维的破坏,进而打破血液压力与血管壁弹力的平衡,增加瘤体破裂风险。
从临床角度来看,较低的血流速度一方面会导致血液中的红细胞长时间在对应区域滞留、聚集,致使局部血栓形成。这也解释了为何AAA瘤腔内易有血栓存在;另一方面则会使血液中的脂质在局部停留时间增加,使其更容易附着于血管壁上,进而引起动脉粥样斑块的发生、发展,增快AAA发展的进程。本研究显示AAA瘤体膨大处的血流速度较低,因此该处可能是血栓及动脉粥样斑块好发的部位,这与临床上AAA的实际情况不谋而合。血栓及动脉粥样斑块可能导致AAA的瘤壁发生退变,进而降低瘤壁的强度。因此,AAA患者一旦发现瘤腔血栓及动脉粥样斑块形成,应尽早进行医疗干预,预防其进一步发展。
3.3 血流流线
有研究证实当血管内径大于3.0 cm时,其内血液的流动将变得复杂,会出现异常流动[15]。瘤腔内异常的流动会引起瘤壁的颤动,导致瘤壁受力不均匀,瘤壁被拉伸,瘤腔进一步增大,进而增加其破裂的风险[15-16]。本研究发现血流在近、远端瘤颈以层流方式流动,但在形态不规则的瘤腔内血流形式较为复杂,出现了涡流,甚至湍流,且主要分布在瘤腔的膨大处。此区域涡流、湍流的形成可能与瘤腔的扩大及形态不规则有关,因为血流在扩大的、不规则的瘤腔内流动时更易发生血流方向的突然改变和相互碰撞。因此异常流动集中区域可能是瘤体生长、破裂的高风险区域。此外,层流是正常主动脉和较小动脉瘤内血流的主要流动方式。相较于涡流,层流能有效减少流动过程中的能量损失,降低心脏做功。因此及时采取手术(如人造血管植入术)或介入方式(如腹主动脉覆膜支架放置术)纠正腹主动脉内异常流动的血液将有助于减少心脏的负荷。
3.4 血管壁面压力
本例AAA数值模拟的结果显示壁面压力与其内的血流速度一样,会随心动周期变化而改变。总体而言,射血期作用于AAA瘤壁上压力的大小及其变化范围都明显大于充盈期,并且于射血峰值时(t=0.08 s)达到最大值,这提示射血峰值时是AAA破裂的高危时刻。从射血期AAA各部位压力的分布来看,虽然壁面压力存在由动脉瘤近端至远端逐渐降低的规律,但可以看出沿动脉瘤长轴的各垂直截面上,作用于瘤壁各个点上的大小仍存在不同。根据病变血管壁上的应力超过其能承受的应力极限时动脉瘤便会破裂这一理论,通过AAA仿真模型将有助于对AAA破裂位置进行预测。但本研究并未将瘤壁本身的厚度、形态、组织特性及病理改变等会对瘤壁强度产生影响的因素考虑在内,故无法对AAA的破裂进行预测,这有待于进一步的研究加以完善。
3.5 血管壁面切应力
血管壁面切应力是腔内流动的黏性血流对其流经的血管壁表面产生的摩擦力。从模拟结果可以看出切应力的大小会随着血流速度及血管内径的改变而发生相应的变化,大体而言其与流速呈正比,与内径呈反比。
壁面切应力可能与AAA的发生、发展及破裂密切相关[3]。从AAA发生的角度来看,腹主动脉的内膜由血管内皮细胞构成。血管内皮细胞具有内分泌功能,可分泌血管收缩因子和舒张因子。血流能够通过影响血管内皮细胞的结构和功能,来改变血管的舒缩状态。而在血管内皮细胞承受的三种机械作用力(切应力、静水压和环形张力)中,切应力对其结构和功能的影响最大[4]。高切应力会损伤腹主动脉血管上的内膜,进而刺激血管内皮细胞分泌一氧化氮,并抑制血管收缩因子的释放,从而扩张血管、引起血管形态的重塑,导致局部动脉呈瘤样扩张,最终形成动脉瘤[3]。在AAA的发展及破裂过程中,低的切应力又发挥着重要的作用:由于动脉瘤瘤腔的扩大,其内出现涡流和湍流,致使对应区域的血流流速减低,切应力也随之下降。这样会引起血管内皮细胞释放的内皮素增加,诱导血管平滑肌细胞增殖,促使血管平滑肌细胞的表型发生改变。此外,还促使炎症细胞因子和氧化因子的表达,进而加重动脉内膜的损伤,促进血栓及动脉粥样硬化斑块的形成[17]。由于腹主动脉管壁的血供主要来自腹主动脉内的血液,形成的粥样硬化斑块会引起内膜增厚而阻碍血管内皮细胞的营养获取,进而促使瘤壁退行性变的发生和动脉壁结构蛋白破坏的加重,从而降低瘤壁组织的强度,增加瘤体破裂的风险[18]。由此可见,切应力在AAA的发生、发展及破裂过程中发挥着重要的作用。
本研究结果显示在心动周期内的,瘤颈附近始终是壁面切应力较高的区域。根据上述的理论,对应部位的血管壁长期处于较高的切应力水平,这会引起该处血管内膜的受损,管腔扩张,久而久之便演变为上述动脉瘤的一部分,这可能是动脉瘤长径增长的一个重要原因,这与Berge等的观点相一致[19]。本例AAA瘤体部分的壁面切应力在整个心动周期内都处于较低的水平,且波动范围小,该区域可能是动脉瘤增长及破裂的高风险区域,临床应对此区域特别关注。
4 结论
本研究基于MRA图像成功建立了AAA形态模型,并在此基础上建立了个体化的AAA计算机仿真模型,得出了模型上的流线、流速、压力、切应力等血流参数及其分布规律,分析了血流动力学因素在AAA发生、发展及破裂过程中所起到的作用。研究结果为AAA的治疗提供了血流动力学理论支持,有助于临床对该疾病进行个体化干预及术后监测。
本研究将血管壁视为刚性管壁,忽略了血液与弹性血管壁之间存在的双向流固耦合作用,并将血液假设为牛顿流体,也未设定个体化的出入口边界条件,事实上不同个体的血液流速、压力均存在差异。但以上假设均得到业界认可,在今后的研究中将逐步完善模型设定,如建立流固耦合模型,设定个体化出入口边界条件(磁共振相位对比法可准确地测量主动脉的血流[20],将其测得的血流信息作为边界条件引入模型中,会令仿真结果更接近实际情况)等。
