水稻白化转绿和穗顶端退化突变体vpa1的遗传分析和基因定位
2021-01-22王中豪贺彦张晓波徐霞吴建利施勇烽
王中豪 贺彦 张晓波 徐霞 吴建利 施勇烽
(中国水稻研究所 国家水稻改良中心/水稻生物学国家重点实验室, 杭州 310006; *通信联系人, E-mail: shiyongfeng@caas.cn)
叶色变异是一类类型丰富、表型明显的突变性状。Kurata等[1]将水稻叶色突变体分成白化、黄化、条纹、转绿、黄绿和斑马叶等几类。转绿突变体是在阶段性失绿后能恢复到正常叶色形态的一类叶色突变体,不同转绿突变体的失绿表型存在差异,可分为白化转绿、条纹转绿和黄化转绿等类型[2-4]。白化转绿在转绿材料中比较常见,至今大约已鉴定了 40多个白化转绿的突变体,绝大部分白化转绿性状受隐性核基因控制,但也有受显性基因控制的报道。房贤涛等[5]对两系不育系SE21S辐照处理后得到的6份白转绿突变体的研究表明,白化转黄绿突变体21W1系的叶色表型受显性基因控制。这些白化转绿突变体为揭示叶绿体分化与发育的分子机制提供了丰富的试验材料,利用这些突变体已将gra3[6]、wgl[7]、gra75[8]、osv15[9]等突变基因定位到基因组特定的区间内,也克隆了一些白化转绿基因,如V1[10]、V2[11]、V3[12]、YSA[13]等。
穗顶端退化在水稻育种和生产中经常发生,往往造成每穗粒数显著减少,严重影响水稻单产。已报道水稻顶端退化现象主要受遗传控制,一部分属于数量性状遗传,相关 QTL位点分布广泛。如越光与桂朝2号的重组自交系群体在不同环境下种植共检测到位于第1、2、3、5、6和7染色体上的6个控制穗顶端退化的 QTL[14]。Cheng等[15]在 PAA品种L-05261和正常穗品种IRAT129的F2鉴定到7个穗退化 QTL,其中主效基因qPAA8精细定位在RM22475与8-In112之间的37.6 kb区间内。顶端颖花退化突变体的研究表明顶端颖花退化性状主要受单隐性基因控制,如paa-hwa的穗退化由第4染色体上的一个隐性基因控制,候选基因LOC_Os04g56160存在一个单碱基突变[16]。目前利用突变体已克隆了DPS1[17]、OsALMT7[18]、TUTOU1[19]等穗顶端退化基因,这些基因编码不同类型的蛋白功能,这些蛋白参与细胞凋亡、过氧化氢清除、离子转运等生理过程,表明穗顶端颖花正常发育可能受多个代谢途径的影响。
本实验室从EMS诱变籼稻IR64的突变体库中发现的一份能稳定遗传的突变体vpa1,其苗期叶片出现明显的白化现象,并逐渐转绿恢复至正常叶色,抽穗期能观查到明显的穗顶端退化现象。遗传分析表明vpa1的叶色白化转绿和穗顶端退化性状受独立的两个隐性基因控制。通过基因定位将控制vpa1的叶色白化转绿性状基因Osv16定位于第3染色体RM3441和RM3029之间,将控制穗顶端退化基因Ospaa10定位于第1染色体RM11157和RM5972之间,这些结果为进一步的基因克隆和基因功能研究打下了基础。
1 材料与方法
1.1 供试材料
本研究采用的突变体vpa1是籼稻品种IR64经过EMS诱变获得的。经过连续多代自交,vpa1的叶色白化转绿和穗顶端退化性状在浙江和海南都能稳定遗传。常规品种IR64和Moroberekan作为杂交亲本构建遗传分析和定位的群体。
1.2 农艺性状考查
突变体vpa1和野生型IR64于2017年5月种植在中国水稻研究所富阳实验基地,正常田间管理。成熟期随机选取野生型IR64和突变体各3株考查株高、穗长、有效穗数、结实率和千粒重等农艺性状,取平均值进行分析。
1.3 群体构建及遗传分析
以突变体vpa1为母本,分别与 IR64和Moroberekan配制杂交组合,观查F1的表型并收获F1单株种子。在苗期统计vpa1/IR64、vpa1/Moroberekan的F2群体中正常叶色和白化转绿叶水稻株数,vpa1/Moroberekan F2群体中白化转绿表型单株用于DNA提取和基因定位。在成熟期统计vpa1/IR64、vpa1/Moroberekan F2群体中正常穗型和顶端退化穗型的水稻株数,vpa1/ Moroberekan F2群体中穗顶端退化单株用于DNA提取和基因定位。进一步观查并统计vpa1/IR64 F2群体中100个单株的白化转绿和穗顶端退化表型,分析两个性状是否独立遗传。
1.4 光合色素含量测定
分别在播种后第2周、第8周和第14周分别称取野生型和突变体vpa1新生全展叶15 mg,剪成0.3~0.5 cm片段,每个时期野生型和突变体各取3株作为生物学重复,参照贺彦等[20]的方法提取叶绿素和类胡萝卜素。用酶标仪(SpectraMax i3x)测定470、649和665 nm三个波长处的光吸收值,参照Arnon和Wellburn等[21,22]的方法计算叶绿素和类胡萝卜素含量。
1.5 基因定位
采用简易法提取亲本和突变单株DNA,苗期分别取vpa1/Moroberekan F2群体中正常表型单株与白化转绿表型单株各 10株,抽穗期分别取vpa1/Moroberekan F2群体中正常穗型单株与顶端退化单株各10株,以等量叶片构建野生型DNA池和突变体DNA池。利用水稻12条染色体上638对SSR标记,对亲本vpa1和Moroberekan进行多态性标记筛选,筛选到的多态性标记用于野生池与突变池间多态性分析,找到两个池间有多态的标记,用于F2群体中突变单株的基因型分析,初步确定突变基因的位置。在目标区间进行SSR标记加密,进一步缩小区间范围。所用 SSR标记序列下载至Gramene数据库(http://www.gramene.org),由铂尚生物技术有限公司合成。参照Shi等[23]的方法进行PCR和产物检测。
2 结果与分析
2.1 vpa1的表型及主要农艺性状
自然生长条件下,与与野生型相比,突变体vpa1在苗期就出现明显的白化表型(图1-A),后逐渐转绿成白条纹叶,在分蘖期 vpa1的新生叶片仍有明显的白条纹。突变体的生育期较野生型没有明显变化,但株高下降明显(图 1-B)。突变体vpa1的剑叶较野生型明显变短且窄(图1-C)。vpa1穗呈明显的白色,穗长变短且顶端颖花退化(图 1-B、DD)。农艺性状考查发现,突变体 vpa1的的株高、穗长、每穗粒数和和千粒重均较较野生型显著下下降,而结实率却没有明显变化(表1)。vpa1株高较较野生型下降约9.0%,穗长减减少约27.6%,每穗粒数减少约31.4%,千粒重较野生型下降约20.5%。
2.2 vpa1的色素含量
在播种种后第2周、第8周和第14周分别测测定突变体与野生型叶绿素和类胡萝卜素含量。第22周和第 8周时突变体的叶叶绿素 a、叶绿素 b、类胡胡萝卜素和总叶绿素含量均较野生型显著下降,其中中,第2周时分别下降83.1%、82.5%、78.5%和83.1%,而第 8周时则分别下降了 22.9%、25%、12.5%和23.7%(图2-A~B)。在第14周时vpa1的叶绿素素b和类胡萝卜素含量较野生型无明显差别,而叶绿绿素a和总叶绿素含量仍较野生型分别下降 7.6%和5.7%(图2C)。显然,随着生育期的推移突变体vpa1光合色素含量呈逐渐升高趋势,与叶片白化转绿表型变化一致。

图1 突变体vpaa1及其野生型在苗期和抽穗期的表型Figg. 1. Performance of vpa1 annd wild type aat the seedling and heading stages.

表1 突变体vpa1和野生型型IR64的主要农艺性状Table 1. Commparison of agrronomic traits between vpa1and the wild-ttype.
2.3 vpa1白化转绿和穗顶端退化性状的遗传分析
以vpaa1为母本,IIR64和Morooberekan为父本构建了vpa1/IR64和vppa1/Moroberekan群体。考查F1植株叶色和穗部性状发现 F1的叶色和穗部表型与IR64一致,均表现为正常叶色和正常穗表型,表明叶片白化转绿和穗穗顶端退化性状受隐性基因控制。在苗期对一个vpa1/IIR64 F2群体共980株进进行调查,发现正常叶色有7226株,白化转绿叶有254株,正常叶色与白化转绿叶个体的分离比符合3∶1(χ2=0.44<χ20.05=3.84)(表 2)。vpa1/Moroberekan F2群体的正常叶色与白化转绿叶个体的分离比也符合3∶1,表明vpa1的白化转绿叶性状受单隐性核基因控制。在成熟期对vpa1/IR64的F2群体共720株进行穗顶端退化性状调查,发现正常穗型有 565株,顶端退化穗型有155株,正常穗型与穗顶端退化个体的分离符合 3∶1(χ2=3.58<χ20.05=3.84)(表2),表明vpa1的穗顶端退化性状受单隐性核基因控制。但是vpa1/Moroberekan的F2群体共1435株,其中1181株表现为正常穗型,254株表现为顶端退化表型,顶端退化个体数少于理论数(表3)。

图2 不同时期vpa1和野生型IR64叶片光合色素含量的比较Fig. 2. Comparison of pigment contents between vpa1 and WT at different growth stages.

表2 vpa1中转绿叶性状的遗传分析Table 2. Genetic analysis of the virescent leaf in vpa1.

表3 vpa1中穗顶端退化性状的遗传分析Table 3. Genetic analysis of the paa trait in vpa1.
为了进一步鉴定vpa1的这两个性状是否受同一个基因控制,随机考查 100个来源于vpa1/IR64组合的F2单株表型。其中54株表现正常叶色和正常穗型,22株仅出现白化转绿叶,19株仅出现穗顶端退化表型,有5株同时出现白化转绿叶和穗顶端退化表型,100个单株的分离情况符合独立分配定律,进一步证明vpa1的白化转绿和穗顶端退化性状受两个独立的隐性基因控制。
2.4 白化转绿基因Osv16定位
采用分池法构建白化转绿和正常叶色DNA池各一个,用基因组中均匀分布的638对SSR标记进行vpa1和Moroberekan的多态性筛选,共189对在亲本间存在多态。其中,第3染色体短臂上的4个标记RM14523、RM3545、RM218和RM232在两个DNA池中具有多态。进一步用这4个标记分析F2群体的27株白化转绿单株,分别检测到4株、1株、1株和 4株重组个体(图 3-A),初步将vpa1的白化转绿基因定位于RM14523和RM3545之间,并命名为Osv16。随后在区间内筛选到4个在亲本间有多态的标记(RM5755、RM7576、RM3441和RM5925),进一步分析F2群体的128株白化转绿单株,将Osv16定位于RM3441和RM5925之间(图3-B)。为了精细定位Osv16,筛选到亲本间多态引物RM3029、RM14626、RM14627,并与两侧引物RM3441和RM5925分析1372个F2突变型的单株,根据标记的物理位置和交换情况,最终将Osv16定位至RM3441和RM3029之间,物理距离约为125 kb的区间内(图3-C)。
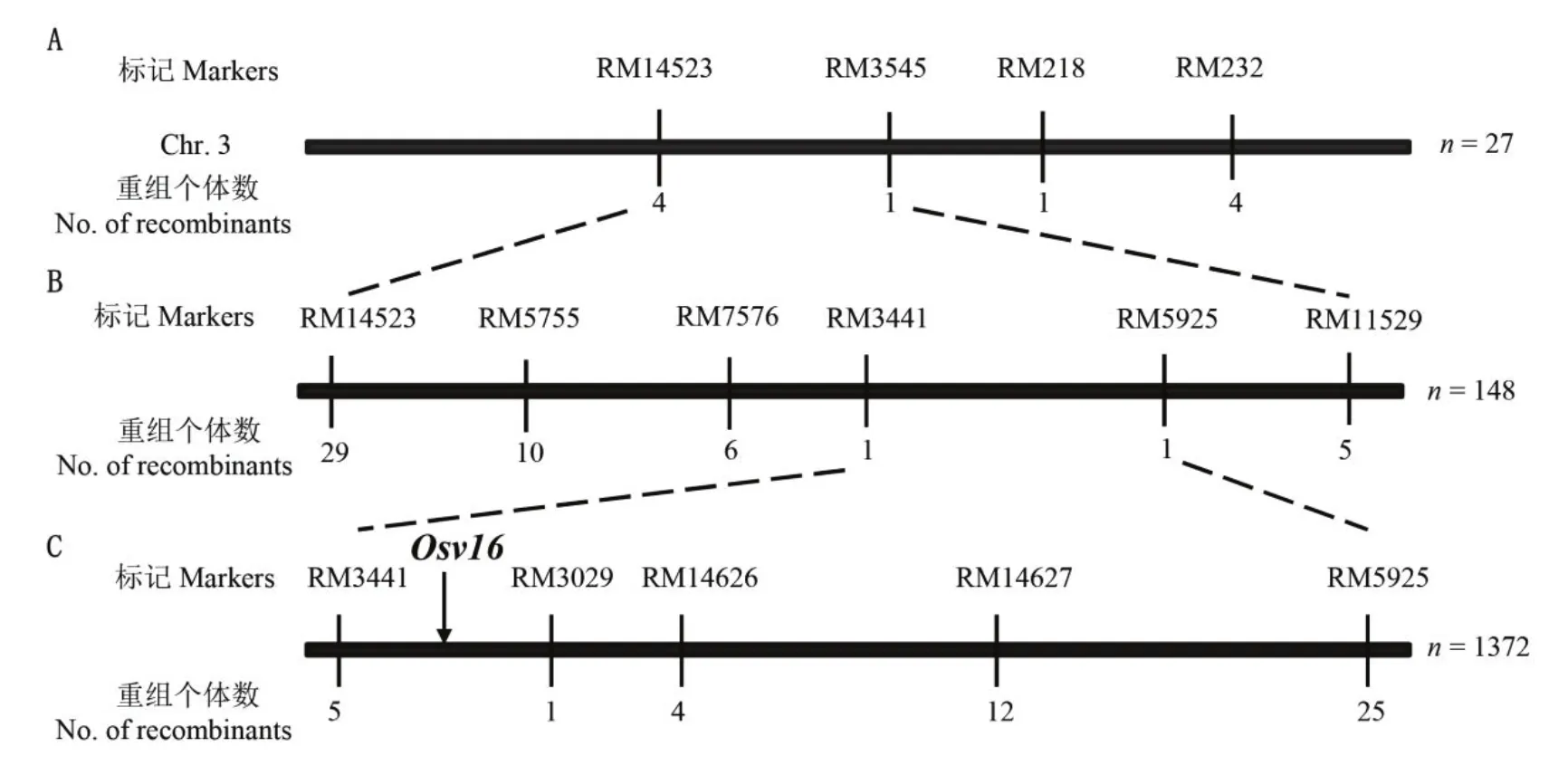
图3 白化转绿基因Osv16在第3染色体上的定位Fig. 3. Location of Osv16 on chromosome 3.

图4 穗顶端退化基因Ospaa10在第1染色体上的定位Fig. 4. Location of Ospaa10 on chromosome 1.
2.5 顶端退化基因Ospaa10定位
在vpa1/Moroberekan F2群体中构建正常穗型和顶端退化穗型DNA池各一个,采用分池法快速初步定位与顶端退化性状连锁的标记。其中,第 1染色体上RM23和RM3240在两个DNA池上表现多态,表明vpa1的顶端退化性状基因可能位于第1染色体上。用 RM23和 RM3240对来源于vpa1/Moroberekan F2中随机的30株顶端退化单株分析发现RM23存在11个单交换,RM3240存在13个单交换(图4-A)。在RM23和RM3240之间筛选得到3个亲本间多态标记(RM466、RM24和RM5),并结合RM23和RM3240对152个F2突变单株进行连锁分析,初步将vpa1的顶端退化基因定位于RMR24和RM5之间(图4-B),并命名为Ospaa10。在定位区间内进一步发展并鉴定获得 5个亲本间有多态的标记(RM11121、RM11134、RM11135、RM11157和 RM5972)。用这 5个标记和RM24、RM5对254株顶端退化单株进行分析,将Ospaa10基因定位于RM11157和RM5972之间,物理距离约190 kb(图4-C)。
3 讨论
突变体是遗传学研究必需的基础材料,在遗传育种、基因克隆及基因表达调控等研究中具有重要作用。EMS诱变具有技术简单、突变率高,能在短时间内获得大量突变体等优点,被广泛用于水稻突变体构建。EMS诱变获得的水稻突变体往往包含较多的突变位点,Wu等[24]对0.8%和1.0% EMS诱导产生的1000个M2单株用TILLING检测pp2A4和cal7两个基因,估算的突变密度为每Mb范围约有0.5个突变,而在1.6% EMS诱导的群体中突变密度则上升至约每1 Mb有1个突变。Henry等[25]利用全外显子测序的方法分析了72份M2水稻突变体,根据获得的突变位点预测共有超过 2700个突变位点可能改变基因功能。一旦这些基因功能的改变直接导致突变体的表型变化,则在大田环境下容易被鉴定获得。在本研究中,我们利用 EMS诱变获得的突变体vpa1兼有白化转绿叶和穗顶端退化两种明显的表型特征,遗传分析表明这两种性状并不是由一个基因突变引起的一因多效,而是受两个独立分离的隐性基因控制。类似vpa1,在水稻叶、穗等器官中发生变异的多基因突变体目前报道较少。
本研究中突变体vpa1中控制白化转绿性状的基因Osv16定位在第3染色体RM3441和RM3029之间,约125kb的物理区间内。目前第3染色体上已报道了多个白化转绿基因,蔡海亚等[6]将白化转绿基因gra3定位于RM14436和RM14450之间,约125 kb区间。刘喜等[7]将WGL的突变基因定位于RM6472和N3-15之间,约680 kb的物理距离内。通过图位克隆的方法在第3染色体上已鉴定了V1、V2和YSA三个白化转绿基因,V1基因编码1个定位于叶绿体的NUS1蛋白,NUS1蛋白主要参与叶绿体 RNA的代谢调控,其特异地在未成熟叶片上表达并促进叶片早期低温胁迫下质体遗传系统的建立[10,26]。V2基因编码1个定位于质体和线粒体的鸟苷酸激酶(pt/mt GK),其突变导致叶绿体分化过程受到抑制,pt/mt GK可能参与叶绿体蛋白的合成或装配[11,27]。YSA基因编码一个叶绿体定位的三角状五肽重复(PPR)蛋白,YSA基因突变致使突变体ysa三叶期前表现白化,后逐渐转绿,ysa的主要农艺性状与野生型培矮64S无明显差异,可作为标记性状直接用于杂交水稻生产[13]。简磊等[28]报道的白化转绿基因albg是ysa的等位基因,albg的株高、结实率等农艺性状显著低于野生型,说明YSA基因的不同位置突变对植株的影响并不一致。Osv16定位区间与已报道的基因位置均不重叠,可能是一个新的控制叶绿体发育的基因。
王斌等[14]利用1个籼粳交重组自交系群体在3个地点对穗顶端退化性状进行 QTL分析,仅在 1个点检测到位于第1染色体RM6451-OSR13区间的qASA1,这也表明穗顶端退化性状对环境条件敏感,可能受栽培条件及气候因子等影响。除了受数量性状控制外,dps1[17]、tut1[19]、cipk31[29]等突变体研究表明穗顶端退化性状主要受单隐性基因控制,但也有突变体的顶端退化性状受单个显性基因控制,如PAA2[30]。目前已知的穗顶端退化基因中,编码cAMP类受体蛋白的抑制因子的TUT1位于第1染色体[19]。本研究中vpa1的穗顶端退化性状受单隐性基因控制,顶端退化基因Ospaa10定位于第1染色体RM11157和RM5972之间,区间内尚未有其他顶端退化基因报道。
