新型铁铈复合氧化物催化臭氧氧化工艺去除对硝基苯酚
2021-01-20靳志豪黄远星付小洁胡守训杨俊豪
靳志豪,黄远星,付小洁,胡守训,杨俊豪,余 柳
(上海理工大学环境与建筑学院,上海 200093)
对硝基苯酚(4-硝基酚,p-nitrophenol,4-NP)是一种重要的有机合成原料,其应用范围涉及医学、农业、工业产品等许多领域[1]。作为一种典型的内分泌干扰物,4-NP进入生物体后会造成激素分泌失衡,影响生物正常的新陈代谢,其对水环境的影响程度也越来越高[2-3]。此外,作为医药和染料工业的重要中间体,4-NP具有难降解、毒性大等特点。美国环境保护局(EPA)已经将其列为水体中的优先污染物[4],同时它也是我国饮用水水质标准中的污染物控制指标之一[5]。目前,文献中报道过的去除4-NP的方法主要有氧化还原法[6]、生物降解法[7]、吸附法[8]、光催化法[9]等。
臭氧具有极强的氧化能力,不仅在消毒灭菌、除臭等方面具有显著优势,同时对于难降解有机废水具有极强的氧化降解能力[10]。臭氧易攻击有机物中的不饱和键,但与饱和有机物的反应速率较低,且难以将有机物彻底矿化成二氧化碳和水。催化臭氧法利用特定催化剂催化臭氧分解,产生具有极强氧化能力、无选择性的羟基自由基,从而快速将有机物彻底氧化,被广泛用于水中难降解有机污染物的深度去除中[11]。目前,催化臭氧技术主要是均相催化臭氧和非相催化臭氧。在反应体系中,常用到的均相催化剂一般为过渡金属离子,有Fe2+、Mn2+、Ni2+、Co2+、Cd2+、Cu2+、Ag+等。非均相催化剂制备过程简单,较易回收,且催化剂的催化活性很高,成本较低,较均相催化臭氧技术而言,具有明显的优势。金属氧化物可以作为非均相催化臭氧氧化的主要催化剂。常见的金属氧化物有TiO2、MnO2、Al2O3、ZnO及铁氧物等。其中,铁基材料由于毒性低、来源广、成本低及高稳定性等优点,涉及到众多领域。
本文采用水热法制备铁铈复合氧化物,并将之作为催化剂,催化臭氧氧化去除水中的4-NP,目的在于提高4-NP的矿化率,通过改变试验条件,以期研究臭氧浓度、催化剂投加量、初始pH、不同铁铈摩尔比对水中4-NP去除效果的影响,为含4-NP实际废水的处理提供理论基础。
1 材料及方法
1.1 材料及仪器
仪器:臭氧发生器(KX-S10型,上海康孝环保设备有限公司),马弗炉(SX2-4-13 N型,上海一恒科学仪器有限公司),总有机碳/总氮(TOC/TN)测定仪(Muliti N/C 3100型,德国耶拿公司),X射线衍射仪(D8 Advance 型,德国布鲁克公司),电子天平(PL-203型,梅特勒-托利多公司),真空干燥箱(DZF-6020型,上海一恒科学仪器有限公司),离子计(PXSJ-226型,上海仪电科学仪器股份有限公司)。
对硝基苯酚(4-NP,>99.0%),其他化学试剂[如Ce(NO3)3·6H2O、Fe(NO3)3·9H2O等]均为分析纯,购自国药集团化学试剂有限公司。
1.2 复合氧化物的制备
选用水热法制备复合氧化物,将所称得一定量的Ce(NO3)3·6H2O和Fe(NO3)3·9H2O溶于去离子水中,搅拌均匀后得到不同摩尔比的金属盐溶液。然后,将配好的溶液置于磁力搅拌器上,缓慢滴入5 mol/L的氨水,保持体系pH值在10左右。稳定后,将60 mL混合溶液转移到100 mL不锈钢高压釜中,180 ℃条件下反应48 h。冷却后,用蒸馏水洗涤样品数次至中性,并将复合氧化物在烘箱中烘干。最后,在500 ℃煅烧10 h,即可得到所需红色Fe2O3/CeO2复合氧化物。
1.3 臭氧试验
在室温下,试验反应溶液总体积为1.0 L,将0.8 g 4-NP溶于去离子水中,然后将溶解的4-NP溶液定溶于1 L的容量瓶中作为4-NP储备液,使用时按需求稀释相应的倍数。向初始浓度为20 mg/L的4-NP溶液中投加1.0 g的催化剂,打开臭氧发生器,由曝气头向反应溶液中通入臭氧/空气混合气体,并立即计时。臭氧气体流量可通过分流装置调节,以调节具体每个试验的臭氧投加量,溶液中的臭氧浓度采用靛蓝法检测[12]。然后,设置不同铁铈摩尔比催化臭氧氧化与单独臭氧氧化进行对比,确定最优铁铈摩尔比。通过控制变量法,改变试验条件,进行催化臭氧氧化4-NP的试验。每个反应过程持续60 min,分别在0、10、20、40、60 min取样。通入惰性气体吹脱水样中的臭氧后,经0.45 μm滤膜过滤去除固体催化剂,随即利用TOC分析仪测定水样TOC。所有试验均重复3次,最终数据取3次试验的平均值。表1为催化臭氧试验不同条件参数。

表1 催化臭氧试验不同条件参数Tab.1 Different Conditional Parameters of Catalytic Ozonation Test
2 结果与讨论
2.1 催化剂的XRD表征
图1是在相同条件下改变铁铈摩尔比合成的铁铈复合氧化物的X射线衍射图。由图1可知,所合成的材料衍射峰分别在2θ=24.1°、33.1°、35.6°、49.4°和54.0°以及在2θ=28.5°、33.0°与标准卡片Fe2O3(JCPDS No.33-0664)、CeO2(JCPDS No.34-0394)的X射线衍射图相吻合,说明合成的材料均是铁铈复合氧化物,且无其他杂峰的出现,即水热法制备的复合氧化物纯度较高。
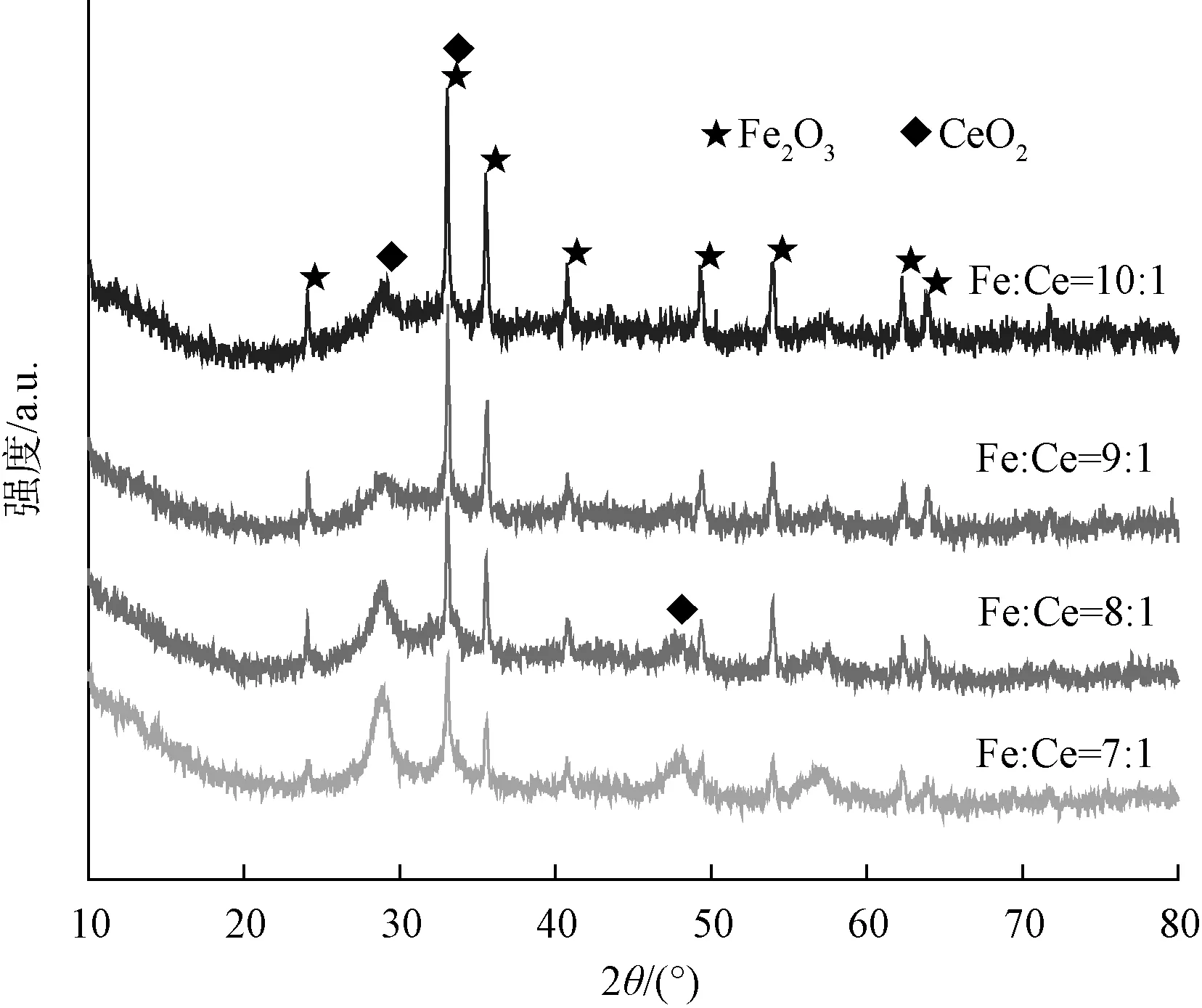
图1 铁铈复合氧化物的XRD图Fig.1 XRD Pattern of Fe-Ce Composite Oxide
2.2 不同催化臭氧氧化反应体系对4-NP去除效果的影响
在表1中①的试验条件下,研究复合氧化物吸附、单独臭氧氧化、氧化铁催化臭氧氧化(O3/Fe2O3)以及复合氧化物催化臭氧氧化(O3/Fe2O3/CeO2)4种反应体系对4-NP去除效果的影响。
如图2(a)所示,复合氧化物在60 min内对4-NP的吸附几乎无作用,此结果与Fe2O3/CeO2(7∶3)的表面性质相关。陈忠林等[13]的研究表明,催化剂表面的羟基基团易与亲电性的有机物吸附。然而,在未通入臭氧的情况下,催化剂表面无羟基基团和合适的吸附位点,其对4-NP几乎无吸附和降解作用。其余3种体系对4-NP的去除具有明显的效果。反应60 min内,单独臭氧氧化体系中,TOC的去除率为54.0%。在氧化铁催化臭氧氧化(O3/Fe2O3)体系下反应60 min,TOC的去除率为66.7%。在复合氧化物催化臭氧氧化体系下,TOC的去除率提高到了81.3%,比O3/Fe2O3体系时增加了14.6%。如图2(b)所示,不同摩尔比复合氧化物的降解曲线可通过一级动力学反应模型拟合出来。单独臭氧氧化、氧化铁催化臭氧氧化以及复合氧化物催化臭氧氧化反应体系下对应的降解曲线的反应速率常数分别为0.013、0.015、0.024 min-1。复合氧化物催化臭氧氧化体系对4-NP的去除具有很好的效果,Fe2O3/CeO2(7∶3)的加入明显提高了对4-NP的降解率。研究表明[14],在催化臭氧氧化反应体系下,复合氧化物加入后,臭氧在催化剂表面生成了强氧化性的羟基自由基(·OH),臭氧的利用效率明显提高,生成了更多的·OH。在反应40 min之后,降解效率趋于平缓,说明并不能将水中的有机物完全降解为水和二氧化碳,而是小部分有机物转变成了中间产物。

图2 不同催化臭氧氧化反应体系对4-NP去除效果的影响(a)及一级动力学反应速率常数(b)Fig.2 Effects of Different Catalytic Ozonation Reaction Systems on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b)
2.3 不同铁铈摩尔比对催化效果的影响
通过改变铁盐和铈盐的摩尔配比,合成Fe∶Ce为7∶3、8∶2、9∶1、10∶1这4种不同金属摩尔配比复合氧化物。在表1中②的试验条件下,分析比较4种不同摩尔比氧化物对4-NP去除效果的影响。
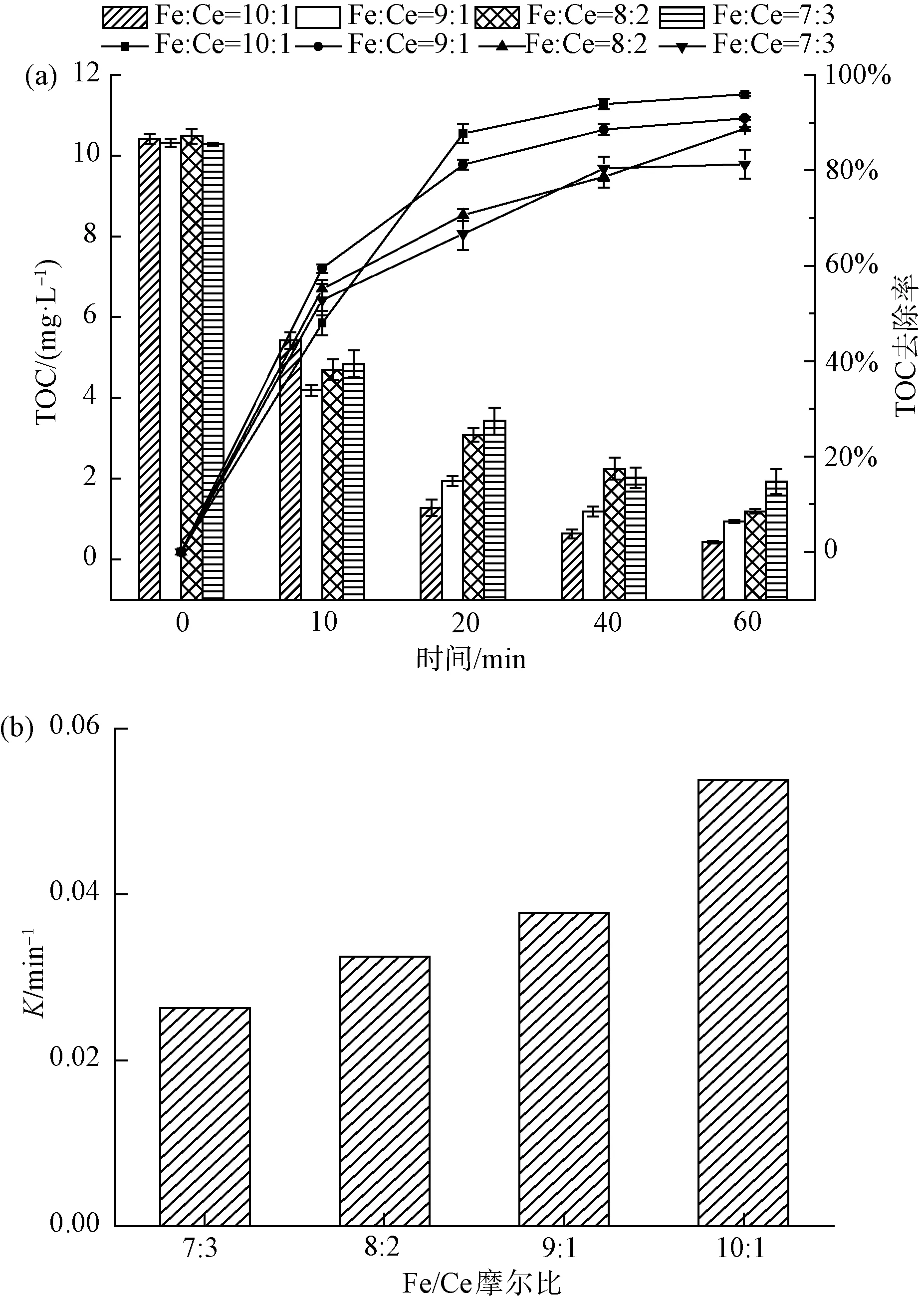
图3 不同铁铈摩尔比对4-NP去除效果的影响(a)及一级动力学反应速率常数(b)Fig.3 Effects of Different Fe-Ce Molar Ratios on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b)
如图3(a)所示,随着铁铈摩尔比的增加,4种复合氧化物对4-NP去除率也逐渐增加。其中,在催化臭氧氧化体系下反应60 min,当Fe∶Ce=7∶3时,TOC的去除率为81.3%;当Fe∶Ce=8∶2时,TOC的去除率为88.7%;当Fe∶Ce=9∶1时,TOC的去除率为90.9%;当Fe∶Ce=10∶1时,TOC的去除率提高到最大,为95.9%。此外,如图3(b)所示,不同摩尔比复合氧化物的降解曲线可通过一级动力学反应模型拟合出来,当Fe∶Ce为7∶3、8∶2、9∶1、10∶1时,降解曲线的反应速率常数分别为0.026、0.033、0.038、0.054 min-1,反应速率随着铁铈摩尔比的增加而加快。Li等[15]的研究表明,在一定范围内铁铈摩尔比增加,CeO2很好地分散在Fe2O3上,2种氧化物之间形成了很强的相互作用,在催化臭氧过程中,导致催化剂表面活性位点的增加,能吸附更多的臭氧,从而在催化臭氧过程中产生更多的·OH。综合表明,铁铈复合氧化物催化臭氧氧化效果与铁铈摩尔比有关,铁铈摩尔比为10∶1时的去除效果最佳。选用此比例复合氧化物作为催化剂进行后续试验。
2.4 水中臭氧浓度对4-NP去除效果的影响
在表1中③的试验条件下,选用Fe2O3/CeO2(10∶1)作为催化剂,改变通入水中的臭氧投加量,测得水中臭氧浓度分别为4.1、5.4、7.0 mg/L,分析比较水中臭氧浓度对4-NP去除效果的影响。

图4 水中臭氧浓度对4-NP去除效果的影响(a)及一级动力学反应速率常数(b)Fig.4 Effects of Ozone Concentration on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b)
2.5 水中初始pH对4-NP去除效果的影响
在表1中④的试验条件下,选用Fe2O3/CeO2(10∶1)作为催化剂,调节水中初始pH值为5.0、7.0、9.0,分析比较水中初始pH对4-NP去除效果的影响。
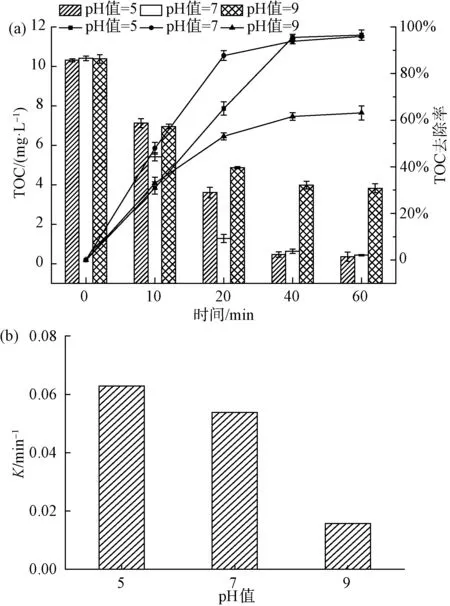
图5 水中初始pH对4-NP去除效果的影响(a)及一级动力学反应速率常数(b)Fig.5 Effects of Initial pH Value on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b)
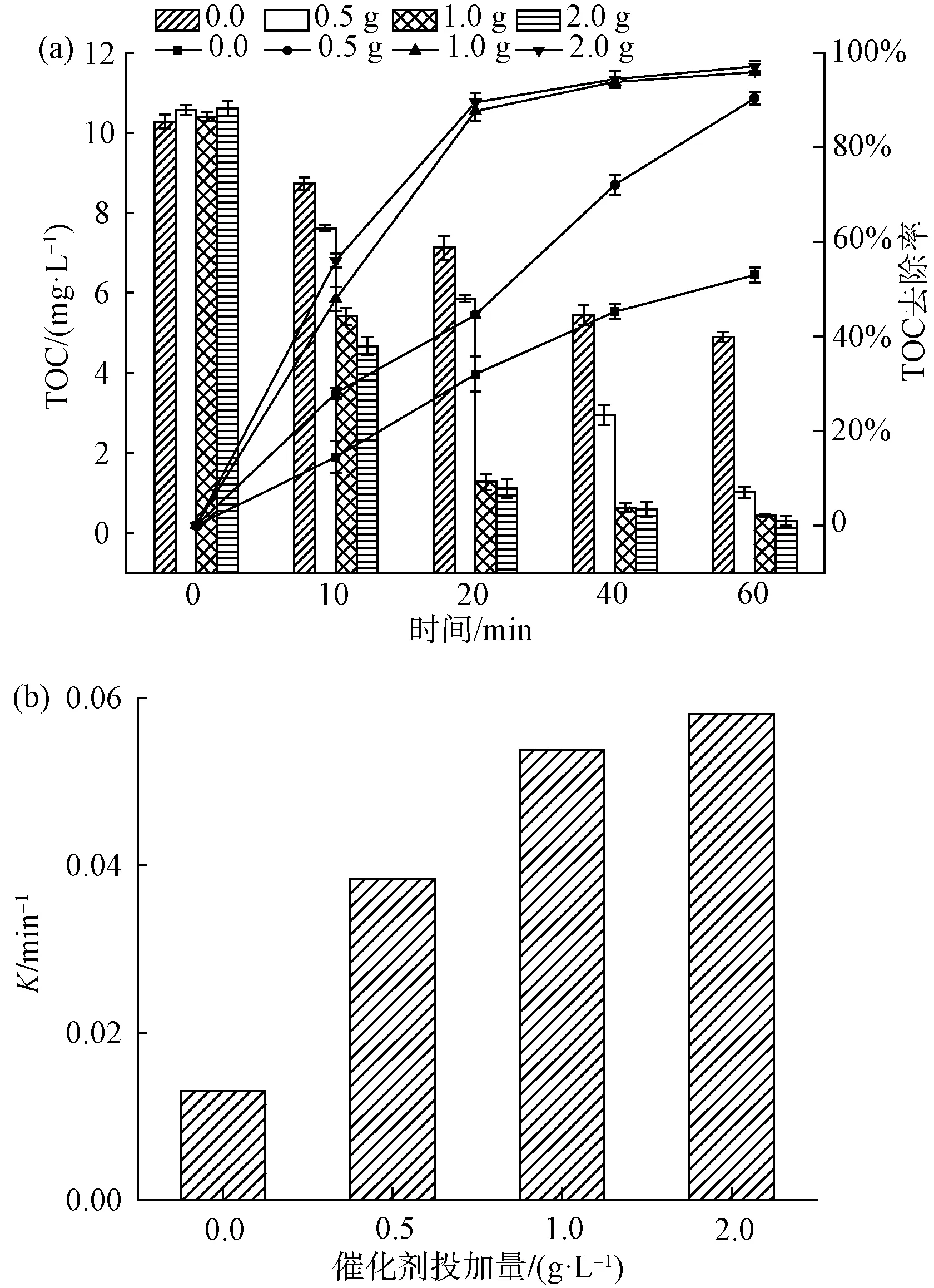
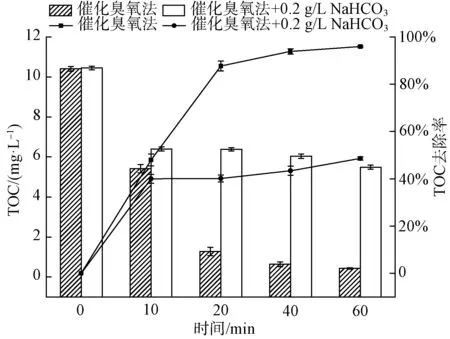
如图5(a)所示,当水中初始pH值为9.0时,TOC的去除率为63.1%;当水中初始pH值为5.0时,TOC的去除率提高到96.6%,与水中初始pH值为7.0时TOC的去除率(95.9%)相差甚小。如图5(b)所示,当pH值为5、7、9时,降解曲线的反应速率常数分别为0.063、0.054、0.016 min-1。研究表明[18],催化臭氧氧化体系受到催化剂表面的等电点以及臭氧氧化体系中发生的反应的影响。试验采用质量滴定法测得的催化剂等电点pHpzc=6.9[19],在pH接近pHpzc时,催化剂表现出最好的效果。在碱性条件下,当催化剂投加量不变时,Lewis酸性位点上的表面羟基基团数量不变。反应溶液pH升高,则OH-增加,竞争吸附于活性位点上,导致表面羟基基团减少,溶液中产生的·OH数量减少,最终使催化降解4-NP的效率降低,这与前面研究的pHpzc机理一致[20]。酸性条件下降解效果显著,原因可能是pH 在表1中⑤的试验条件下,选用Fe2O3/CeO2(10∶1)作为催化剂,改变催化剂的投加剂量,分析比较催化剂投加量对4-NP去除效果的影响。 如图6(a)所示,不投加催化剂,在催化臭氧氧化体系下反应60 min,TOC的去除率为53.0%;当催化剂的投加量为0.5 g/L时,TOC的去除率为90.4%;当催化剂的投加量分别为1.0 g/L和2.0 g/L时,对应的TOC的去除率为95.9%、97.2%,2种催化剂投加量下,去除率几乎无差异,4-NP基本降解完全。Yu等[21]的研究表明,采用MIL-88 A(Fe)催化臭氧化,对TOC去除率为38.7%,而本试验对TOC的去除率达到近97.2%,表明铁铈复合金属氧化物催化剂对4-NP的去除有较强的效果。由图6(b)可知,催化剂投加量为0.0、0.5、1.0、2.0 g/L所对应的降解曲线反应速率常数分别为0.013、0.038、0.054、0.058 1 min-1。陈炜彧等[22]的研究表明,催化剂的催化效果随着催化剂的增加而增加,其主要原因是在催化臭氧氧化过程中,随着Fe2O3/CeO2(10∶1)催化剂投加量的增加,催化剂浓度增加,催化剂表面为臭氧分子提供了更多的活性位点,产生的·OH也随之增加,从而提高了4-NP的去除效果。当催化剂投加量提高至2.0 g/L时,TOC去除率的增加趋于平缓,与投加1.0 g/L催化剂相比,反应速率常数仅提高了0.004 3 min-1。一方面可能是由于过量的催化剂导致自身发生复合作用,臭氧分子与催化剂表面的活性位点接触减少;另一方面,催化臭氧体系产生过量的·OH,导致其自身发生反应,从而降低体系中·OH的浓度。因此,出于TOC去除率以及经济成本的考虑,后续试验催化剂的最佳投加量为1.0 g/L。 图6 催化剂投加量对4-NP去除效果的影响(a)及一级动力学反应速率常数(b)Fig.6 Effects of Catalyst Dosage on 4-NP Removal(a) and First-Order Kinetic Reaction Rate Constant(b) Bai等[23]的研究表明,NaHCO3是一种强碱弱酸盐,作为·OH抑制剂,可以有效消耗催化臭氧氧化过程中产生的自由基,且NaHCO3不与臭氧发生反应。因此,在催化臭氧体系中添加NaHCO3,利用其与有机物的竞争反应,来验证催化臭氧过程中·OH 的作用。 图7 NaHCO3对4-NP去除效果的影响Fig.7 Effect of NaHCO3 on 4-NP Removal ·OH的浓度对去除污染物具有决定性的意义。因此,加入DMSO自由基捕集剂和2,4-二硝基苯肼制得DNPH-HCHO,通过HPLC间接测量·OH的浓度[24]。在实验室条件下,DMSO浓度为250 mmol/L、催化剂投加量为1.0 g/L、臭氧浓度为7.0 mg/L、初始pH值为7.0时,单独臭氧与催化剂催化臭氧,·OH生成量如图8所示。 图8 ·OH的累积量Fig.8 Accumulative Amount of Hydroxyl Radical 在单独臭氧体系中反应60 min,·OH的累计生成量为13.34 μmol,这是由于臭氧在水中分解产生少量的·OH。催化剂催化臭氧体系中反应60 min,·OH的累计生成量为22.8 μmol。TOC降解曲线也相对应地出现了明显的差异,间接证实了催化臭氧产生的·OH进一步矿化有机物,导致TOC降解效率的提高。 本文采用水热法制备的新型铁铈复合氧化物作为催化剂,对催化臭氧氧化去除4-NP进行了试验研究,得出以下主要结论。 (1)在探究不同反应体系对4-NP去除效果的过程中,发现催化臭氧体系去除4-NP效率显著高于吸附和单独臭氧氧化法,且铁铈复合氧化物催化效率远高于单独的氧化铁。 (2)在本文研究的条件范围内,随着铁铈摩尔比的增加,复合氧化物催化臭氧氧化法对4-NP的去除率逐渐增大。 (3)以Fe2O3/CeO2(10∶1)为催化剂的催化臭氧氧化体系对4-NP有很好的去除率。4-NP的去除率受到铁铈摩尔比、臭氧浓度、催化剂投加量和体系初始pH的影响。试验表明,在一定范围内,4-NP去除率随着铁铈摩尔比、臭氧浓度和催化剂投加量的增加而提高。 (4)最佳组合工艺条件:铁铈摩尔比为10∶1,臭氧浓度为7.0 mg/L,催化剂投加量为1 g/L,初始pH值为7.0。催化剂在重复使用5次后,去除率仍维持在92.1%,所制备的催化剂未出现钝化现象,具有较好的稳定性。 (5)铁铈复合氧化物催化臭氧体系中加入自由基抑制剂NaHCO3后,4-NP去除率显著降低,说明·OH在催化臭氧氧化4-NP过程中起主导作用。另外,间接检测了催化臭氧过程中·OH浓度的变化,使得试验结果更具说服力。2.6 催化剂投加量对4-NP去除效果的影响
2.7 添加抑制剂对4-NP去除效果的影响

2.8 催化臭氧过程中·OH浓度变化

3 结论
