miR-141对于宫颈癌微环境改变的研究
2021-01-14林荣春林浩亮彭永排谢庆生梁金晓姚婷婷
林荣春 林浩亮 彭永排 谢庆生 梁金晓 姚婷婷
宫颈癌是最常见的妇科恶性肿瘤之一,其发 生是一个多因素、多阶段和多基因的过程,涉及大量的结构性变化和肿瘤相关基因的异常表达。因此,研究宫颈癌发生发展的分子机制,选择有效的治疗靶点对尤为重要。
MicroRNAs(miRNAs)是一种高度保守的非编码小RNA。大多数成熟的miRNAs 通过剪切靶信使RNA(mRNAs)或通过与mRNA 的3’-UTRs 结合来抑制mRNA 的翻译,抑制基因表达[1]。越来越多的研究表明,miRNAs 在肿瘤细胞的增殖、凋亡、侵袭和迁移中发挥重要作用,并参与了肿瘤的形成。
hsa-miR-141 是miR-200 家族的一员,miR-200家族成员下调所引起的肿瘤组织上皮间充质转化(epithelial mesenchymal transition,EMT)被认为是肿瘤形成的重要机制之一[2]。此外,miR-141 参与血管生成的网络调控,并能抗肿瘤血管生成[3]。但目前文献缺乏对miR-141 参与宫颈癌发生、发展的分子机制的研究。而基于微阵列的基因表达谱技术已被广泛应用于分析基因在组织和细胞中的表达差异和调控功能,为探索肿瘤发生的分子机制提供了极大的便利。故本研究将采用基于微阵列的基因表达谱技术检测下调miR-141 后SiHa 和HeLa 细胞中差异表达基因,筛选与宫颈癌发生发展相关的基因组,分析差异基因的功能,以探索miR-141 与宫颈癌发生、发展的关系。
1 材料和方法
1.1 细胞培养 人类宫颈癌细胞系SiHa 和HeLa是从美国ATCC 细胞库购买,用含有100 IU/mL 青霉素G,100 mg/mL 链霉素,10%胎牛血清的DMEM培养基培养在37℃含有5%二氧化碳的培养箱中。
1.2 RNA 转染 合成小干扰RNA(siRNA)用于敲低miR-141,使用Lipofectamine 3000 将RNA 转染到10 cm 培养皿中培养的宫颈癌细胞中。转染48 h后使用Trizol 试剂提取总RNA。
1.3 主要实验设备 22K 人类基因组阵列由北京博奥生物提供,其中21329 个Oligo DNA 选自Operon 公司2.1 版的人类基因组Oligo 位点。另外193个Oligo DNA 人工合成。利用LuxScan 10 KA 双通道激光扫描仪对基因芯片进行扫描。所得数据用LuxScan 3.0 分析。
1.4 微阵列芯片制备 对于每个样品,1μl RNA用于分光光度计测试260 nm/280 nm 浓度和纯度。甲醛凝胶电泳进行RNA 质量控制(图1)。
取提取的RNA 4 μL 添加到50 μl 逆转录反应体系,用于芯片制备。样品用cRNA 荧光标记、纯化、干燥后用于杂交。我们将HeLa-1 和SiHa-1 定义为miR-141 下调样本,将HeLa-2 和SiHa-2 定义为阴性对照样本。分别用cy5-2 dUTP 标记HeLa-1、SiHa-1 的mRNA。用cy3-2 dUTP 标记HeLa-2、Si-Ha-2 的mRNA。经乙醇沉淀后将两者混合溶解在5X 柠檬酸钠缓冲液(SSC)+0.2%十二烷基硫酸钠(SDS)杂交液20 μL 中,42℃杂交过夜。盖玻片封片,置于密封舱内60℃杂交16 h。然后依次以2×SSC+0.2%SDS 溶 液、0.1%SSC+0.2%SDS 溶 液 及0.1%SSC 溶液各洗涤10 min,室温下晾干。用Lux-Scan 10K/A 扫描芯片,分别提取基因表达的荧光信号强度值Cy5 和Cy3,用预先选定的内参照基因对Cy5 和Cy3 值进行标准化处理。
1.5 基因表达分析,GO通路分析,KEGG分析 差异基因选择标准:①IV 信号值≥1500;②Ratio(Cy5/Cy3)≥2 或≤0.5,分别包括了表达上调或下调的基因。挑选两组宫颈癌细胞中差异表达基因,在g:Profiler 网站中行GO 功能富集分析及KEGG pathway 分 析(https://biit.cs.ut.ee/gprofiler/gost)。使 用g:Profiler 推荐的g:SCS 阈值0.05 为显著性阈值,g:SCS<0.05 的GO、KEGG 富集通路视为有统计学意义。
1.6 基因集富集分析(Gene set enrichment analysis,GSEA) 为弥补GO 分析、KEGG pathway 分析在统计学方面的缺点,使用GSEA 4.1.0 软件进行基因集富集分析。指定HALLMARK 功能集为预设基因集。置换检验次数为的1000 次,当P 值小于0.05、多重假设检验错误发现率(FDR)小于0.05 时认为此基因集的富集有统计学意义。
2 结 果
所有样品提取的总RNA 为16.35-18.34 μg,吸光度值260 nm/280 nm 在2.09-2.10 之间。所有RNA 样品的浓度和纯度均在正常范围内。RNA 电泳条带清晰,28 S 比18 S 条带亮度大于1:1,质量合格,数量充足。(图1)
图1 RNA 甲醛修饰凝胶电泳 从左到右分别是SiHa-1a、HeLa-1、SiHa-2、HeLa-2、SiHa-1b;条带清晰,28 S 的亮度大于18 S
根据上述统计标准,我们的结果显示,在HeLa-1 和HeLa-2 之间有23 个差异表达基因(表1)。1例上调,22 例下调。SiHa-1 和SiHa-2 之间有80 个差异表达基因(表2)。52 个为上调基因,28 个为下调基因。杂交散点图见图2。
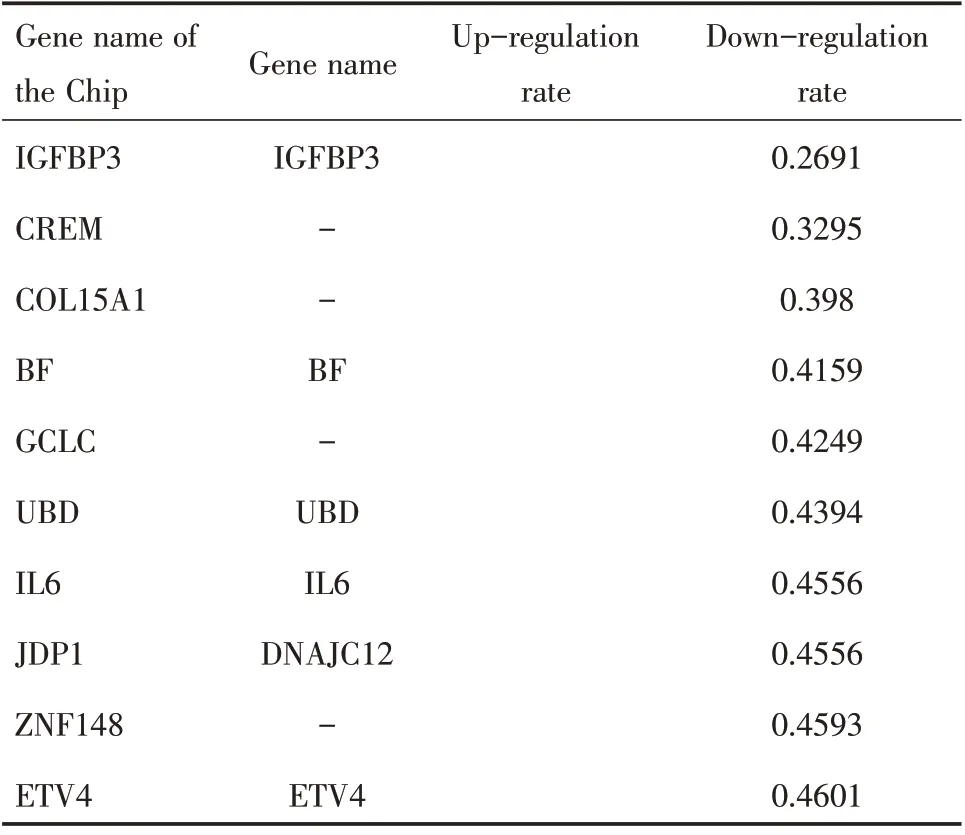
表1 miR-141 下调HeLa 细胞部分差异表达基因
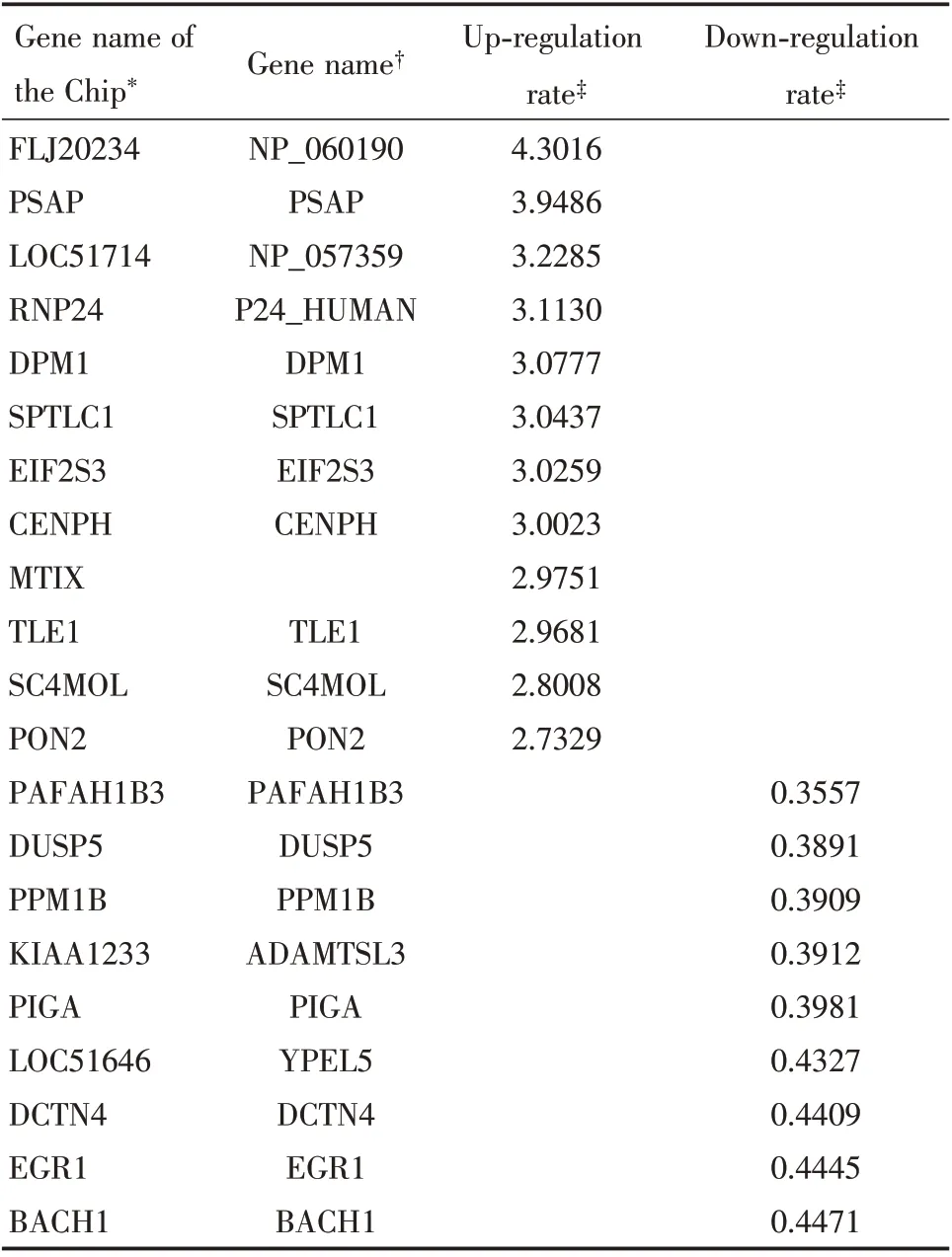
表2 miR-141 下调的SiHa 细胞中部分差异表达基因
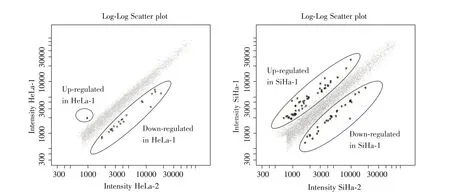
图2 miR-141 下调HeLa 与SiHa 细胞基因差异表达散点图 左图为HeLa-1 vs. HeLa-2,右图为SiHa-1 vs. SiHa-2。图中灰点为非差异表达基因,圈中黑点为差异表达基因;各图左上方圈中为在miR-141 下调细胞中高表达的基因,右下方圈中为在miR-141 下调细胞中低表达的基因。
对上述差异表达的基因行GO、KEGG 通路分析(图3)。在miR-141 下调HeLa 细胞的KEGG 通路分析中,提示肿瘤转录失调通路富集,GO 分析中未见显著富集的基因功能集。在miR-141 下调的SiHa 细胞差异表达基因的GO 分析中,分子功能方面的钙黏蛋白连接以及细胞组分方面中的细胞-基底连接、锚定连接均有富集;但KEGG 通路分析未见显著富集的通路。
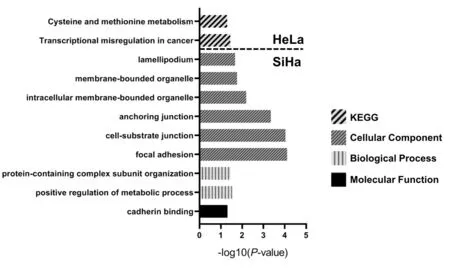
图3 miR-141 下调HeLa 与SiHa 细胞的GO、KEGG 分析 虚线上方为miR-141 下调的HeLa 细胞差异表达基因的KEGG 通路分析;虚线下方为miR-141 下调的SiHa 细胞差异表达基因的GO 分析
基因集富集分析的结果显示,有6 组基因集明显富集于阴性对照的HeLa 细胞,分别是TNFα-NFκB 通路调控基因集、亚铁血红素代谢与有核红细胞分化基因集、乏氧相关基因集、蛋白分泌基因集、免疫应答基因集与紫外线辐照后表达下降的基因集(图4)。miR-141 下调的SiHa 细胞与阴性对照间未发现符合设定P 值及FDR 值的基因集富集。对上述富集基因集行领头亚集分析(Leading Edge Analysis),与肿瘤相关的3 个基因集(TNFα-NFκB 通路调控基因集、乏氧相关基因集、免疫应答基因集)中对富集得分起重大作用的基因有所重叠(图5),其中3 个基因集中均出现的基因有SERPINE1、IL-6、F3 和PLAUR。
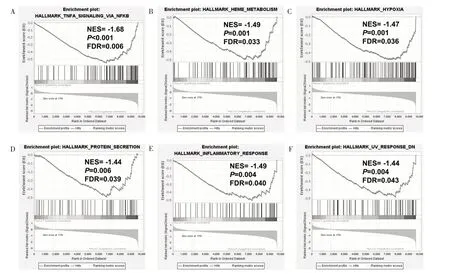
图4 miR 下调的HeLa 细胞的基因集富集分析结果 A. TNFα-NFκB 通路调控基因集,B. 亚铁血红素代谢与有核红细胞分化基因集,C.乏氧相关基因集,D.蛋白分泌基因集,E.免疫应答基因集,F.紫外线辐照后表达下降的基因集。缩写:标化后的富集得分(Normalized enrichment score,NES),错误发现率(False Discovery Rate,FDR)。NES 为负数提示此基因集富集于阴性对照细胞。

图5 miR 下调的HeLa 细胞富集基因集的领头亚集分析基因热图 热图行由上至下分别为TNFα-NFκB 通路调控基因集、免疫应答基因集、乏氧相关基因集;热图列则为领头亚集中的基因。图中方格颜色越深,说明此基因在HeLa 阴性对照细胞中表达越高。
3 讨 论
本课题组前期研究发现hsa-miR-141 在宫颈癌细胞中显著上调[4],其在宫颈癌中的生物学效应也与其他瘤种中的不同,表现为促进宫颈癌细胞增殖、侵袭、EMT[5],本研究结果亦支持前人观点。对SiHa 细胞的GO 分析结果提示,钙黏蛋白、细胞基底连接、锚定连接等细胞连接相关的功能集富集,提示miR-141 在宫颈癌SiHa 细胞的EMT中有潜在作用。GSEA 结果提示,在HeLa 细胞中下调miR-141 后,与肿瘤形成相关的基因集,诸如TNFα-NFκB 通路基因集、乏氧所激活的基因集在阴性对照HeLa 细胞中富集。既往研究提示TNFα可以通过NFκB/Twist1 通路诱导HeLa 细胞系的EMT,并使之具有肿瘤干细胞样的特点[6];乏氧环境可以通过TGF-β 诱导的EMT 机制促进HeLa、Si-Ha 细胞系肿瘤细胞的迁移、侵袭及黏附能力[7]。这些提示miR-141 可能通过TNFα-NFκB 通路、乏氧通路增强宫颈癌HeLa 细胞的增殖、侵袭能力。
在miR-141 下调的HeLa 细胞中,炎症因子IL-6的表达亦下调,而GSEA领头亚集分析分析中,IL-6 也是3 条富集的基因集领头亚集中共有的基因。研究表明,高危型HPV 的E6、E7 蛋白可使宫颈癌细胞IL-6 表达上调;过表达的IL-6 蛋白通过自分泌、旁分泌形式诱导STAT3 磷酸化,从而减少宫颈癌细胞凋亡并促进其增殖[8]。此外,IL-6-STAT3 通路可激活VEGF 介导的新血管生成,并促进宫颈癌的发生[9]。在高危型HPV 感染的宫颈癌的肿瘤相关成纤维细胞中,E6 蛋白可以激活IL-6-STAT3 信号通路,以自分泌、旁分泌的形式促进成纤维细胞衰老以使肿瘤生长[10]。说明miR-141 可能介由IL-6-STAT3 通路参与调控宫颈癌的肿瘤免疫微环境网络,并影响肿瘤的血管生成。
本研究使用基于微阵列的基因表达谱分析来探索miR-141 在宫颈癌发生中的作用,在mRNA 水平进行生物信息学为主的分析,未行体内外实验,可能存在一些不足之处。例如转录后调控使mRNA 水平不能完全代表病理免疫组化结果以及外泌蛋白水平;又因基因表达谱的复杂性,仅从生物信息学角度出发难以全面反映细胞内真实的通路改变。因此,我们将在后续工作中通过体内外试验进一步探索miR-141 对宫颈癌细胞系增殖、浸润、血管生成、EMT 以及肿瘤微环境等方面的影响。
综合以上结果,我们认为miR-141 在宫颈癌肿瘤形成中的作用与miR-200 家族传统认知上的生物效应相反,miR-141 可能通过TNFα-NFκB 通路、乏氧通路参与宫颈癌的上皮间充质转化,并通过IL-6 通路影响血管生成,从而促进宫颈癌的发生与发展,有望成为新的宫颈癌预后标志物及治疗靶点。
